不同提取时间的艳山姜挥发油组分分析及其抑菌活性研究
邹月,黄金凤,魏琴,单谦,沈子豪,邓超,王芹
(1.宜宾学院 生命科学与食品工程学院 香料植物资源开发与利用四川省高校重点实验室,四川 宜宾 644000;2.西华大学 食品与生物工程学院,成都 610039)
艳山姜(AlpiniazerumbetBurtt. et Smith)为姜科山姜属植物,广泛分布于中国东南部至西南部各省区。除作为观赏植物外,其果实具有重要的药用价值,如在2003版《贵州省中药材、民族药材质量标准》中介绍其主治心腹冷痛、胸腹胀满、消化不良、呕吐腹泻等症状[1]。艳山姜果实挥发油中α-蒎烯、莰烯、1,8-桉叶油醇及β-蒎烯等作为其主要活性物质基础[2],具有一定的抗炎、镇痛、防治心血管系统疾病和抑制因高糖诱导的疾病作用[3,4]。近年来,随着种植面积扩大[5],产量逐年增加,国内学者常使用GC-MS研究其化学成分,如张成川等通过分析艳山姜各部位化学成分发现其中含有许多热不稳定物质[6,7],故不同提取时间所得艳山姜挥发油化学成分有所差异,简单地以提取率为目的的提取工艺无法合理地利用此资源。而使用GC-MS仅能检测到样品中化学成分的种类及其含量,不能像电子鼻一样在较短的时间从整体上无损地对样品风味进行分析,同时艳山姜果实挥发油的抗菌活性研究较少。
故本实验结合GC-MS和电子鼻对不同提取时间的艳山姜挥发油的化学物质进行检测,通过主成分分析(principal component analysis,PCA)对其成分进行分析[8],比较分析其抗菌活性,旨在揭示不同提取时间所得化合物变化情况及其抑菌效果的差异。为进一步完善艳山姜果实挥发油提取工艺和提高其医用等价值提供更加科学的依据,为艳山姜资源开发和产业化发展提供一定的理论依据和技术支撑。
1 材料与方法
1.1 实验材料与仪器
1.1.1 材料与试剂
艳山姜:干果,采自广西省邕宁区,将艳山姜在干燥箱中40 ℃烘干,研磨成粉末过40目筛储存。二氯甲烷:HPLC,成都科隆化学品有限公司;无水硫酸钠:西陇科学股份有限公司;肉汤培养基:广东环凯微生物科技有限公司;LB培养基:杭州百思生物技术有限公司;其他化学试剂:均为分析纯。
1.1.2 仪器
Agilent 7890A/5975C型气相色谱-质谱联用仪(GC-MS) 美国安捷伦公司;ME203电子天平 梅特勒-托利多仪器(上海)有限公司;Pen3型电子鼻 德国 Airsense 公司;LRH-250恒温培养箱 上海齐欣科学仪器有限公司。
1.1.3 菌种
供试病原菌菌株:金黄色葡萄球菌(StaphylococcusaureusCICC 21600);福氏志贺氏菌(ShigellaflexneriCICC 21534);肠炎沙门氏菌(SalmonellaenteritidisCICC 21513);出血性大肠埃希氏菌(EscherichiacoliEHEC CICC 21530),由北京城市学院梁寒峭课题组和北京科技大学刘洋课题组提供。
1.2 供试品溶液的制备
取40 g艳山姜粉末置于1000 mL挥发油提取器中,加水混匀,浸泡1 h,使用水蒸气蒸馏法提取挥发油[9],选取挥发油得率为0.385~0.438 mL的时间(2,3,4,5,7,8 h)。停止加热后,待提取器中油水自然分层时,取出上层油状物质,加入适量无水硫酸钠,静止过夜,干燥待用。
1.3 电子鼻分析
吸取精油0.1 mL加入25 mL 旋口顶空瓶中密封,在50 ℃恒温30 min后上样分析。样品的检测参数:进样量200 mL/min,进样时间60 s,延滞时间300 s。当传感器接触到样品挥发物后,电导率G会发生改变,且G与初始电导率G0的比值也随之变化。响应气体浓度越大[10],G/G0的值越偏离1(大于或小于1)。
1.4 GC-MS分析
1.4.1 样品制备
将7个时间提取的挥发油经无水硫酸钠干燥后,加适量二氯甲烷稀释样品溶液,经 0.22 μm 微孔滤膜过滤,进行成分分析。
1.4.2 GC条件
HP-5MS毛细管色谱柱(30 m×250 μm×0.25 μm);载气(He);流速1 mL/min,不分流进样,进样口温度220 ℃;柱温60 ℃用于0 min,然后以10 ℃/min 升温到 190 ℃,保持 2 min;再以5 ℃/min升温到 210 ℃。保持2 min;然后以10 ℃/min升温到220 ℃,保持8 min,运行30 min。
1.4.3 MS条件
接口温度280 ℃;离子源温度230 ℃;电子电离源;电子能量70 eV;质量扫描范围45~300 amu。
1.5 抑菌实验
1.5.1 样品制备1.5.1.1 菌液制备
将金黄色葡萄球菌、芽孢杆菌、沙门氏菌、志贺氏菌于肉汤培养基中培养2代后配制成1×108CFU/mL菌悬液,备用。
1.5.1.2 抗菌液制备
取提取时间为2,3,4,5,6,7,8 h的挥发油各0.1 mL用二甲基亚砜(DMSO)稀释10倍,配制成100 μL/mL挥发油抗菌液。
1.5.2 最小抑菌浓度(MIC)和最小杀菌浓度(MBC)[11]
将96 孔培养板用体积分数95%乙醇溶液浸泡1 h后晾干,备用。配制1×103CFU/mL的4 种菌液,备用。在96孔培养板中用二倍稀释法配制11个浓度梯度[12]。用移液枪往孔中分别注入11个浓度梯度抗菌液50 μL,肉汤培养基130 μL,4种菌液20 μL,得11个抗菌液浓度梯度25~0.024 μL/mL培养液,每个梯度重复3次,以空白培养基和DMSO作为对照。接种后,放于37 ℃恒温培养箱中培养20 h后取出观察,将用肉眼看小孔内澄清即在小孔内完全抑制细菌生长的最低药物浓度记作MIC。从完全无菌生长的孔内移取50 μL液体涂板,做3个重复,然后将培养皿放入37 ℃的培养箱中培养24 h,平板完全没有菌生长出的最低浓度记作MBC。
2 结果与分析
2.1 电子鼻实验结果分析
若某个传感器响应值越远离1,它在样品风味形成中占据越重要的地位,反之,若越接近1则它在样品风味形成中占据的地位越低。检测到的各个时间段挥发油气味数据见图1。


图1 电子鼻艳山姜挥发油气味响应曲线(a为2 h,b为8 h)Fig.1 Response curves of flavor of volatile oils fromAlpinia zerumbet by e-nose
注:a为2 h,b为8 h。
在该电子鼻所有的10根金属氧化物传感器中[13],艳山姜挥发油在W1S出现最高的响应值,该传感器对甲烷敏感,W2S、W5S上出现较高的响应值,两种传感器分别对醇类和氮氧化合物灵敏,故推测甲基类、醇类、氮氧化合物等物质为该挥发油的主要化合物。由该结果可知,挥发油中可能存在部分GC-MS未检测出的氮氧化合物和硫化物,具体情况还需做进一步研究。

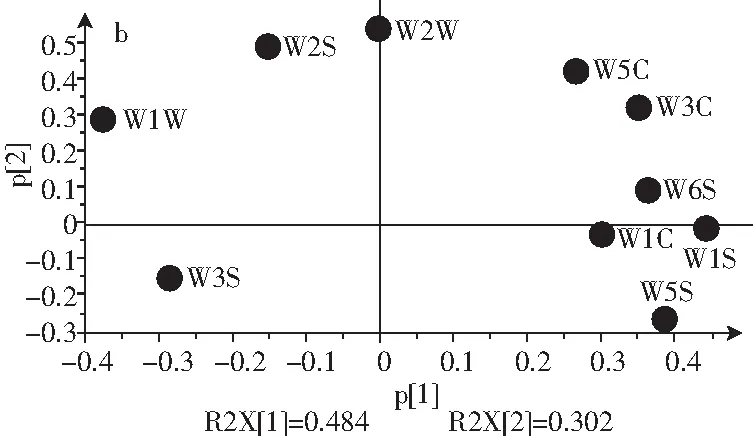
图2 艳山姜挥发油电子鼻PCA的得分图(a)和载荷图(b)Fig.2 Scoring plot (a) and loading plot (b) of volatile oils from Alpinia zerumbet byelectronic nose and PCA
选取平稳时间段55~57 s的数据进行主成分分析,将数据导入SIMCA 14-1软件中进行PCA分析。由图2可知,PCA将数据降维后第一主成分贡献率为48.4%,第二主成分贡献率为30.2%,第一主成分和第二主成分总贡献率为78.6%,能代表大部分挥发油电子特征信息。在PCA分析中将7个样品分为3类:第一类:2 h,第二类:3~7 h,第三类:8 h。Loading图表示每个传感器在区分样品时的相对重要性。在第一主成分上,因W5S、W1S、W1W在载荷图上贡献值较大,即可知氮氧化合物、甲烷、硫化物可能为样品区分为3类的主要差异物质,在第二成分上5 h,6~8 h存在差异,主要是W2W、W2S、W6S贡献值不同,即有机硫化物、乙醇、氢气含量不同所致。
2.2 GC-MS实验结果分析
GC-MS 共分离出38个化合物,通过 NIST 质谱库检索结合相关文献[14,15],确定化合物名称,用色谱峰面积归一化法计算挥发油成分的相对质量分数,总共鉴定出36种化合物,均占挥发油总量的97.9%以上,结果见表1。

表1 不同提取时间艳山姜挥发油成分分析Table 1 Composition analysis of volatile oils from Alpinia zerumbet at different extraction time

续 表
艳山姜挥发油主要由单帖类(C10Hn)和倍半萜类(C15Hn)组成[16],其中单帖类9种(18.44%~33.92%),倍半萜24种(63.33%~78.63%),其他物质仅有3种(1.62%~2.25%)。其中(-)-β-杜松烯、α-毕橙茄醇、tau-Muurolol、1,8-桉叶油醇、β-蒎烯、石竹烯为艳山姜果实挥发油主要的化学成分。4 h前沸点的高低会对化合物提取造成影响,低沸点的单帖类在2 h和3 h时含量高于其他时间,高沸点的倍半萜类在2 h和3 h时含量低于其他时间,故可认为不同时间提取的艳山姜果实挥发油的差异主要表现在单帖类和倍半萜的相对含量不同。

图3 艳山姜挥发油化合物PCA得分图Fig.3 PCA scoring plot of volatile oil compounds from Alpinia zerumbet
对7个时间提取挥发油的GC-MS数据进行PCA分析,由图3可知,第一主成分(PC-1)方差贡献率为67.9%,第二主成分(PC-2)方差贡献率为12.0%,累计贡献率为79.9%,包含了样品大部分信息。7个时间所提取的挥发油因化合物成分不同而区分开,可将此分为4类,分别为2 h,3 h,4~7 h,8 h。

表2 GC-MS 特征向量矩阵Table 2 GC-MS eigenvector matrix

续 表
由表2可知,4-萜烯醇(0.200)、1,8-桉叶油醇(0.200)、(-)-α-依兰油烯(-0.199),β-蒎烯(0.198)在第一主成分具有较大载荷,其中1,8-桉叶油醇含量在7.39%~14.9%之间,β-蒎烯含量在4.82%~11.65%之间,在区分2 h与其他时间气味差异时起重要作用,2-异丙基-5-甲基-9-亚甲基双环[4.4.0]DEC-1-烯(0.436),α-依兰油烯(-0.350)在第二主成分具有较大载荷,在区分8 h,3 h与4~7 h上起到重要作用。
2.3 挥发油抑菌结果分析
植物挥发油富含萜类化合物,可通过破坏其细胞膜对微生物产生抑制作用[17]。本研究中,艳山姜挥发油中含有的大量萜烯和萜醇[18],如1,8-桉叶油醇、β-蒎烯、石竹烯、橙花叔醇等具有一定的抑菌活性。不同时间提取的艳山姜挥发油对各致病菌的MIC,MBC浓度见表3。

表3 艳山姜挥发油抑菌实验结果Table 3 Bacteriostatic test results of volatile oils from Alpinia zerumbet μL/mL
两个对照培养基中均有菌种生长,排除了DMSO的抑菌影响。由表3可知,艳山姜挥发油对所试3种阴性菌MIC的浓度(6.25~12.5 μL/mL)明显高于金黄色葡萄球菌的MIC浓度(0.024~0.781 μL/mL),说明艳山姜挥发油对4种供试菌均表现出抑菌活性,且对金黄色葡萄球菌的抑菌活性最佳。乔明锋等[19]在研究花椒挥发油时发现其对阳性菌的抑制作用明显,对阴性菌的抑菌活性较小,故可推测艳山姜果实挥发油对阳性菌的抑制效果优于阴性菌。陈建烟在探究其叶片挥发油的抑菌活性时发现金黄色葡萄球菌的抑菌活性与大肠杆菌相同,故可推测艳山姜果实与叶的抑菌效果可能不同,可对此做进一步研究。
比较各时间所得挥发油的抑菌效果可得,2 h的挥发油对志贺氏菌的抑制效果最佳,MIC=6.25 μL/mL,MBC≤6.25 μL/mL,而此时1,8-桉叶油醇、β-蒎烯的浓度与其他提取时间相比最高,故1,8-桉叶油醇、β-蒎烯可能是艳山姜挥发油对志贺氏菌发生抑菌活性的主要化合物;6 h的挥发油对沙门氏菌的抑制效果最佳,MIC=12.5 μL/mL,MBC≤12.5 μL/mL;除2,7 h的挥发油抑菌效果较差外,其余时间所提取的挥发油对大肠杆菌的抑制效果均为MIC=12.5 μL/mL,MBC≤25 μL/mL;提取8 h的挥发油对金黄色葡萄球菌的抑制效果最佳,MIC=0.024 μL/mL,MBC≤0.024 μL/mL,而此时1,8-桉叶油醇、β-蒎烯的浓度与其他提取时间相比最低,故1,8-桉叶油醇、β-蒎烯是艳山姜挥发油对金黄色葡萄球菌发生抑菌作用的过程中不发挥主要作用的主要化合物。8 h的挥发油抑菌效果略优于其他组,不同时间提取的挥发油抑菌效果存在差异,可能是其中化合物含量不同导致的。
3 结论
由本实验电子鼻结果可知艳山姜挥发油在传感器W1S、W2S、W5S出现较高的响应值,说明甲基类、醇类、氮氧化合物等物质是该挥发油的主要化合物。结合PCA可将7个样品分为三类:第一类2 h,第二类3~7 h,第三类8 h。
利用GC-MS从艳山姜挥发油中共鉴定出36种挥发性物质。在分析不同时间提取的艳山姜果实挥发油的差异时,主要表现在单帖类和倍半萜的相对含量不同。结合PCA对样品做进一步分析,可将样品分为四类,分别为2 h,3 h,4~7 h,8 h,较电子鼻的分类更具体,可能是电子鼻对风味较接近的样品分类效果没有GC-MS灵敏所致。
抗菌实验表明艳山姜挥发油对4种供试菌均有抑菌活性。不同时间提取所得挥发油对不同细菌的抑制效果不同,提取8 h的挥发油抑菌效果略优于其他组。
本研究通过结合电子鼻的无损检测方法、GC-MS、抑菌实验探索不同时间提取的艳山姜挥发油的差异,并进行了定性定量的差异描述,发现电子鼻在区分差异较大的样品时拥有无损、快速、简单等优势,后续可通过结合GC-MS去改进电子鼻检测方法,以达到准确、快速区分不同样品的目的。

