褪黑素对PDGF诱导的肝星状细胞中JAK2/STAT3信号通路的影响
岳彩飞,洪汝涛,徐德祥,陈艳梅
(1.安徽医科大学第一附属医院消化内科,合肥 230022;2.安徽医科大学毒理学系,合肥 230032)
肝纤维化已被认为是一个严重的公共卫生问题,是由多种病因(包括肝炎病毒、毒素、药物、酒精和自身免疫性疾病等)引起的创伤愈合过程[1]。肝纤维化过程中,肝星状细胞(hepatic stellate cell,HSC)首先激活并增殖,产生大量细胞外基质(extracellular matrix,ECM)[2],因此抑制HSC的激活和增殖是预防和治疗肝纤维的重要方法。HSC的激活是由大量的炎性细胞因子和生长因子介导,其中血小板衍生生长因子(platelet derived growth factor,PDGF)是HSC中最有效的有丝分裂增殖细胞因子之一,对HSC的增殖、迁移、趋化等发挥关键作用[3]。PDGF与HSC质膜上的PDGFR特异性结合,从而激活JAK2/STAT3信号通路,致使HSC增殖,并抑制HSC凋亡。大量研究[4-5]已证实,褪黑素对肝纤维大鼠具有保护作用,其机制可能与其抗氧化活性及抑制相关信号通路有关。然而,褪黑素对PDGF诱导的HSC中的JAK2/Stat3通路的影响尚未被研究。本课题以PDGF诱导肝纤维化模型,探讨褪黑素对HSC-T6细胞中 JAK2/ STAT3信号通路的影响。
1 材料与方法
1.1 材料
1.1.1细胞与试剂 DMEM购自美国Hyclone公司;HSC-T6细胞购自南京凯基生物科技发展公司;褪黑素、MTT购自美国Sigma公司;PDGF购自美国PeproTech公司;BCA蛋白定量试剂盒、RIPA裂解液、蛋白酶抑制剂、DMSO、胰酶消化液、青霉素/链霉素购自上海碧云天生物技术有限公司;抗JAK2抗体、抗p-JAK2抗体、抗STAT3抗体、抗p-STAT3抗体购自英国Abcam公司。
1.1.2仪器 CO2恒温培养箱(Thermo Forma 3111,美国Thermo公司);Tanon-5200成像系统(上海天能科技有限公司);电泳仪(mini protean 3 cell,美国BIO-RAD公司)。
1.2 方法
1.2.1细胞培养 HSC-T6细胞用含10%的胎牛血清,1%青霉素/链霉素 的DMEM高糖培养基,置于37 ℃,5% CO2的培养箱中进行培养,d 2换液,2~3 d传代一次,收集对数期细胞进行后续实验。
1.2.2MTT实验 将处于对数生长期的细胞经胰蛋白酶消化,显微镜下计数后制成5×104个细胞/mL的细胞悬液。分别取100 μL至96孔培养板,接种3个同样的孔作为复孔。次日按照以下分组处理细胞:对照组(PBS)、模型组(PDGF,10 μg·L-1)、褪黑素低浓度组(PDGF+1 nmol·L-1MEL),褪黑素中浓度组(PDGF+1 μmol·L-1MEL)、褪黑素高浓度组(PDGF+0.1 mmol·L-1MEL),抑制剂组(PDGF+AG490),每组设置3个复孔。分别于药物作用0、24、48、72、96 h后每孔加入MTT溶液(5 g·L-1)20 μL,再加入180 μL无血清培养基。置于37 ℃,5% CO2培养箱孵育4 h后,吸弃孔内的上清液。每孔加150 μL DMSO,震荡10 min。用酶标仪测定490 nm波长各孔吸光度(optical density,OD)值。
1.2.3细胞免疫组化实验 将各组制成的细胞爬片用PBS洗去培养基,再用4%甲醛固定30 min,PBS洗3 min×3次;加3% H2O2,PBS冲洗3 min×3次,1% BSA封闭1 h,PBS洗3 min×3次;滴加一抗后湿盒孵育于4 ℃冰箱孵育过夜;滴加HRP标记广谱二抗,湿盒孵育,室温下放置20 min后,PBS冲洗3 min×3次;再用DAB染色,苏木素复染2 min后,再经过冲洗晒干及封片,镜下观察,采集分析相关部位,放大200倍拍照,用Image-Pro Plus软件分析结果。
1.2.4Western blot实验 将处于对数生长期的细胞经胰蛋白酶消化后接种于培养瓶,细胞分组、干预同1.2.2。作用48 h后从培养箱中取出细胞,吸去培养液,适量预冷的1×PBS洗涤2次,吸去PBS,加入含有蛋白酶抑制剂的RIPA裂解液,4 ℃充分裂解细胞,将细胞刮入1.5 mL EP管中,12 000 r·min-1离心 10 min,获得蛋白;采用BCA法进行蛋白质定量,每孔上样量约为20 μg蛋白;然后加入到10% SDS-PAGE蛋白凝胶上样孔内,120 V 电泳60 min,之后将蛋白质转移至PVDF膜上,5%脱脂奶粉(检测磷酸化蛋白用BSA)室温封闭1 h,根据说明书JAK2 1 ∶5 000;p-JAK2 1 ∶1 000;STAT3 1 ∶1 000;p-STAT3 1 ∶2 000;GAPDH 1 ∶10 000稀释抗体,抗体加入封闭液中稀释到所需浓度,4 ℃冰箱孵育过夜,次日孵育一抗的膜用TBST洗涤3次,每次5 min。随后根据用量,按照1 ∶10 000稀释HRP标记的二抗,与膜37 ℃孵育1 h,30 min后加ECL显色液显影。用磷酸化蛋白与非磷酸化蛋白的平均灰度值比值表示蛋白表达水平。
1.3 统计学处理采用SPSS 22.0软件进行分析,多组间比较采用单因素方差分析,两组间比较采用t检验。
2 结果
2.1 褪黑素对PDGF激活的HSC-T6细胞增殖的影响利用MTT法检测细胞增殖,与对照组比较,模型组OD值增加(F=79.13,P<0.01);与模型组比较,褪黑素低、中、高浓度组及抑制剂组的OD值呈下降趋势(F=79.13,P<0.01)。见Fig 1。
2.2 细胞免疫组化检测褪黑素对PDGF诱导的HSC-T6细胞中p-JAK2、p-STAT3蛋白的表达p-JAK2蛋白主要在胞质中表达,而p-STAT3蛋白主要在胞核中表达。与对照组比较,模型组中p-JAK2、p-STAT3蛋白表达差异有统计学意义(tp-JAK2= 6.177,P=0.003 5;tp-STAT3=10.45,P=0.000 5);与模型组比较,褪黑素低(tp-JAK2=3.76,P=0.019 8;tp-STAT3=4.497,P=0.010 8)、中(tp-JAK2=4.85,P=0.008 3;tp-STAT3=6.858,P=0.002 4)、高实验组(tp-JAK2=6.792,P=0.002 5;tp-STAT3=10.56,P=0.000 5)以及抑制剂组(tp-JAK2=7.922,P=0.001 4;tp-STAT3=1 087,P=0.000 4)p-JAK2、p-STAT3蛋白表达差异有统计学意义(P<0.05),并且随着褪黑素浓度增加p-JAK2、p-STAT3表达的抑制作用逐渐增强。见Fig 2、3。
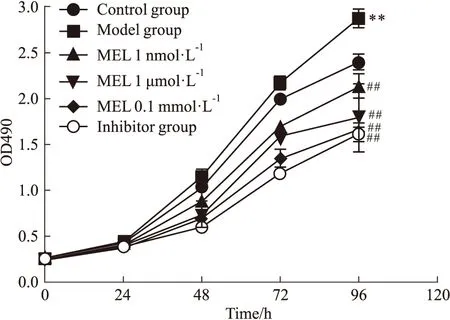
Fig 1 Effect of melatonin on proliferation of HSC-T6
**P<0.01vscontrol group;##P<0.01vsmodel group.
2.3 Western blot检测褪黑素对PDGF诱导的HSC-T6细胞中p-JAK2、p-STAT3蛋白的表达的影响与对照组比较:模型组HSC-T6细胞中p-JAK2、p-STAT3蛋白的表达增强(tp-JAK2/JAK2=8.192,P=0.001 2;tp-STAT3/STAT3= 21.53,P<0.000 1);与模型组比较,褪黑素低(tp-JAK2/JAK2=3.28,P=0.032;tp-STAT3/STAT3=6.06,P=0.003 7)、中(tp-JAK2/JAK2=5.31,P=0.006;tp-STAT3/STAT3=7.89,P=0.001 4)、高浓度组(tp-JAK2/JAK2=11.07,P=0.000 4;tp-STAT3/STAT3=17.93,P<0.000 1)以及抑制剂组(tp-JAK2/JAK2=12.66,P=0.000 2;tp-STAT3/STAT3=22.39,P<0.000 1)HSC-T6细胞中p-JAK2、p-STAT3蛋白表达水平降低,并随着褪黑素浓度升高蛋白表达量逐渐下降。见Fig 4。

Fig 2 Effect of melatonin on p-JAK2 protein expression by
A: Control group;B: Model group;C: MEL 1 nmol·L-1;D: MEL 1 μmol·L-1;E:MEL 0.1 mmol·L-1;F:Inhibitor group;**P<0.01vscontrol group;#P<0.05,##P<0.01vsmodel group.
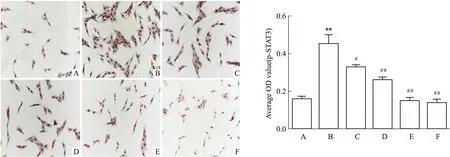
Fig 3 Effect of melatonin on p-STAT3 protein expression by
A:Control group;B:Model group;C:MEL 1 nmol·L-1;D:MEL 1 μmol·L-1;E:MEL 0.1 mmol·L-1;F:Inhibitor group;**P<0.01vscontrol group;#P<0.05,##P<0.01vsmodel group.
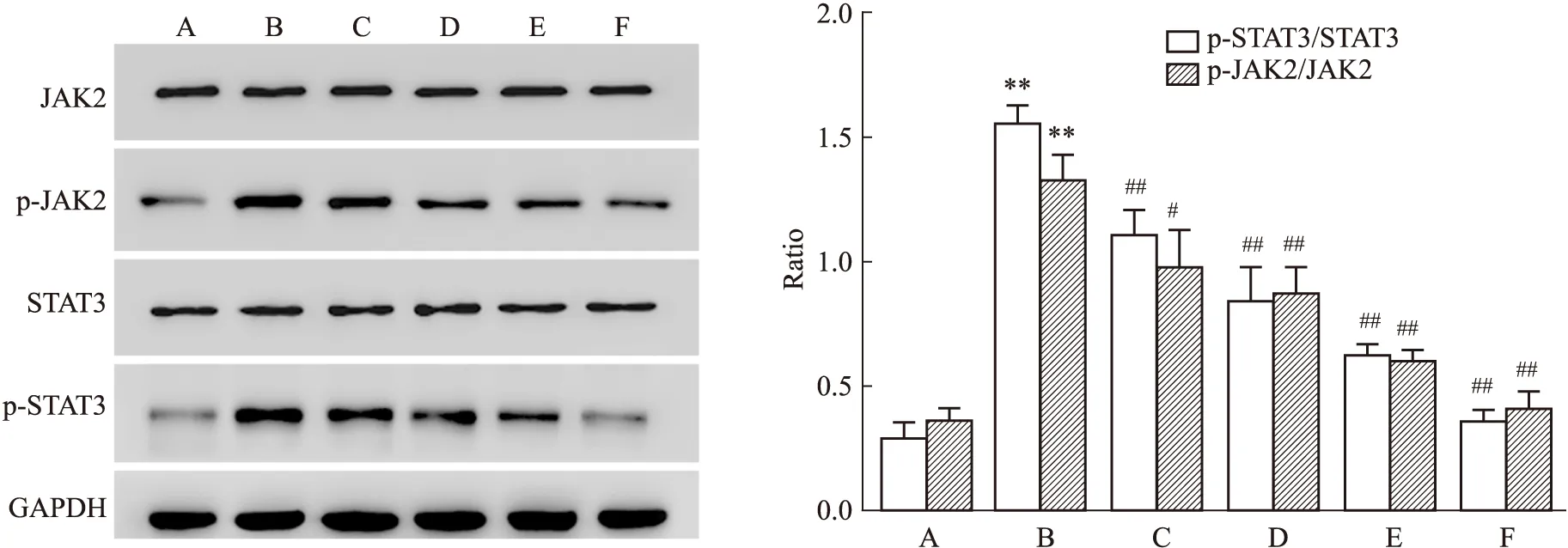
Fig 4 Effect of melatonin on expression of p-JAK2 and p-STAT3 proteins by Western
A:Control group;B:Model group;C:MEL 1 nmol·L-1;D:MEL 1 μmol·L-1;E:MEL 0.1 mmol·L-1;F:Inhibitor group;**P<0.01vscontrol group;#P<0.05,##P<0.01vsmodel group.
3 讨论
肝纤维化是多种慢性肝病的病理组成部分,HSC是肝脏中主要的胶原生成细胞,其活化促进肝纤维化[6]。因此,如果能够抑制HSC的活化和增殖,理论上可以减少甚至逆转肝纤维化的发生和发展。PDGF-BB是目前已知的最强的促进HSC活化的细胞因子之一,位于HSC质膜上的PDGFR是PDGF跨膜传递的关键环节[7]。JAK2/STAT3信号通路是一条多种细胞因子共用的信号传导途径,广泛参与细胞增殖、分化、凋亡等过程[8-9]。该信号通路被激活后,使得STAT3 发生磷酸化并形成二聚体,转移到细胞核后,与 DNA 上的特定序列结合,诱导相应基因的表达,使HSC活化增殖,最终导致肝纤维化。AG490 能够特异性抑制JAK2 的酪氨酸磷酸化,从而阻断STAT3的磷酸化,最终抑制HSC的活化增殖[10]。
褪黑素又称松果体素,是一种生命必需的吲哚胺类物质,人体中褪黑素具有增强免疫力、延缓衰老、调节昼夜节律等作用,近年来研究[4,11]显示,其对肝损伤模型有较强的保护作用,但是其具体机制尚不明确。而褪黑素对PDGF诱导的肝星状细胞JAK2/STAT3信号通路的影响国内外尚未见报道。
本课题组前期实验[5]已经证实,褪黑素浓度增加至1 mmol·L-1,HSC增殖显著被抑制,以及参照Shajari等[12]的褪黑素通过视黄酸相关孤儿核受体介导5-脂氧合酶抑制HSC增殖实验中的褪黑素浓度,因此采用1 nmol·L-1、1 μmol·L-1和0.1 mmol·L-1作为实验组褪黑素的药物浓度,该实验研究结果显示采用PDGF浓度为10 μg·L-1可激活HSC-T6细胞,与Wang等[13]用该浓度PDGF激活HSC相一致。MTT实验证明褪黑素可明显抑制PDGF激活的HSC-T6细胞的增殖;免疫组化实验和Western blot实验结果显示PDGF能显著激活HSC-T6细胞中p-JAK2、p-STAT3蛋白的表达,而褪黑素实验组及抑制剂组HSC-T6细胞中的p-JAK2、p-STAT3蛋白的表达量呈下降趋势,且随褪黑素浓度的升高下降水平越明显,提示肝纤维化过程中JAK2/STAT3信号通路被激活,并且褪黑素能够抑制该通路。
综上所述,褪黑素可抑制PDGF诱导的HSC的活化与增殖,其机制可能与抑制JAK2/STAT3信号通路有关,这可能是褪黑素改善肝纤维化的机制之一;此项研究为抑制肝纤维化提供新的治疗靶点。
(感谢安徽医科大学公共学院毒理学实验室徐德祥院长、王取南老师、王华老师、付林师兄等在实验中给予我的无私支持和帮助。感谢安徽医科大学第一附属医院中心试验室所有老师在免疫组化上给予我的支持和帮助。感谢安徽医科大学第一附属医院消化内科杨仁俊、范圆圆、刘浩波、陈艳梅等在细胞培养上给予我的支持和帮助。)

