Th17细胞在类风湿关节炎发病机制中的作用研究进展
李 鑫,蔡 雄,刘 良
(湖南中医药大学1.中医诊断学湖南省重点实验室、2.中药粉体与创新药物省部共建国家重点实验室培育基地,湖南 长沙 410208;3. 澳门科技大学中药质量研究国家重点实验室,澳门 氹仔 999078)
类风湿关节炎(rheumatoid arthritis,RA)是一种慢性炎症性自身免疫疾病,其主要病理特征为进行性关节滑膜炎症,软骨和骨破坏,最终造成关节畸形和功能丧失[1]。研究表明,RA是以大量CD4+T细胞浸润为主的慢性滑膜炎症反应,CD4+T细胞作为效应T细胞的重要成分,参与免疫应答过程的各个阶段,其介导的免疫反应异常被认为是RA主要发病机制之一[2]。根据其产生的细胞因子及其功能,通常将CD4+T 细胞分为辅助性T细胞1 (helper T 1,Th1)、Th2、Th17和调节性T细胞 (regulatory T cell,Treg)四大亚群。Th17细胞主要分泌IL-17、IL-21等炎性细胞因子,具有促进炎性反应和促进关节软骨和骨破坏进程等多重效应。因此,本文拟收集近年来Th 17细胞参与RA发病的相关研究进展并进行综述,以期为RA病理机制研究提供参考。
1 Th17细胞概述
在免疫应答的不同阶段,因抗原性质、局部微环境等因素的综合效应,CD4+T细胞会朝不同方向分化,进而发挥其特定的生物学效应。Th17 细胞是CD4+T细胞新亚群,其主要分泌白介素IL-17A、IL-17F、IL-21等细胞因子,并表达转录因子维甲酸相关孤核受体(retinoid acid-related orphan receptorγ,RORγt)和RORα,而在自身免疫疾病中发挥重要作用。
在树突细胞、单核细胞等抗原呈递细胞作用下,IL-6协同低浓度的转化生长因子-β(transforming growth factor β,TGF-β),激活JAK1,进而招募信号传导及转录激活因子-3 (signal transducer and activator of transcription-3,STAT3),并使其磷酸化,活化的JAK1/STAT3通路激活RORγt,并促进IL-21产生[3]。在IL-6和IL-21协同作用下,产生IL-23R、RORα 和RORγt,使Naive CD4+T细胞向Th17细胞分化[4],并抑制转录因子叉头蛋白3 (forkhead box protein 3,Foxp3)的负向调节作用。Th17细胞被转录因子STAT4和STAT6调控,生成 IL-17,同时可产生IL-23、IL-6 和肿瘤坏死因子-α (tumor necrosis factorα,TNF-α)等炎性细胞因子,IL-23可促进激活的记忆细胞产生IL-17,使Th17细胞得以存活和维持功能[5]。见Fig 1。
2 Th17细胞在RA滑膜炎症反应中的作用
RA早期主要表现为大量CD4+T细胞浸润为主的慢性滑膜炎症反应。IL-17是RA早期重要细胞之一,具有强大的促炎效应,大量、广泛表达于在RA患者关节滑液、滑膜组织、外周血、外周淋巴结等处[6]。RA患者发病前外周血IL-17表达水平显著高于发病后,RA患者(病程<12月)外周血IL-17表达量相当高,且与C-反应蛋白(C-reactive protein,CRP)呈正相关[7]。RA患者血清Th17水平显著升高,且与疾病活动性评分28 (disease activity score 28,DAS28)呈正相关[8]。RA患者外周血Th 17、IL-6、IL-17、IL-21表达量随疾病活动程度增加而增加[9]。RA患者外周血单个核细胞Th17细胞中趋化因子受体6(chemokine receptors 6,CCR6)和RORγt表达量显著增加,且关节滑液单核细胞Th17细胞比例显著高于外周血单个核细胞[10]。树突细胞可分泌IL-In the presence of antigen-presenting cells such as dendritic cells and monocytes,IL-6 is synergized with low-concentration TGF-β to activate JAK1,and then activated JAK1 recruits and phosphorates STAT3. JAK1/STAT3 signaling activates RORγt and promotes production of IL-21.Under the circumstance of abundant IL-6 and IL-21,naive CD4+T cells differentiate into Th17 cells,and simultaneously negative regulation of Foxp3 to this differentiation is inhibited. Transcription factors STAT4 and STAT6 regulate Th17 cells to produce pro-inflammatory cytokines IL-23,IL-6,and TNF-α.IL-23 promotes activated memory CD4+T cells to produce IL-17 which in turn maintain the survival and function of Th17 cells.

Fig 1 Pathway of differentiation of naive CD4+ T cells into Th17 cells
23促进IL-17的增殖,而参与RA风湿结节的形成[5]。胶原性关节炎(collagen induced arthritis,CIA)大鼠关节滑膜及外周血IL-17显著升高,外周血RORγt显著增加[11]。CIA小鼠血浆IL-17、外周血和脾脏Th17细胞比例,CD4+T细胞IL-17 mRNA表达水平均显著增加[12]。IL-17可协同IL-1β和TNF-α共同诱导T细胞和树突细胞的趋化[13]。IL-17协同TNF-α促进成纤维样滑膜细胞(fibroblast-like synoviocytes,FLSs)和上皮细胞大量分泌IL-6、IL-8、前列腺素E2(prostaglandin E,PGE2)和中性粒细胞化学引诱物[13]。上述研究表明,Th17细胞在外周血、关节滑液等部位均有表达,不仅参与了RA发病,而且与疾病活动程度及临床检测指标密切相关。
IL-21是Th17细胞分泌的促炎性细胞因子,大量表达于CD4+T细胞及FLSs。RA患者关节滑液中CD4+IL-21+T细胞比例显著增加,外周血CD4+IL-21+T细胞及血清IL-21与DAS28、抗-CCP抗体、血沉和类风湿因子呈正相关[14,15]。IL-21通过抑制Foxp3表达,上调RORC而促进Th17细胞分化与增殖[16]。研究显示,联合阻断IL-6和IL-21可有效抑制CIA小鼠脾脏CD4+Th17细胞分化,进而减轻疾病严重程度[4]。IL-21/IL-21R可介导磷脂酰肌醇3-激酶/蛋白激酶B (phosphoinosmde-3-kinase/protein kinase B,PI3K/PKB) PI3K/Akt促进IL-23表达而促进RA-FLS异常增殖[17]。IL-21通过丝裂原活化蛋白激酶 (mitogen-activated protein kinase,MAPK)、STAT3及PI3K/Akt通路介导FLS分泌TNF-α、IL-6等促炎性细胞因子[18]。
3 Th17细胞在RA骨破坏中的作用
关节软骨的破坏及骨侵蚀是RA进展期重要组织学特征。研究表明,破骨细胞是介导RA骨破坏的关键细胞,核因子-κB受体活化因子配基 (receptor activator of nuclear factor-κ B ligand,RANKL)是破骨细胞生成的启动信号。CD4+T细胞介导的免疫应答在RA骨破坏中具有重要作用。IL-17A/F通过上调Runt相关转录因子-2 (runt-related transcription factor,RUNX2)蛋白,增强IL-6蛋白和基质金属蛋白酶-3 (matrix metalloproteinase-3,MMP-3)mRNA表达而抑制RA关节软骨的产生潜能[19]。骨桥蛋白可促进成骨细胞中IL-17表达而引起CIA小鼠骨质侵蚀[20]。IL-17通过活化IL-17/IL-17R/STATS-3信号通路促进RANKL表达,抑制骨保护素 (osteoprotegerin,OPG)表达而介导佐剂性关节炎(adjuvant induced arthritis,AIA)大鼠FLS破骨细胞分化[21]。RA患者骨髓血浆中IL-17A/F及CD3+CD4+IL-17+细胞百分比较骨关节炎患者显著升高,提示骨髓微环境可以促进Th17细胞和IL-17A/F过度产生而介导RA破坏[4]。IL-17 促进K/BxN小鼠体内人分泌型卷曲相关蛋白 1 (secreted frizzled related protein,sFRP1) 分泌,减少 sFRP3 的分泌,进而抑Wnt/β-catenin/RUNX2 通路,负调控成骨细胞生成[22]。IL-17通过诱导软骨MMP-3表达而抑制关节滑膜和软骨细胞COL2A1表达而促进骨破坏[23]。综上,IL-17主要通过以下途径参与RA骨破坏:(1)促进RANKL表达,进而促进破骨细胞分化;(2)促进MMPs表达,进而降解骨细胞外基质,引起骨破坏;(3)抑制成骨细胞生成。见Fig 2。
IL-21促进FLS的RANKL表达而介导破骨细胞生成[24]。IL-21促进FLS分泌介导RA骨与关节软骨破坏的关键蛋白酶MMP1、MMP2、MMP3、MMP9、MMP13而介导,其中MMP3、MMP9的活化与PI3K、 STAT-3及细胞外调节蛋白激酶 (extracellular regulated protein kinase 1/2,ERK1/2)有关[25]。IL-21/IL-21R相互作用可活化PI3K/Akt通路介导活化T细胞核因子1蛋白 (nuclear factor of activated T-cells,NFATc1)及骨吸收相关因子组织蛋白酶k (cathepsin K)和抗酒石酸酸性磷酸酶 (tartrate-resistant acid phosphatase,TRAP)表达进而介导骨破坏[17]。综上,IL-21参与RA骨破坏的途径主要有:(1)促进MMPs表达,进而降解骨细胞外基质,引起骨破坏;(2)调节骨吸收相关因子的表达;(3)促进破骨细胞分化。见Fig 2。
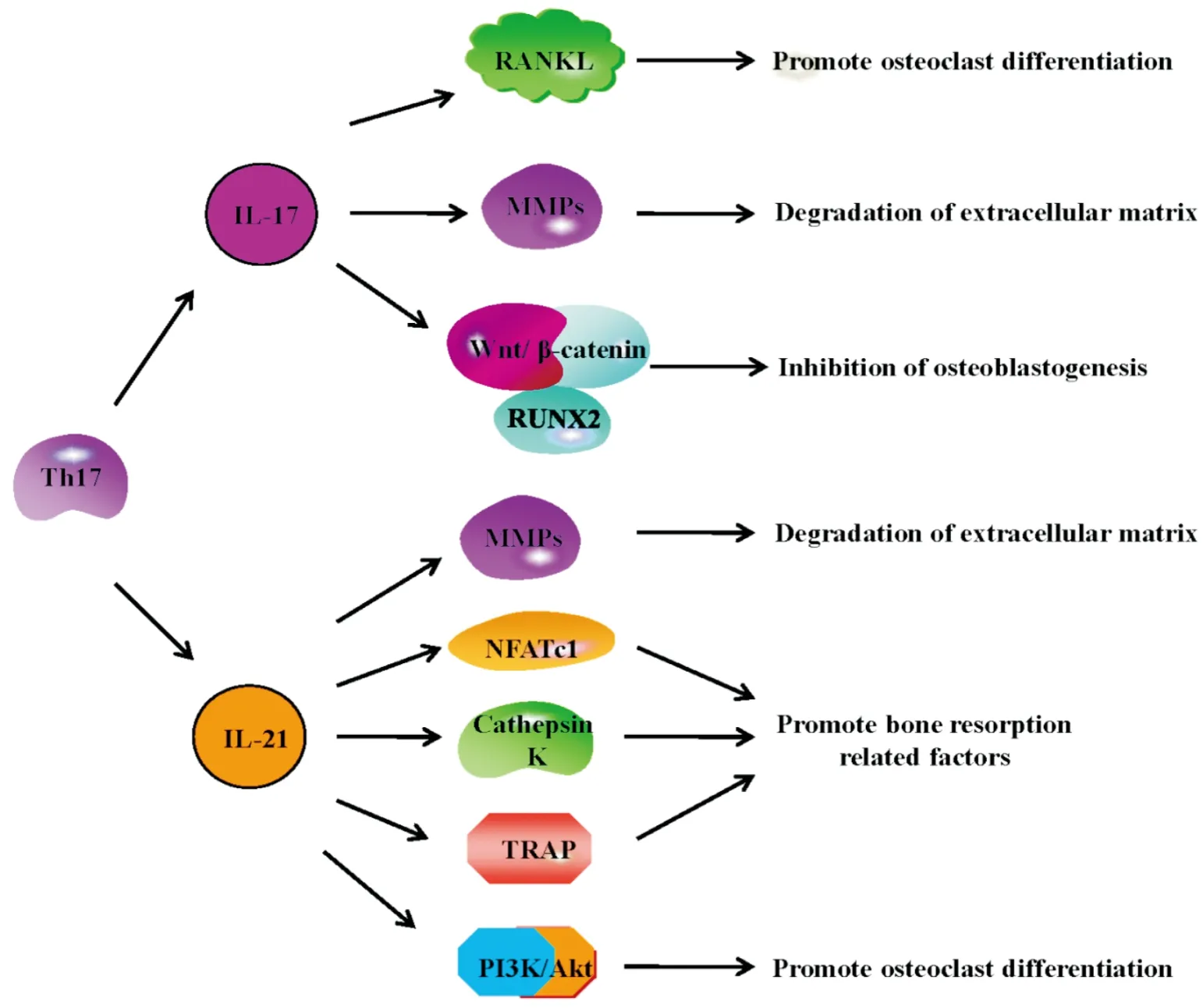
Fig 2 Bone destruction in RA promoted by Th17 cells
Th17 cells produce IL-17 and IL-21 which play an important role in bone destruction of patients with RA. IL-17 promotes bone destruction in RA through the following pathways: (1) IL-17 promotes RANKL expression and osteoclast differentiation; (2) IL-17 promotes the expression of MMPs that degrade the extracellular matrix of bone; (3) IL-17 inhibits osteoblastogenesis.IL-21 promotes bone destruction in RA through the following pathways:(1) IL-21 promotes the expression of MMPs which degrade the extracellular matrix of bone; (2) IL-21 promotes the expression of bone resorption-related factors; (3) IL-21 promotes osteoclast differentiation
4 总结与展望
综上所述,Th17细胞及其分泌的IL-17、IL-21等促炎性细胞因子对RA早期的滑膜炎症反应和RA晚期的骨破坏等病理环节均发挥促进作用,但对于不同病理环节的作用强度是否有差异;对于不同环节的作用机制及其效应靶点是否异同,均尚有待于进一步深入研究。因此,深入研究Th17细胞对RA不同病理环节的影响,有助于进一步揭示其针对RA不同病理环节的病理机制及其效应靶点,进而开发基于Th17细胞的RA多靶向防治药物,具有重大的研究意义和广袤的应用开发前景。

