青藤碱对脑出血大鼠脑水肿及炎症因子IL-1β和TNF-α的影响#
雷皓尹 杨菲 殷晓珮 何毅 章卓
·基础论著·
青藤碱对脑出血大鼠脑水肿及炎症因子IL-1β和TNF-α的影响#
雷皓尹*1杨菲2殷晓珮何毅4章卓5△
(1. 西南医科大学药学院2016级中药学,四川 泸州 646000;2. 西南医科大学药学院2016级药学,四川 泸州 646000;3. 西南医科大学药学院2017级药学,四川 泸州 646000;4. 西南医科大学临床医学院泌尿外科,四川 泸州 646000;5. 西南医科大学药学院药理教研室,四川 泸州 646000)
研究青藤碱对脑出血大鼠模型脑水肿及炎症因子表达影响。将60只SD大鼠随机分为假手术组,脑出血模型组,青藤碱低剂量组、中剂量组、高剂量组以及阳性对照组(n=10)。除假手术组外,各组大鼠均脑内尾状核注射凝血酶Ⅶ 0.5 U诱发脑出血模型。假手术组和脑出血模型组给予生理盐水灌胃2 ml•次-1,青藤碱各剂量组分别按青藤碱50 mg·kg-1,100 mg·kg-1,200 mg·kg-1灌胃,阳性对照组给予地塞米松0.75 mg•kg-1灌胃,各组大鼠在造模前和造模后各连续给药3 d,一天一次。采用改良Longa分级法在造模后24 h和72 h测评大鼠神经功能,术后78 h处死大鼠。采用干湿重法检测脑组织含水量,ELISA法检测脑组织和血清中白细胞介素-1β和肿瘤坏死因子-α水平。与假手术组相比,模型组大鼠神经功能评分,脑组织含水量以及IL-1β和TNF-α表达均明显增加(P<0.05)。与模型组比较,青藤碱各剂量组可显著降低大鼠神经功能评分,脑组织含水量和IL-1β和TNF-α表达(P<0.05)。青藤碱明显减轻脑出血大鼠脑水肿,其可能与减少炎症因子IL-1β和TNF-α表达有关。
青藤碱;脑水肿;炎症因子
脑出血急性期病死率高达30%~40%,是威胁人类健康的脑血管疾病之一。脑出血后引起脑组织明显的炎症反应,导致血脑屏障严重破坏进而形成脑水肿,因此如何消除脑出血患者脑水肿和炎症反应一直是研究热点[1]。
白介素-1β(Interleukin-1β,IL-1β)是一种具有多向性生物功能的炎症介质,血清中IL-1β水平显著升高是脑出血后炎症反应重要标志之一。IL-1β与脑出血后脑水肿程度呈正相关,其机制可能与通过刺激胶质细胞释放其他细胞因子和黏附因子、直接破坏血脑屏障,增加其通透性有关,加重外周白细胞浸润等有关[2,3]。肿瘤坏死因子α(Tumor necrosis factorα,TNF-α)是一种多肽类细胞因子,主要由单核巨噬细胞产生,正常水平的TNF-α维持多种细胞的分化和成活,而病理情况是机体炎症及免疫应答的重要调节因子,与脑出血后继发性脑损害密切相关[4]。阻断或抑制炎性因子IL-1β和TNF-α的大量释放,可有效控制脑出血后炎症反应,以达到减轻脑水肿,进而减轻脑出血后病理损伤的目的,为临床提供可行治疗策略。
青风藤为防己科植物青藤或毛青藤的藤茎,有祛风湿、通经络、活血、利水的功效。青藤碱是从青风藤提取出的生物碱单体,可降低IL-1β,TNF-α等炎症因子的含量,已被广泛应用于治疗风湿性关节炎[5],但青风藤是否通过抑制IL-1β,TNF-α等炎症因子表达减轻脑出血导致的脑水肿或其他继发性损伤尚不清楚。
本研究通过观察青藤碱对脑出血大鼠模型脑水肿及相关炎症因子表达影响,为青藤碱防治脑出血水肿提供依据。
1 材料与方法
1.1 材料
IL-1β和TNF-α ELISA试剂盒(购自武汉艾美捷科技有限公司);SD大鼠(购自西南医科大学动物实验中心,生产许可证号:SCXK(川)2013-17),凝血酶Ⅶ(购自Sigma公司)。
1.2 方法
1.2.1 脑出血模型制备
采用脑内尾状核注射凝血酶Ⅶ诱发尾壳核出血建立大鼠脑出血模型。SD大鼠经10%水合氯醛2 mg•kg-1麻醉后,以脑立体定位仪定位前囟后约1 mm,矢状线右侧3 mm处,匀速注射胶原酶Ⅶ 0.5 U(5 μl,进针深度6 mm,推注时间5 min,留针10 min,出针5 min)。
1.2.2 分组
60只SD大鼠,雌雄各半,随机分为假手术组,脑出血模型组,青藤碱低剂量组(50 mg•kg-1,灌胃),青藤碱中剂量组(100 mg•kg-1,灌胃),青藤碱高剂量组(200 mg•kg-1,灌胃)、阳性对照组(地塞米松0.75 mg•kg-1,灌胃)。
除假手术组外,各组大鼠均采用1.2.1的方法建立脑出血模型;假手术组大鼠操作同脑出血模型组,但仅注射等量无菌生理盐水。造模前各药物处理组大鼠分别连续给予相应药物3 d,并于造模后12 h继续给药3 d[6]。假手术组和脑出血模型组则每天给予等体积生理盐水灌胃。
1.2.3 神经功能评定
神经功能评定采用改良Longa分级法。0分为无神经缺陷症状;1分为不能伸展手术对侧前肢;2分为手术对侧前肢屈曲;3分为轻度向手术对侧转圈;4分为严重向手术对侧转圈;5分为向手术对侧跌倒。2分以上模型成功。术后24 h和72 h评分。
1.2.4 脑组织含水量测定
造模后第3 d和最后一次给药后6 h(术后78 h),通过颈椎脱臼处死大鼠,采用干湿重法测定脑出血灶周围脑组织含水量:去除额极后,取病变侧2 mm×2 mm厚脑组织测定其含水量。脑组织湿重表示为A;将脑组织用锡纸包裹,放入烤箱内100℃烘干24 h后取出,称出干重为B;脑组织含水量=(A-B)/A×100%。
1.2.5 ELISA法检测脑组织和血浆中IL-1β、TNF-α含量
处死前取大鼠腹主动脉血2 ml,3000转•min-1离心3min后放于4℃冷藏备用。之后颈椎脱臼法处死大鼠,剥取注射部位周围脑组织50 mg置于4℃冷藏备用。按ELISA说明书操作,以酶标仪测定脑组织和血浆样本在波长为450 nm 时的OD值,绘制标准曲线,计算IL-1β和TNF-α含量。
1.3 统计学处理

2 结果
2.1 各组大鼠模型神经功能评定
假手术组大鼠神经功能未见异常,评分为0;脑出血模型组大鼠出现明显神经功能障碍,Longa评分与假手术组相比明显增高(P<0.01)。青藤碱各剂量组和阳性对照组大鼠在术后24 h以及72 h的Longa评分均明显低于脑出血模型组(P<0.01),具有明显降低神经功能损伤的作用,见图1。
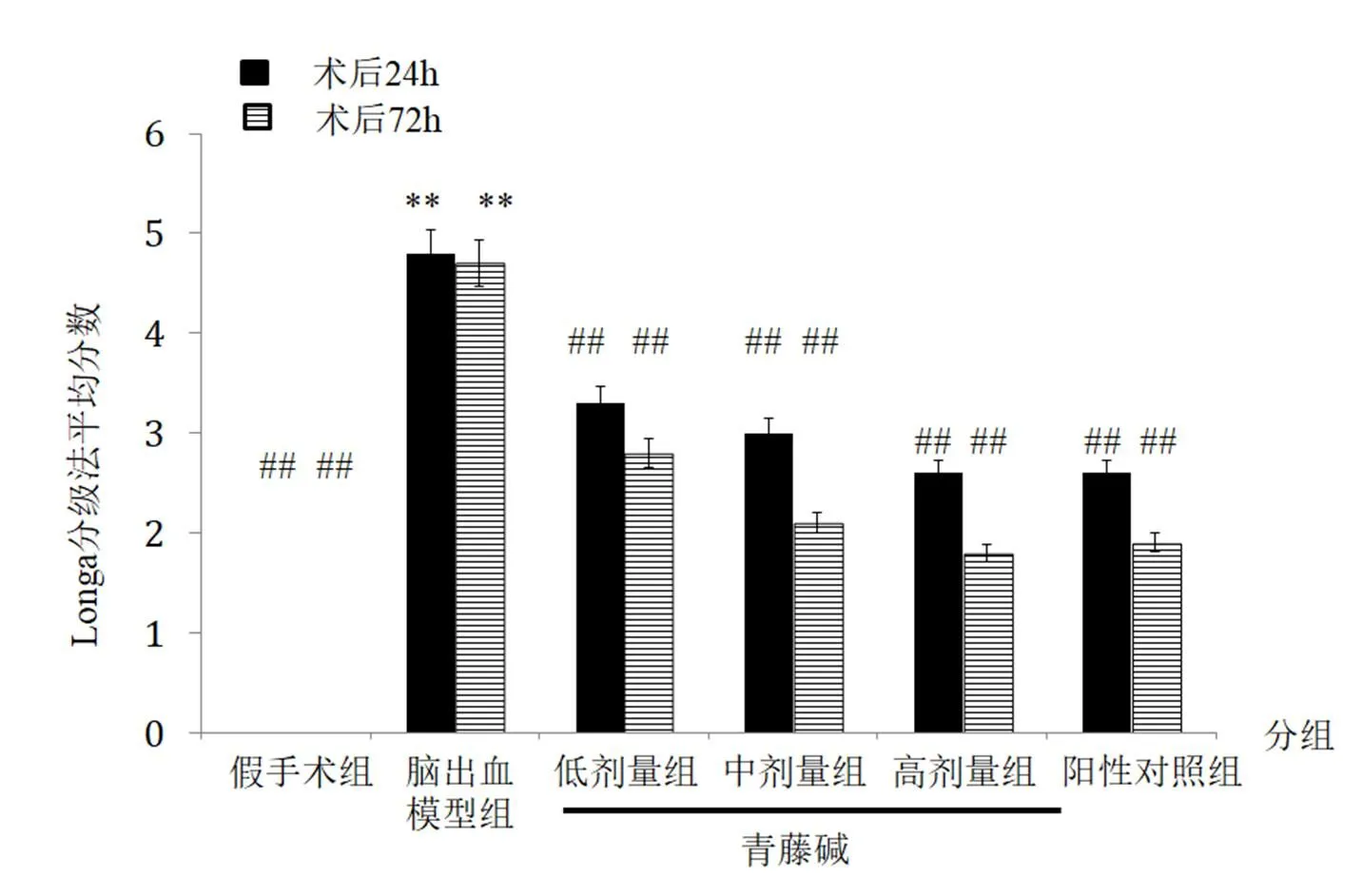
图1 术后24 h、72 h大鼠Longa神经功能评分
注:与假手术组相比,*P<0.05,**P<0.01;与模型组相比,##P<0.01。
2.2 青藤碱干预后脑组织含水量测定
模型组大鼠脑组织含水量明显高于假手术组(P<0.05),青藤碱各剂量组和阳性对照组脑组织含水量则明显低于模型组(P<0.05),见图2。
2.3 青藤碱干预后脑组织与血浆IL-1β和TNF-α含量测定
模型组大鼠脑组织和血浆中IL-1β和TNF-α含量均明显高于假手术组(P<0.05),而青藤碱各剂量和阳性药均可明显降低模型大鼠脑组织和血浆中IL-1β和TNF-α含量(P<0.01),具有抑制炎症因子IL-1β和TNF-α表达作用,见图3。
3 讨论
脑出血是一种严重的致死性疾病,脑水肿以及继发性损伤是其致死原因之一。炎症反应症致使血脑屏障被破坏,形成严重脑水肿以及继发性损伤。炎症本身是对各种损伤因子刺激所发生的防御性病理过程,但炎症反应除了防御外,对机体也会产生破坏作用,比如释放多种酶及炎症介质就会加重局部组织的水肿和神经细胞的破坏[7]。脑出血后血肿及其周围脑组织炎症反应的发生、发展是造成继发性脑损伤的主要原因之一[8]。因此在脑出血急性期, 采用抗炎治疗可明显减轻脑水肿的产生。炎症反应中IL-1β和TNF-α是重要的炎症因子和炎症反应重要标志之一,脑出血后IL-1β和TNF-α释放增多,刺激胶质细胞释放其他细胞因子和黏附因子促进炎症反应,破坏血脑屏障,增加其通透性,促进脑损伤的发展[9]。

图2 青藤碱干预后大鼠脑组织含水量比较
注:与假手术组相比,*P<0.05;与模型组相比,# P<0.05。

图3 青藤碱对脑出血大鼠脑组织与血浆IL-1β和TNF-α含量影响(pg·mL-1)
注:A. 脑组织IL-1β;B. 脑组织TNF-α;C. 血浆IL-1β;D. 血浆TNF-α。*与假手术组相比, P<0.05;#与模型组相比, P<0.05;##与模型组相比P<0.01。
青藤碱可被用于治疗风湿性关节炎,具有降低TNF-α等炎症因子含量,降低发病率的功效[10],本研究通过尾状核内内注射胶原酶Ⅶ0.5 U建立大鼠脑出血模型,结果显示模型组大鼠在模型建立后3 d,神经功能明显下降,Longa评分均在4分以上,提示造模成功。地塞米松因具有强大的抗炎作用,能缓解脑水肿,故作为阳性对照药物用于本次研究。另外本次研究发现,采用灌胃方式给予大鼠不同剂量青风藤治疗后发现,大鼠脑干湿比重明显低于模型组,提示此药物具有减轻脑水肿的作用。同时,模型组大鼠脑组织和血浆中炎症因子TNF-α与IL-1β水平明显增加,青藤碱各剂量组大鼠脑组织和血浆中TNF-α与IL-1β水平均显著下降,提示青藤碱有减少炎症因子释放作用。
综上,青藤碱具有抑制脑出血模型大鼠脑水肿,减少炎症因子释放的作用,但本研究仅分析了青藤碱对炎症因子影响,对于具体的药物作用机制和信号通路值得进一步研究。
1 Sato S, Yamamoto H, Qureshi AI, et al. Antihyper- tensive treatment of acute cerebral hemo rrhage- (ATACH)-II at Japan site: study design and advance construction of domestic research network [J]. Rinsho Shinkeigaku, 2012, 52(9): 642-650.
2 Fontanella M, Rainero I, Gallone S, et al. Interleukin-1 cluster gene polymorphisms and aneurysmal subara- chnoid hemorrhage[J]. Neurosurgery, 2010, 66(6): 1058-1062.
3 乔智慧, 黄秀兰, 蔡娜莉, 等. 抵抗素及IL-1β在新生大鼠缺氧缺血性脑损伤中的表达及其意义[J]. 免疫学杂志, 2010, 26(12): 1104-1106.
4 Yin XP, Chen ZY, Zhou J, et al. Mechanisms underlying the perifocal neuroprotective effect of the Nrf2-ARE signaling pathway after intracranial hemor- rhage[J]. Drug Des Devel Ther, 2015, 17(9): 5973- 5986.
5 Tae WK, Jeong MH, Young KH, et al. Anti- inflammatory effects of sinomenium acutum extract on endotoxin-induced uveitis in lewis rats[J]. Int J Med Sci, 2018, 15(8): 758-764.
6 经鑫爱, 王彩霞, 孙桂芳. 加味麻杏石甘汤对哮喘大鼠外周血嗜酸性粒细胞和细胞黏附分子1调节作用的实验研究[J]. 中国中西医结合儿科学, 2011, 3(6): 548-550.
7 Ye L, Gao L, Cheng H. Inflammatory profiles of the interleukin family and network in cerebral hemor- rhage[J]. Cell Mol Neurobiol, 2018, 38(7): 1321-1333.
8 Fu G, Wang H, Cai Y, et al. The aflavin alleviates inflammatory response and brain injury induced by cerebral hemorrhage via inhibiting the nuclear transcription factor kappa β-related pathway in rats[J]. Drug Des Devel Ther, 2018, 6(12): 1609-1619.
9 Wang X, Shi N, Shi H, et al. Correlations of acute cerebral hemorrhage complicated with stress ulcer bleeding with acute physiology and chronic health evaluation (APACHE) II score, endothelin (ET), tumor Necrosis Factor-alpha (TNF-α), and blood Lipids[J]. Med Sci Monit, 2018, 24(24): 9120-9126.
10 Zhao XX, Peng C, Zhang H, et al. Sinomenium acutum: a review of chemistry, pharmacology, pharmaco- kinetics, and clinical use[J]. Pharm Biol, 2012, (8): 1053-1061.
Effects of sinomenine on cerebral edema and levels of IL-1β and TNF-α in rat with cerebral hemorrhage#
Lei Hao-yin*1, Yang Fei2, Yin Xiao-bei3, He Yi4, Zhang Zhuo5△
(1. Chinese Pharmacy Major of 2016 Grade, Pharmacy College, Southwest Medical University, Luzhou 646000, Sichuan; 2. Pharmaceutical Major of 2016 Grade, Pharmacy College, Southwest Medical University, Luzhou 646000, Sichuan; 3. Pharmaceutical Major of 2017 Grade, Pharmacy College, Southwest Medical University, Luzhou 646000, Sichuan; 4. Department of Urology, Affiliated Hospital of Southwest Medical University, Luzhou 646000, Sichuan; 5. Department of Pharmacology, Pharmacy College, Southwest Medical University, Luzhou 646000, Sichuan)
To evaluate the effects of sinomenine (SIN) on cerebral edema and inflammation cytokines levels in rats with cerebral hemorrhage.Sixty SD rats were randomly divided into the sham-operatedgroup, cerebral hemorrhage model group, SIN low dose group, SIN medium dose group, SIN high dose group, and the positive control group (n=10). Besides sham-operated group, cerebral hemorrhage were induced by injecting 0.5 U thrombin Ⅶ into the caudate nucleus of rats.. Rats in SIN treatment groups and positive control group were orally administrated SIN (50 mg•kg-1, 100 mg•kg-1and 200 mg•kg-1) and dexamethasone (0.75 mg•kg-1) once a day for six days, respectively. And rats in control group and cerebral hemorrhage model group were orally administrated the same volume of saline. After 24 h and 72 h of cerebral hemorrhage, the neurological function was evaluated by the modified Longa grading method and the water content of brain was measured by wet and dry ratio. The levels of interleukin-1 beta (IL-1β) and tumor necrosis factor-alpha (TNF-α) in brain tissue and serum were measured by ELISA.Compared with the sham-operated group, the score of neurological functions, water content of brain tissues and IL-1β and TNF-α levels of rats in model group were significantly increased (P<0.05), which were significantly decreased by SIN (P<0.05).SIN can alleviate cerebral edema in rats with cerebral hemorrhage via decreasing the IL-1β and TNF-α level.
Sinomenine; Brain edema; Inflammatory cytokines
(2019-11-7)
泸州市-西南医科大学联合项目(编号:2017LZXNYD-J32);西南医科大学大学生科研项目(编号:201816032056)
雷皓尹,男,西南医科大学2016级中药学专业学生,Email:354699170@qq. com;
章卓,男,教授,主要从事中药药理学研究,Email:363041626@qq. com。

