乳酸菌对发酵牦牛肉灌肠理化性质及挥发性风味物质的影响
龚珏,唐善虎,李思宁,郑娇,谭雪梅
(西南民族大学 生命科学与技术学院, 四川 成都, 610041)
牦牛是一种在海拔 3 000 m以上“无污染区”的高寒低氧草地放牧的珍稀畜种[1],主要分布在我国的青藏高原一带。据报道牦牛肉的蛋白质、脂肪酸和氨基酸等营养成分高于其他牛肉,同时具有脂肪含量低和微量元素丰富等优点,有极高的营养价值和商业价值[2-3]。牦牛肉与普通黄牛肉相比虽保水性好、大理石花纹适中,但嫩度低、肉色较深,导致牦牛肉食用品质一般,口感较为粗糙[4]。因此,采取适当的加工方式对牦牛肉的感官品质进行优化,最大程度保留牦牛肉的营养价值成为牦牛产品加工研究的重要部分。
发酵灌肠作为一种典型的发酵肉制品,一般通过自然发酵或人工接种发酵剂制得,其分布广泛,品类众多,风味独特,受到全世界消费者的喜爱[5]。向发酵基质中人工添加的活的或休眠状态的微生物制剂即为发酵剂[6],灌肠发酵剂是指能在灌肠中发挥理想代谢活性的微生物制剂,主要包括乳酸菌、酵母菌、凝固酶阴性球菌和部分霉菌菌株。目前,这些能改善香肠感官营养特性的微生物已成为发酵灌肠研究的核心[7]。乳酸菌是发酵灌肠中的优势菌属,潘晓倩等[8]报道了用含有乳酸菌的3 种商业发酵剂制作的北方风干香肠,与对照组相比,红度值a*显著提高,颜色更鲜艳;此外,接种发酵剂能够促进醛类、酮类及酯类等风味物质的生成。CHEN等[9]研究发现从哈尔滨风干肠分离得到的戊糖片球菌、短乳杆菌、弯曲乳杆菌以及发酵乳杆菌拥有分解猪肉肌浆蛋白产生风味物质的能力,而且戊糖片球菌促进可溶性肽和氨基酸生成的能力最强,对风味物质生成促进作用最大,可作为良好的发酵剂。丁烯等[10]研究乳酸菌发酵制作的牦牛肉灌肠,发现35℃恒温发酵生产的灌肠感官营养品质相对最优。目前关于单一乳酸菌发酵剂对牦牛肉发酵制品理化指标及风味影响的研究鲜有报道。
本试验保持发酵灌肠制作原辅料及工艺参数等条件不变,采用清酒乳杆菌(Lactobacillussakei,LS)、植物乳杆菌(Lactobacillusplantarum,LP)及戊糖片球菌(Pediococcuspentosaceus,PP)单一接种制作牦牛肉发酵灌肠,以自然发酵为对照。通过测定牦牛肉灌肠不同发酵时期理化指标及风味物质的变化,探究不同乳酸菌发酵对牦牛肉灌肠品质的影响,为相关牦牛肉制品开发提供理论依据。
1 材料与方法
1.1 菌种
清酒乳杆菌(Lactobacillussakei,LS)、植物乳杆菌 (Lactobacillusplantarum,LP)、戊糖片球菌(Pediococcuspentosaceus,PP),中国工业微生物菌种保藏管理中心。
1.2 灌肠原料
自然放牧状态下健康无病的3岁龄公牦牛背最长肌,四川红原;猪肥膘、食盐、蔗糖、五香粉、味精、天然猪肠衣,成都沃尔玛超市。
1.3 试剂
MRS增菌培养基、MRS培养基,杭州微生物试剂有限公司;甲基红、溴甲酚绿、Hcl、MgO,成都市科龙化工试剂厂;以上所有试剂均为国产分析纯。
1.4 仪器与设备
pH-Star仪,德国 Matthaus公司;Centrifuge 5804离心机,德国Eppendorf 公司;绞肉灌肠一体机,深圳康佳智能电器科技有限公司;PL303电子天平,瑞士Mettler Toledo公司;BCD221TMBA冷冻冰箱,青岛海尔股份有限公司;FSH-2A 高速匀浆机,江苏金坛市医疗仪器厂; TA.TX Plus 质构仪,英国 Stable Micro Systems 公司;CR-400 色彩色差仪,日本 Konica Minolta 公司;TRACE DSQ II 型气质联用仪(GC-MS),美国 Thermo公司。
1.5 实验方法
1.5.1 制作牦牛肉灌肠的制作
工艺流程:
原料肉→切块→混匀(瘦肥比为9 ∶1)→腌制(4 ℃、12 h)→绞肉→接种(对照组不进行接种)→ 灌肠→结扎、排气→恒温发酵(32 ℃,24 h)→风干发酵(室温,25 d)→成品
对照组除不进行发酵剂接种外,其余工艺流程均与处理组相同,操作细节如下:(1)切块:将剔除筋膜的牦牛肉以及猪背膘洗净后切成约2 cm×2 cm×2 cm大小立方块。(2)腌制:按比例将牦牛肉及猪背膘混合,加入3.5%食盐、0.4%味精、5%蔗糖、0.05%NaNO2、0.45%五香粉(均为质量分数),充分混匀后置于4 ℃冰箱腌制12 h;(3)接种:用绞肉机将腌制后的原料肉绞成均匀肉馅;分别单独接种LS、LP、PP并充分混匀,接种量为1×106CFU/g,以不接种乳酸菌的自然发酵组为对照。(4)灌肠:将肉馅灌于猪小肠衣内,使每节肠长度在15 cm左右,直径在2.5 cm左右,用线绳结扎并用针扎孔排气。(5)发酵:灌肠移至32 ℃培养箱恒温发酵24 h,然后将灌肠移至阴凉通风的自然环境(13~22 ℃)继续风干发酵25 d。在开始发酵后第1、6、11、16、26天进行相关指标的测定。
1.5.2 pH值的测定
取发酵牦牛肉灌肠3 g于离心管中,加27 g蒸馏水匀浆,然后用pH Star仪测定牦牛肉发酵灌肠的pH值,待读数稳定记录数值
1.5.3 色泽测定
将牦牛肉发酵灌肠横切成2 cm左右薄片,使用校正后的色差仪对其横截面取点进行测定,记录亮度值(L*)、红度值(a*)、黄度值(b*)。
1.5.4 水分含量测定
采用常压干燥法对样品的水分含量进行测定。
1.5.5 挥发性盐基氮(total voatile base nittrogen,TVB-N)的测定
参考PIERRE 等[11]的方法并略作修改对TVB-N进行测定。取牦牛肉发酵灌肠10 g加水匀浆后采用半自动凯氏定氮仪进行消化,消化完成后收集回收液,以甲基红和溴甲酚绿混合液作为指示剂,以1 mol/L的HCl滴定液进行滴定,结果换算为毫克每一百克(mg/100g)。
1.5.6 质构(terture,TPA)的测定
将牦牛肉灌肠切成3 cm左右的均匀薄片后,对香肠的TPA质地进行测定。测定指标为硬度(hardness)、 黏聚性(cohesiveness)、咀嚼性(chewiness)和弹性 (springiness);探头为直径5 mm的平底柱形探头P/5; 测定条件为测定速率5 mm/s;停留间隔为5 s;数据采集速率为400 pps;触发值为5 g。
1.5.7 挥发性风味物质的测定
参考STOLKE等[12]的方法并略作修改,采用顶空固相微萃取法进行样品处理。取1.5 g牦牛肉发酵灌肠搅碎置于20 mL顶空瓶中,压盖后将50/30 μm DVB/CAR/PDMS 萃取头插入样品瓶顶空部分,于60 ℃吸附30 min,然后将吸附后的萃取头取出后插入气相色谱进样口,于220 ℃解吸3 min。
色谱条件:使用TR-5 MS毛细管柱(30 m ×0.25 mm ×0.25 μm),高纯氦气为载气,流速1 mL/min。升温程序:炉温在40 ℃下保持3 min, 以5 ℃/min的升温速率升至90℃,不保持,再以10 ℃/min的速率升温至230 ℃,保持6 min。
质谱条件:电离方式EI+,电子能量70 eV,发射电流120 μA,扫描质量范围40~550m/z。
1.5.8 数据处理
运用Excel和Graphpad Prism 8进行表格和图像处理,用SPSS 25软件进行显著性检验(Duncan′s)以及主成分分析(principal copmonent anlysis,PCA)分析。
2 结果与分析
2.1 牦牛肉灌肠发酵过程中pH值的变化
乳酸菌在适宜的温度下,能够快速分解碳水化合物产生大量乳酸,使pH值降低。在灌肠的发酵过程中,pH值的变化能够起到估测灌肠发酵程度的作用。由图1可知,各组pH值在发酵初期快速下降,从5.51降至4.6左右。在恒温发酵时期(0~1 d),接种了乳酸菌的处理组pH下降速率远高于对照组,这说明乳酸菌能够加速牦牛肉灌肠产酸;对照组pH值也有大幅下降,可能是该组灌肠中非人工添加的乳酸菌及其他微生物的产酸作用所致。各组在发酵第6天后pH值趋于稳定并略有回升,这可能是氨基酸水解所产生的氨类物质的中和作用所导致的。另外LP组在风干发酵时期(6~26 d)pH值显著低于其他处理组(P<0.05),并在16~26 d仍有下降趋势,这可能是肉源性酸性蛋白酶、植物乳杆菌菌株蛋白水解活力以及植物乳杆菌发酵产酸等方面协同作用,使LP在pH值较低环境下仍能持续生成酸性物质的结果[13]。

图1 牦牛肉灌肠发酵过程中pH的变化Fig.1 Changes in pH value during the fermentation process of yak sausage
2.2 牦牛肉灌肠发酵过程中水分含量的变化
牦牛肉灌肠的水分含量变化如图2所示。各组水分含量均随发酵时间的延长而显著下降,从1~26 d,水分含量由50 %左右降至20 %左右。在发酵的前中期(1、6、11 d),3个处理组的下降速率要高于对照组;且在前3个时间点,处理组水分含量均显著低于对照组(P<0.05),这一现象表明接种乳酸菌会加速牦牛肉灌肠水分的损失。在发酵后期(16、26 d)LS组与对照组的水分含量变化不再显著,而LP组和PP组的水分含量仍有小幅度下降,且LP组在26 d的水分含量要显著低于其他各组(P<0.05)。结合pH变化结果分析这可能是由于处理组pH值更快的下降到等电点,另外快速的pH值下降会导致肌肉蛋白的变性和酸诱导的凝胶反应,这些都会使得牦牛肉肌肉蛋白的持水力下降,致使水分的损失加速[14]。

图2 牦牛灌肠发酵过程中水分含量的变化Fig.2 Changes of moisture content during the fermentation of yak sausage注:不同小写字母表示同一发酵时间不同菌种对牦牛肉香肠中水分含量的影响差异显著(P<0.05);不同大写字母表示同一菌种不同发酵时间对牦牛肉灌肠香肠中水分含量的影响差异显著(P<0.05)
2.3 牦牛肉灌肠发酵过程中色泽的变化
牦牛肉灌肠发酵过程中色泽的变化如图3所示。各组牦牛肉灌肠的L*、a*和b*值随发酵时间的变化差异显著(P<0.05),L*值总体呈现先下降后上升的趋势,这可能是由于香肠发酵过程水分的快速损失导致了L*值的下降[15]。在发酵末期(26 d),所有处理组a*值均显著高于对照组,且PP组的L*、a*和b*值均显著高于其他组(P<0.05),这可能是因为乳酸菌产酸降低了原料肉的 pH,同时还具有产生亚硝酸盐还原酶的能力,这些都能促进亚硝酸盐分解为NO,NO与肌红蛋白结合,促进肉制品发色[16]。
2.4 牦牛肉灌肠发酵过程中TVB-N的变化
TVB-N是一类在酶和腐败菌的作用下, 食物蛋白质分解而产生的氨和胺类等碱性含氮物质,这类物质具有较强的挥发性。TVB-N在肉制品中的含量变化与肉制品的腐败程度具有密切的关系[17]。牦牛肉

a-L*值;b-a*值;c-b*值图3 牦牛肉灌肠发酵过程中的色泽变化Fig.3 Changes of color during the fermentation of yak meat sausage
灌肠发酵过程中的TVB-N含量变化如图4所示。在恒温发酵(1 d)以及风干发酵前期(6 d),各组TVB-N快速上升,这是前期腐败菌及乳酸菌快速生长繁殖分解蛋白所致。发酵1 d后,各组间TVB-N含量差值不大;第6天时,LS组的TVB-N含量最高,LP组最低,而PP组与对照组差异不大;此后,对照组的TVB-N含量继续上升并在第11天达到最大值:29.4 mg/100g,之后不再上升,这可能是pH降低导致腐败菌和酶的分解反应停滞所致。此外,此时间段内处理组TVB-N含量均显著小于对照组(P<0.05),产生这一现象的可能原因是接种的乳酸菌在发酵过程中产生了抗菌素,在一定程度上抑制了肉中本身腐败菌的生长繁殖,从而降低了牦牛肉灌肠中TVB-N的含量[18]。另外LS组的TVB-N含量始终显著高于LP组和PP组,其原因可能是LS的产抗菌素能力比另外2株乳酸菌稍弱。

图4 牦牛肉香肠发酵过程中TVB-N的变化Fig.4 Changes of TVB-N during the fermentation of yak sausage。注:不同小写字母表示同一发酵时间不同菌种对牦牛肉香肠TVB-N含量影响差异显著(P<0.05);不同大写字母同一菌种表示不同发酵时间对牦牛肉灌肠香肠TVB-N含量影响差异显著(P<0.05)
2.5 牦牛肉灌肠发酵过程中质构的变化
牦牛肉灌肠发酵过程中的质构变化如图5所示。各组的硬度随着发酵时间的延长不断上升,且组间差异较大,在1、16以及26 d处理组的硬度均显著大于对照组(P<0.05),在发酵26 d后,各组硬度从高到低依次为LS>LP>PP>对照。这一现象可能是因为整个发酵过程中灌肠水分在不断损失,以致硬度不断增大,而处理组水分含量下降速率更快,使得其硬度高于对照组,这与灌肠水分含量变化结果一致。此外,可能是因为接种乳酸菌促进了牦牛肉灌肠的蛋白质氧化形成交联物质,蛋白结构的韧性增加,从而增加了其硬度[19]。
弹性随着发酵时间的延长下降后又有所恢复,各组灌肠弹性差异不显著(P>0.05),说明发酵剂对牦牛肉灌肠弹性的影响不显著。
黏聚性指的是维持物质结构和形态的内在连接力[20],由图5可知,牦牛肉灌肠的黏聚性随发酵时间呈不规律变化,但在恒温发酵结束(1 d)和风干发酵结束(26 d)时LS组与LP组的黏聚性要显著高于PP组与对照组(P<0.05)。有研究发现香肠的黏聚性与pH值呈显著负相关,当pH值低于蛋白质等电点时,更多蛋白质析出,致使香肠结构更加坚实,黏聚性增加[21]。
咀嚼性的变化趋势与硬度相似,除了对照组在16~26 d略有回复外,所有组的咀嚼性均随着发酵进行不断增大,在26 d,各组之间差异显著(P<0.05),其咀嚼性从大到小依次为为LS>LP>PP>对照。产生这一现象的原因可能与硬度变化相同, RAHMAN等[22]研究得出咀嚼性在各项质构指标中受水分含量变化影响最大,且咀嚼性与硬度呈显著正相关。另外,当pH值在5.0以下时,蛋白含量尤其是结缔组织含量会对香肠的硬度、黏聚性、咀嚼性等产生影响。

a-硬度;b-弹性;c-黏聚性;d-咀嚼性图5 牦牛肉香肠发酵过程中质构的变化Fig.5 Changes of texture during the fermentation of yak sausage
2.6 牦牛肉灌肠发酵过程中挥发性风味物质的变化
2.6.1 牦牛肉灌肠发酵产生的挥发性风味物质
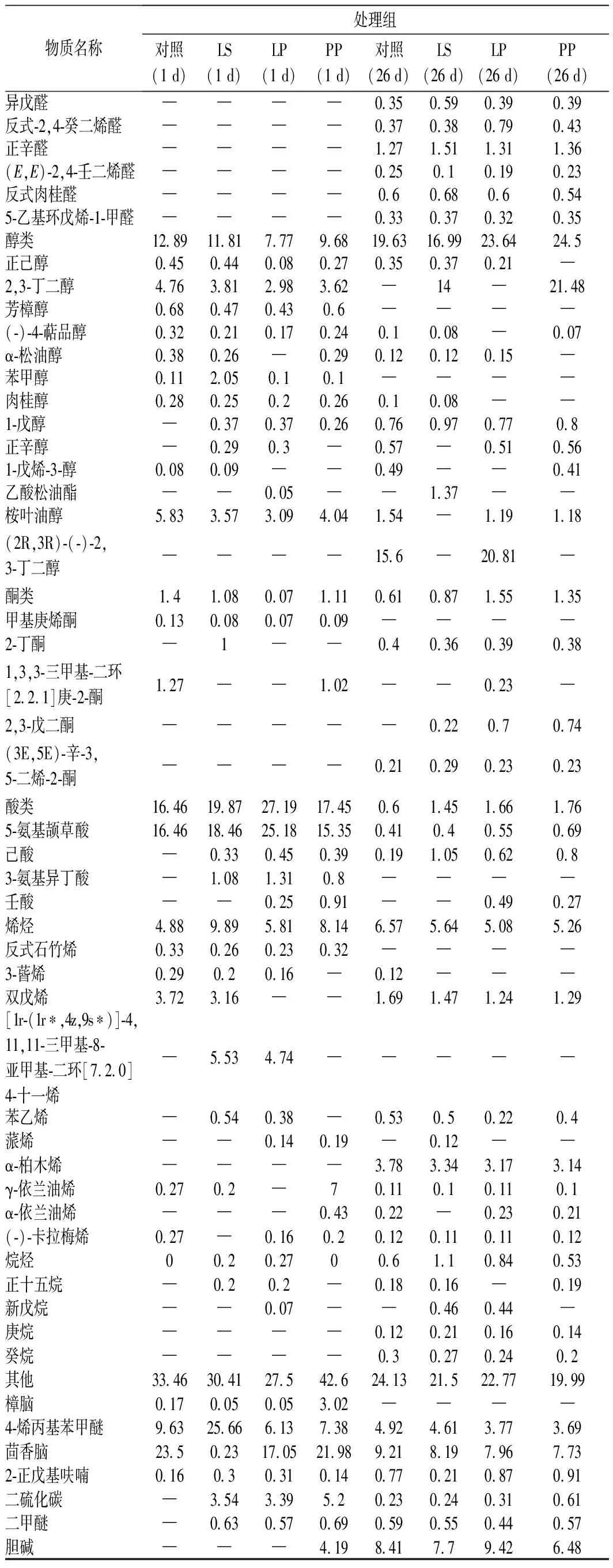
牦牛肉灌肠恒温发酵结束(1 d)和风干发酵结束后(26 d)检出的挥发性风味物质如表1所示。恒温发酵结束后对照组、LS组、LP组以及PP组检出风味物质种类分别为28、39、39和36种,而风干发酵结束后分别为49、53、48和47种。这说明随着发酵的进行,灌肠风味物质的种类不断增加,且处理组产生了更多种类的风味物质。发酵1 d后,各组含量相对较高的风味物质为醛类、醇类和酸类,且处理组醛类,酸类以及碳氢化合物的相对含量明显高于对照组。而发酵26 d后,各组含量较高的风味物质为醛类、酮类和碳氢化合物。与发酵1 d后的结果相比,醛类和酮类物质相对含量成倍增加,且处理组的醛类、酮类物质相对含量要明显高于对照组。对照、LS、LP以及PP组在26 d时醛类物质相对含量分别达到28.23%、31.29%、29.69%和30.32%,成为最主要的风味物质,这与前人的研究结果一致[23]。
醛类物质主要由亚油酸等不饱和脂肪酸氧化及氨基酸物质的降解产生,牦牛肉灌肠中中检测出的直链醛,如正己醛、正辛醛和壬醛等主要来自于不饱和脂肪酸的氧化[24-25],灌肠中相对含量最高的醛类物质是正己醛,富有苹果香气[26],对灌肠风味有很大贡献并且能在一定程度上反应脂肪氧化程度。另外部分醛类来源于蛋白氧化产生的羰基与氨基酸的美拉德反应以及Strecker 降解,比如检测到的苯甲醛,其前体物质为苯丙氨酸[27]。由表1可知,处理组的醛类物质要明显高于对照组,间接说明乳酸菌可能在一定程度上促进牦牛肉灌肠脂肪酸及蛋白质的氧化。
发酵灌肠中醇类物质的产生与微生物的代谢密切相关,主要来自微生物对碳水化合物的分解作用。2,3-丁二醇是灌肠检出含量最高的醇类物质, 该物质在一定条件下可与3-羟基-2-丁酮反应生成2,3-丁二酮,起到改善灌肠风味的作用[28]。在26 d时,LP和PP组的2,3-丁二酮含量相对较高,说明微生物代谢要相对旺盛,这与pH变化结果一致。由于醇类物质香气阈值高,所以对灌肠香味贡献不大。另外部分醇类来自于脂肪的氧化,醇类的大量存在也证明了乳酸菌有一定的脂肪分解能力[29]。
酯类物质由于香气阈值低,对灌肠风味贡献很大,特别是含甲基的短链酯类,对经长时间成熟的肉制品的风味形成具有特殊贡献。酯类多具有芳香气味, 来源于各种醇和酸的酯化作用[30]。短脂则多为果香味,例如,乳酸乙酯、异戊酸乙酯具有强烈酒香气,己酸乙酯和乙酸乙酯具有果香风味[31]。
烃类是脂肪自动氧化的次级产物,其含量与脂肪酸组成有密切关系,脂肪自动氧化也伴随着醛、酮、醇的生成[30]。另外部分烯烃源于腌制时添加的香料,例如胡椒会产生β-蒎烯、月桂烯、3-蒈烯,花椒能生成3-蒈烯、α-蒎烯、β-蒎烯等。烷烃类物质阈值较高,对风味贡献很小[32]。
另外,在牦牛肉发酵灌肠中检测到的少量酮、 醇、酯类和碳氢化合物,主要源自腌制过程中添加的香辛料,如茴香脑、樟脑、桉叶油醇、芳樟醇等。发酵过程中随水分含量减小,这些物质的相对含量有所增加。

表1 牦牛肉灌肠发酵过程中挥发性风味物质的变化Table 1 Changes of volatile flavor substances during the fermentation of yak meat sausage
续表1
物质名称处理组对照(1 d)LS(1 d)LP(1 d)PP(1 d)对照(26 d)LS(26 d)LP(26 d)PP(26 d)异戊醛────0.350.590.390.39反式-2,4-癸二烯醛────0.370.380.790.43正辛醛────1.271.511.311.36(E,E)-2,4-壬二烯醛────0.250.10.190.23反式肉桂醛────0.60.680.60.545-乙基环戊烯-1-甲醛────0.330.370.320.35醇类12.8911.817.779.6819.6316.9923.6424.5正己醇0.450.440.080.270.350.370.21─2,3-丁二醇4.763.812.983.62─14─21.48芳樟醇0.680.470.430.6────(-)-4-萜品醇0.320.210.170.240.10.08─0.07α-松油醇0.380.26─0.290.120.120.15─苯甲醇0.112.050.10.1────肉桂醇0.280.250.20.260.10.08──1-戊醇─0.370.370.260.760.970.770.8正辛醇─0.290.3─0.57─0.510.561-戊烯-3-醇0.080.09──0.49──0.41乙酸松油酯──0.05──1.37──桉叶油醇5.833.573.094.041.54─1.191.18(2R,3R)-(-)-2,3-丁二醇────15.6─20.81─酮类1.41.080.071.110.610.871.551.35甲基庚烯酮0.130.080.070.09────2-丁酮─1──0.40.360.390.381,3,3-三甲基-二环[2.2.1]庚-2-酮1.27──1.02──0.23─2,3-戊二酮─────0.220.70.74(3E,5E)-辛-3,5-二烯-2-酮────0.210.290.230.23酸类16.4619.8727.1917.450.61.451.661.765-氨基颉草酸16.4618.4625.1815.350.410.40.550.69己酸─0.330.450.390.191.050.620.83-氨基异丁酸─1.081.310.8────壬酸──0.250.91──0.490.27烯烃4.889.895.818.146.575.645.085.26反式石竹烯0.330.260.230.32────3-蒈烯0.290.20.16─0.12───双戊烯3.723.16──1.691.471.241.29[1r-(1r∗,4z,9s∗)]-4,11,11-三甲基-8-亚甲基-二环[7.2.0]4-十一烯─5.534.74─────苯乙烯─0.540.38─0.530.50.220.4蒎烯──0.140.19─0.12──α-柏木烯────3.783.343.173.14γ-依兰油烯0.270.2─70.110.10.110.1α-依兰油烯───0.430.22─0.230.21(-)-卡拉梅烯0.27─0.160.20.120.110.110.12烷烃00.20.2700.61.10.840.53正十五烷─0.20.2─0.180.16─0.19新戊烷──0.07──0.460.44─庚烷────0.120.210.160.14癸烷────0.30.270.240.2其他33.4630.4127.542.624.1321.522.7719.99樟脑0.170.050.053.02────4-烯丙基苯甲醚9.6325.666.137.384.924.613.773.69 茴香脑23.50.2317.0521.989.218.197.967.732-正戊基呋喃0.160.30.310.140.770.210.870.91二硫化碳─3.543.395.20.230.240.310.61二甲醚─0.630.570.690.590.550.440.57胆碱───4.198.417.79.426.48
注:“─”表示未检出
2.6.2 牦牛肉灌肠挥发性风味物质的主成分分析
主成分分析采用降维的方法,将较复杂的数据转换为较少的主成分,从而直观的探究因变量与变量间的关系,亦可通过 PCA 图上的距离来直观表征贡献率的大小[33]。
恒温发酵结束后(1 d)牦牛灌肠风味物质的主成分分析结果见图6-a。第一主成分(PC1)与第二主成分(PC2)的方差贡献率分别为44.426%和39.605%,累计方差贡献率达84.231%,可见发酵剂对灌肠恒温发酵后挥发性风味物质生成的影响很大。烷烃、烯烃、醛类和其他类风味物质对第一主成分的贡献率最大,属于第一主成分;醇类、酸类、酮类和酯类风味物质与第二主成分的相关性最高,属于第二主成分。第一主成分影响最大的有烃类和醛类物质,第二主成分影响最大的是醇类物质,这些物质都与氧化反应有着密切关系,说明乳酸菌可能具有促进牦牛肉灌肠蛋白和脂肪氧化,从而促进相关风味物质生成的能力。
风干发酵结束后(26 d)牦牛肉灌肠风味物质的主成分分析结果见图6-b。其中第一主成分(PC1)方差贡献率为49.282%;第二主成分(PC2)方差贡献率为43.876%,累计方差贡献率为93.158%,可见发酵剂对灌肠风干发酵结束后的风味物质成分影响极大。酸类、烯烃、其他类和醛类物质与第一主成分的相关性最高,属于第一主成分;酯类、烷烃、醇类,酮类物质对第二主成分贡献率最高,属于第二主成分。第一主成分影响最大的是酸类物质、第二主成分影响最大的是酯类物质,这些物质的阈值较低,对灌肠风味的贡献较大,说明接种乳酸菌能够促进牦牛肉灌肠挥发性风味物质的生成。
3 结论
在发酵牦牛肉灌肠制作中,与对照相比,人工接种清酒乳杆菌、植物乳杆菌和戊糖片球菌,能够加速产酸速率,快速降低pH;在恒温发酵期及风干发酵初期,接种乳酸菌能够加快牦牛肉灌肠的水分损失;牦牛肉灌肠的TVB-N在整个发酵过程中都呈上升趋势,但接种发酵剂能显著降低灌肠TVB-N的含量(P<0.05);这些变化都有助于抑制腐败菌的繁殖、延长保质期、增加安全性。另外接种乳酸菌发酵剂能在一定程度上改善牦牛肉发酵灌肠的肉色和质构,增加牦牛肉发酵灌肠挥发性风味物质的种类和特殊风味物质的含量,有利于牦牛肉灌肠风味的形成。关于乳酸菌发酵制作的牦牛肉灌肠的营养物质变化还有待进一步研究。

a-恒温发酵;b-风干发酵图6 主成分分析图Fig.6 Principal component analysis

