鱼精蛋白半量负荷剂量加半量微泵输注法中和肝素的效果
陈小莉 陈 东 郭仲辉 魏利娟 马亚飞
心脏手术体外循环(cardiopulmonary bypass,CPB)结束后,临床上常用鱼精蛋白拮抗肝素,既往传统多根据CPB前肝素的用量,以1∶1~1∶1.5的比例一次性给予鱼精蛋白拮抗。但鱼精蛋白中和肝素速度过快或比例不当时,可引起异常出血、严重毒性反应的发生[1-3]。孟保英等[4]研究采用鱼精蛋白经升主动脉根部途径给药拮抗肝素,唐佳丽等[5]研究采用剂量滴定法中和肝素,但操作繁琐且存在一定的风险,临床使用受限。为了加强围术期的血液保护,减少鱼精蛋白的毒性反应,本研究采用经中心静脉途径,鱼精蛋白半量负荷剂量加半量微泵输注维持的方法,观察其中和肝素的效果:是否能减少鱼精蛋白-肝素的不匹配及鱼精蛋白的不良反应,从而为临床合理应用鱼精蛋白提供依据。
1 资料与方法
1.1 一般资料 选取2016年7月至2018年7月河南科技大学第一附属医院行心脏二尖瓣置换术的患者68例,采用随机数字表法分为Ⅰ组与Ⅱ组,每组34例。Ⅰ组鱼精蛋白采用半量负荷剂量+半量微量泵维持法中和肝素,Ⅱ组鱼精蛋白拮抗肝素1∶1.3一次性给予,必要时,根据激活全血凝血时间(activated coagulation time,ACT)追加鱼精蛋白。
纳入标准:①年龄25~67岁者;②ASAⅡ~Ⅲ级者;③心功能Ⅱ或Ⅲ级者;④肺、肝肾及凝血功能正常者。排除标准:糖尿病及过敏病史、脑血管意外史、术中二次转机、实验期间死亡者。本研究经医院伦理委员会审核批准,患者均签署知情同意书。
1.2 麻醉和CPB 患者入室前,肌注安定0.2 mg/kg和东莨菪碱0.3 mg,入室后,监测心率(heart rate,HR)、SpO2,行左桡动脉穿刺置管术,监测有创平均动脉压(mean artery pressure,MAP)。麻醉诱导依次静注咪达唑仑0.1 mg/kg、依托咪酯乳剂0.3 mg/kg、舒芬太尼1.5~3.0 μg/kg和顺阿曲库铵0.3 mg/kg。气管插管后,常规行右颈内静脉穿刺置管,监测中心静脉压(centre vein pressure,CVP)。所有患者术中监测PETCO2和脑电双频指数(bispectral index,BIS),测定 BIS 值,非体外循环期间维持在40~60 之间。麻醉维持采用静-吸复合麻醉,分别于切皮前、CPB前即刻、停机时及关胸前予以静脉注射舒芬太尼1.5~2 μg/kg,持续泵注丙泊酚4~6 mg/(kg·h)、顺阿曲库铵0.15~0.3 mg/(kg·h),间断吸入1%~2%七氟醚,气管插管后,机械通气潮气量8~10 mL/kg、通气频率10~12次/分、氧流量1.5 L/min、氧浓度0.6。根据血气分析结果及PETCO2(维持在35~45 mmHg,1 mmHg=0.133 kPa)调整呼吸参数。
经胸部正中切口开胸,全身肝素化后(肝素400 U/kg),使ACT>480 s,建立CPB,中度血液稀释(红细胞压积为23%~28%)。CPB采用德国Stockert-Ⅲ型体外循环机,西京膜肺氧合器,CPB前测得基础ACT值(Medtronic ACTⅡ分析仪,美国),转流中每30 min测1次,以维持ACT>480 s(均从中心静脉处抽取静脉血测得)。转流中维持MAP 50~80 mmHg,温度32~34℃,两组患者均采用血液回收机回收术野中的出血。
1.3 方法 所有患者均在CPB结束后,经中心静脉途径给予鱼精蛋白(北京悦康药业集团有限公司,批号:26081204),按1.0 mg硫酸鱼精蛋白可以中和100 U肝素(海南制药有限公司制药二厂,批号:181101141)为1∶1计算,Ⅰ组半量负荷剂量+半量微量泵维持,鱼精蛋白总量为6 mg/kg(即1∶1.5),首次负荷量鱼精蛋白为3 mg/kg,微泵速度250 mL/h(10 mg/mL)泵入;剩余半量鱼精蛋白以20 mL/h(10 mg/mL)持续泵注至手术结束,同时肝素血直接回输给患者,并根据肝素血输注速度及术中有无血凝块调节泵速。Ⅱ组首次鱼精蛋白拮抗肝素1∶1.3一次性给予,根据术中ACT值及术野有无血凝块,每次适当追加鱼精蛋白0.5 mg/kg。回输机器中剩余的肝素血时,按每100 mL用鱼精蛋白5 mg中和。两组患者术毕及术后1小时,根据测得的ACT值,适当追加鱼精蛋白。
1.4 观察指标 分别记录两组患者手术、CPB及关胸时间,基础ACT以及肝素化后5分钟、中和后5分钟和30分钟、术毕及术后1小时的ACT值,首次鱼精蛋白用量和鱼精蛋白拮抗肝素比例,术中出血量、回收血量、术后6 h、24 h胸腔引流量及ICU输注红细胞悬液(packed red blood cells,PRBC)例数。记录鱼精蛋白拮抗后不良反应发生的强度:拮抗期间 MAP下降≥10 mmHg定义为鱼精蛋白毒性反应,下降<30 mmHg为轻度反应,≥30~49 mmHg为中度反应,≥50 mmHg为重度反应[6-7]。

2 结果
2.1 一般资料比较 两组患者性别、年龄、体质量、手术时间、CPB时间及关胸时间比较,差异均无统计学意义(P>0.05)。见表1。
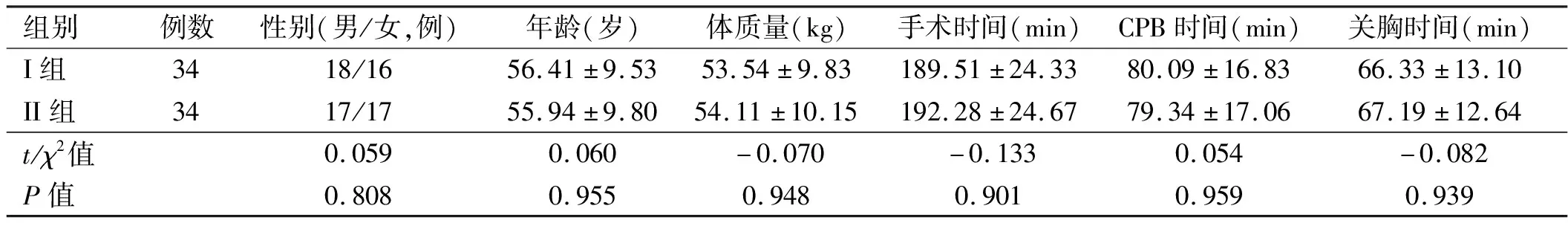
表1 两组患者一般资料比较
2.2 两组患者不同时间点ACT测定值比较 两组间及时点间比较,差异均有统计学意义(P<0.05),时间与分组之间存在交互效应(P<0.05);Bonferroni法校正后检验水准为0.008,因此LSD检验发现,不同时间,两两组间差异均有统计学意义(P<0.05)。结合数据看:两组患者肝素化后5分钟ACT值较基础值均升高,Ⅱ组患者术毕、术后1小时ACT值较基础值延长,两组患者术前、中和后5分钟、30分钟ACT值差异无统计学意义(P>0.05),术毕、术后1小时Ⅱ组ACT值较Ⅰ组延长,差异有统计学意义(P<0.05)。见表2。
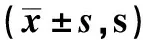
表2 两组患者不同时间点ACT测定值比较
注:与基础值比较,﹟P<0.05
2.3 两组患者鱼精蛋白用量、出血量等指标比较 Ⅰ组患者术中出血量、回收血量、术后6 h和24 h胸腔引流量较Ⅱ组减少,ICU使用PRBC例数少于Ⅱ组,Ⅱ组首次鱼精蛋白用量大于Ⅰ组,差异均有统计学意义(P<0.05),两组患者鱼精蛋白拮抗肝素比例比较,差异无统计学意义(P>0.05)。见表3。
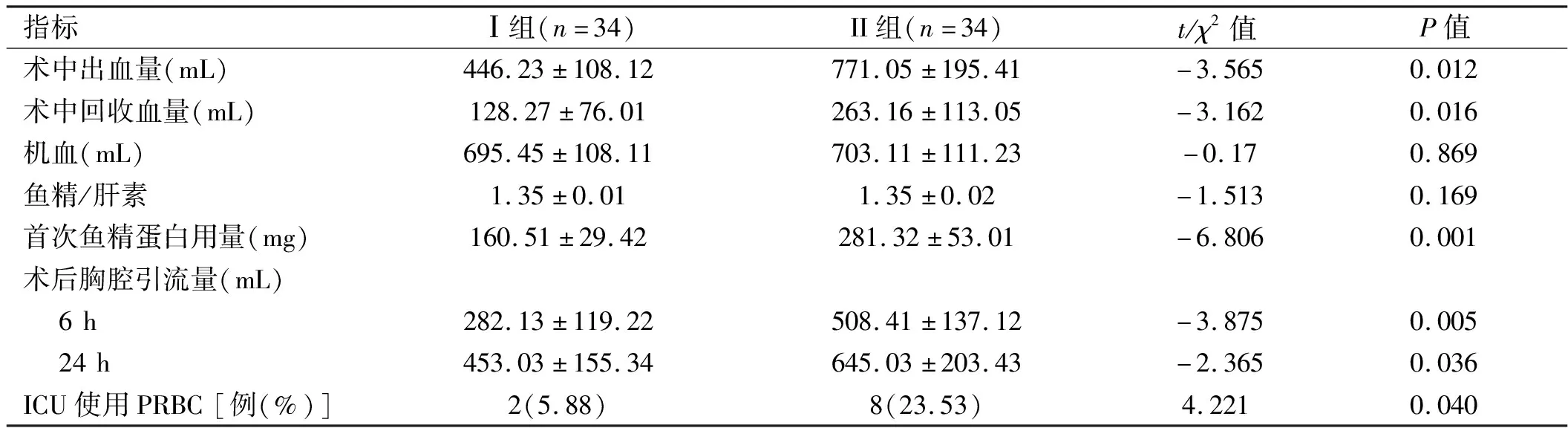
表3 两组患者鱼精蛋白用量、出血量等指标比较
2.4 拮抗后鱼精蛋白不良反应情况比较 Ⅱ组患者不良反应的发生率高于Ⅰ组(χ2=7.556,P=0.006),且不良反应程度加重(Z=-2.833,P=0.005)。见表4。
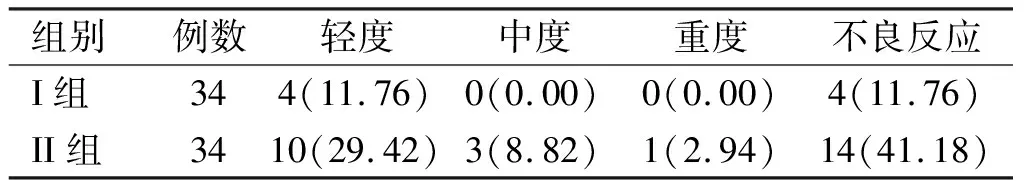
表4 两组患者拮抗后鱼精蛋白不良反应情况比较[例(%)]
3 讨论
鱼精蛋白是具有强碱性基团的碱性蛋白,在体内与强酸性的肝素结合,形成无活性的稳定复合物而使肝素失去抗凝活性。目前,临床上根据CPB前肝素的用量,以1∶1~1∶1.5一次性给予鱼精蛋白拮抗的方法常使肝素和鱼精蛋白不能合理匹配。鱼精蛋白用量过大,会影响凝血功能;鱼精蛋白过少即肝素过量,亦可产生抗凝作用。由于鱼精蛋白半衰期较肝素短,肝素-鱼精蛋白复合物可以分离,潴留在组织或内皮细胞中的肝素可以重新释放入血并再次产生抗凝作用,鱼精蛋白完全中和肝素1~8 h后,约50%的患者血中肝素测定阳性。因此,CPB结束后一次性大剂量给予鱼精蛋白可能导致肝素中和不全或肝素作用反弹。
为减少肝素-鱼精蛋白不匹配导致的出血增加,有研究采用剂量滴定法[5],但该方法主要依赖于浓度和血容量预测的准确性,且操作较复杂,限制了临床使用。本研究采用半量负荷量加半量微泵持续泵注法,结果显示,CPB后Ⅰ组患者ACT平稳,术毕、术后1小时时ACT无明显变化,而Ⅱ组ACT出现波动,表现在中和后5分钟,中和后30分钟ACT接近基础值,术毕、术后1小时ACT延长,需追加鱼精蛋白用量。同时Ⅰ组患者较Ⅱ组术中出血量、回收血量、术后6 h和24 h胸腔引流量均明显减少,ICU使用PRBC例数少于Ⅱ组,差异有统计学意义(P<0.05)。表明Ⅱ组更利于ACT值的恢复或接近CPB 前的生理值,且泵入速度均匀,便于根据肝素血输注速度随时调控,避免鱼精蛋白使用过量或肝素过量,从而减少术中出血,有利于围术期血液保护。
鱼精蛋白是临床上拮抗肝素唯一的药物,其毒性反应个体差异大,以低血压、低血容量较为常见,严重者可致肺动脉高压、急性右心功能不全。鱼精蛋白毒性反应发生率为3%~10.7%,严重毒性反应死亡率可高达到70%[8-10],其不良反应的防治,包括减慢给药速度、左房或主动脉根部注射[4]、钙等正性肌力药及预注抗组织胺药等的应用。经主动脉根部注射虽可避开鱼精蛋白直接进入肺循环,但操作复杂且存在潜在的损伤,临床使用受限。
有研究[2-3,7]显示,鱼精蛋白快注射时,游离鱼精蛋白可直接作用于心肌,诱导心肌细胞释放肿瘤坏死因子,抑制心肌收缩;还可通过释放组胺来降低冠脉灌注压,减少心肌血液供应,降低全身血管阻力,加重低血压。缓慢注射可减少游离的鱼精蛋白进入冠状循环,术中较少发生血流动力学波动[11]。本研究Ⅰ组经中心静脉途径采用半量负荷剂量加半量微泵输注法,操作简单,与Ⅱ组一次性大剂量给药相比,减少了鱼精蛋白毒性反应,特别是中、重度不良反应的发生。该方法既达到缓慢给药的要求,可短期内降低血中游离鱼精蛋白的浓度,同时又结合鱼精蛋白与肝素的药代学特点,使其合理匹配,预防“肝素作用反弹”。这也与朱蔚琳等[12]的研究结果一致,但方法略为不同(负荷小剂量+微泵维持法vs半量负荷量+半量微泵法),前者耗时更长。
总之,鱼精蛋白以半量负荷剂量加半量微泵持续输注法拮抗肝素,可减少CPB术中出血量、术后胸腔引流量和输血量,弱化鱼精蛋白不良反应强度。

