PIGK与PCNA在成釉细胞瘤中的表达与意义
赵尔杨,王 姗,孟 琰,施 磊,强冬霞
成釉细胞瘤是口腔颌面部常见的牙源性上皮肿瘤,约占牙源性肿瘤的60%。其临床特点具有局部侵袭和复发及恶变的风险[1-6]。虽然属于良性肿瘤,由于其自身的生物学特点,针对成釉细胞瘤局部侵袭性的研究成为近年来的热点。
成釉细胞瘤的病因并不完全清楚,可能来源于牙齿发育时期的各种牙源性上皮剩余例如:成釉器、Malassez上皮剩余、Serres上皮剩余、缩余釉上皮以及牙源性囊肿的衬里上皮。也有人认为此瘤可能发生于口腔黏膜上皮[1-6]。
糖基磷脂酰肌醇锚定蛋白质(glycosylphosph-atidyl inositol-anchored protein, GPI-AP)与肿瘤的侵袭与转移及血管生成密切相关[7-8],同时参与T细胞的增殖。PIGK是一种GPI-锚定氨基转移酶,由PIGK基因编码,参与GPI-AP合成过程的调控,是实现GPI-AP功能的关键酶[9]。
PCNA只存在于正常增殖细胞及肿瘤细胞,是反映细胞增殖状态的良好指标,在细胞增殖的启动上起重要作用[10-12]。
本课题对45例成釉细胞瘤进行回顾性分析,采用HE染色与免疫组织化学染色,观察PIGK与PCNA在成釉细胞瘤中的表达情况。
1 资料和方法
1.1 临床资料
收集哈尔滨医科大学附属口腔医院2017年1月—2018年12月期间收治的45例成釉细胞瘤患者的完整病例资料。其中男23例,女22例;年龄23~62岁,平均年龄45岁;发生于上颌骨14例,发生于下颌骨31例。
1.2 组织标本HE染色与免疫组化染色
组织标本用 10%的中性甲醛液固定,进行常规石蜡包埋。所有蜡块进行连续性切片,常规脱蜡,分别进行 HE 染色与免疫组化染色(immumohistochemical staining,IHC)。步骤如下:(1)pH值为9.0的EDTA缓冲液微波加热至95~98 ℃15 min,进行石蜡组织的抗原修复,PBS冲洗3次。(2)3%H2O2室温下孵育10 min,PBS冲洗3次。(3)5%BSA(武汉博士德AR0004)封闭15 min。(4)切片分别滴加一抗PCNA(武汉博士德No:BM0104)(1∶200)、PIG-K(Santa Cruz sc:398611)(1∶200),4 ℃湿盒内孵育过夜,PBS冲洗3次。(5)每张切片滴加1滴Polink-1(中杉金桥PV6002),37 ℃下孵育30 min,PBS冲洗3次。(6)DAB(中杉金桥ZLI9018)显色3 min左右,水洗以终止显色反应。(7)苏木素复染5 min;乙醇梯度上行脱水;二甲苯透明;中性树胶封片。显微镜下观察结果,阳性部位呈棕黄色或棕褐色,分布于细胞浆或细胞核。
1.3 评分标准
在光学显微镜下,每个标本随机选择5个高倍视野( ×400),记录每个视野中阳性细胞数的百分比和染色强弱后取平均数。阳性细胞数比例评分标准:0分为阳性细胞数<5%;1分为阳性细胞数占5%~25%;2 分为阳性细胞数25%~50%;3分为阳性细胞数50%~75%;4分为阳性细胞数大于75%。染色强度评分标准:0分为无染色;1分为染色弱(浅黄色);2分为中等强度染色(棕黄色);3分为强染色(棕褐色)。总评分为阳性细胞数比例评分与染色强度评分的乘积,乘积大于3为阳性表达[13]。PIGK阳性对照为口腔鳞状细胞癌组织,PCNA为口腔抗体公司提供阳性对照。阴性对照为PBS代替一抗后进行上述染色的结果。
染色面积评分标准:0~4分,染色强度评分标准:0~3分,两项内容相乘,结果分布范围:0~12分。所有免疫组化切片分为7个等级,即Ⅰ等级:<3分;Ⅱ等级:3分;Ⅲ等级:4~5分;Ⅳ等级:6~7分;Ⅴ等级:8~9分;Ⅵ等级:10~11分;Ⅶ等级:12分。
1.4 统计学方法
SPSS 19.0统计分析软件进行统计学分析,采用方差分析分别统计PCNA与PIGK的阳性表达与病理分型的关系,采用Spearman等级相关分析分别统计PCNA与PIGK之间的相关性,P<0.05具有统计学意义。
2 结 果
2.1 临床病理资料分析
按照2005年《WHO 牙源性肿瘤组织学分型》的标准,对所选蜡块进行常规HE染色复查,明确诊断为滤泡型30例,丛状型15例,单囊型4例,肿瘤侵犯包膜7例。
2.2 PCNA、PIGK蛋白在成釉细胞瘤中的表达
本次研究中PCNA与PIGK染色情况的描述顺序为:成釉细胞瘤常见病理分型(滤泡型、丛状型、单囊型)、成釉细胞瘤的富细胞区域和成釉细胞瘤的外围纤维结缔组织区域。此过程伴随PIGK阳性表达逐渐加强。
PCNA在不同病理分型的成釉细胞瘤均有阳性表达。滤泡型中(图1a,d)PCNA阳性细胞主要出现在上皮岛周边细胞的细胞核中(图1b,e)。PIGK在同一部位连续切片的免疫组化染色呈现阴性表达(图1c,f)。
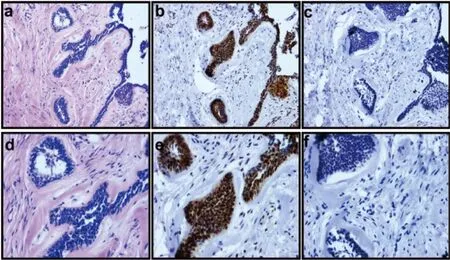
a:成釉细胞瘤滤泡型(HE ×100);b:PCNA在成釉细胞瘤滤泡型中呈阳性表达(IHC ×100);c:PIGK在成釉细胞瘤滤泡型中呈阴性表达(IHC ×100);d:成釉细胞瘤滤泡型(HE ×200);e:PCNA在成釉细胞瘤滤泡型中呈阳性表达(IHC ×200);f:PIGK在成釉细胞瘤滤泡型中呈阴性表达(IHC ×200)
图1PCNA与PIGK在滤泡型成釉细胞瘤中的表达
Fig.1Expression of PCNA and PIGK in ameloblastomawith follicular pattern
丛状型中(图2a),PCNA阳性表达出现在上皮条索外围,星网状层有轻度阳性表达(图2b)。PIGK在同一部位连续切片的免疫组化染色呈现阴性表达(图2c)。

a:成釉细胞瘤丛状型(HE ×100);b:PCNA在成釉细胞瘤丛状型中呈阳性表达(IHC ×100);c:PIGK在成釉细胞瘤丛状型中呈阴性表达(IHC ×100)
图2PCNA与PIGK在丛状型成釉细胞瘤中的表达
Fig.2Expression of PCNA and PIGK in ameloblastomawith plexiform pattern
单囊型中(图3a) PCNA阳性表达结果与以上两病理分型相似(图3b,3c)。

a:成釉细胞瘤单囊型(HE ×100);b:PCNA在成釉细胞瘤单囊型中呈阳性表达(IHC ×100);c:PIGK在成釉细胞瘤单囊型中呈阴性表达(IHC ×100)
图3PCNA与PIGK在单囊型成釉细胞瘤中的表达
Fig.3Expression of PCNA and PIGK in unicysticameloblastoma
从以上三种成釉细胞瘤病理分型中,并没有发现PIGK的阳性表达,为此我们观察了牙源性上皮的富细胞区域(图4a,d,g),这些区域并无典型的成釉细胞滤泡型或者丛状型特征,但可见清晰的PCNA阳性表达出现在细胞核中(图4b,e,h)。PIGK在同一部位连续切片的免疫组化染色中偶可见极弱阳性表达(图4c,f,i)。
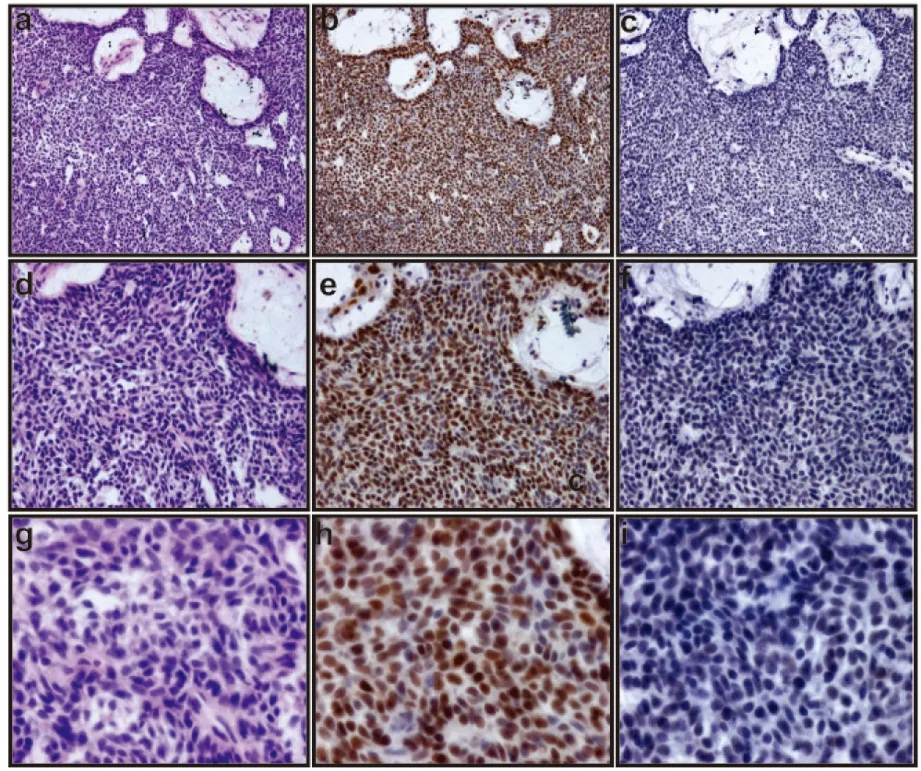
a、d、g为成釉细胞瘤滤泡型富细胞区(HE ×100,200,400);b、e、h为PCNA在成釉细胞瘤滤泡型富细胞区阳性表达(IHC ×100,200,400);c、f、i为PIGK在成釉细胞瘤滤泡型富细胞区少有阳性表达(IHC ×100,200,400)
图4PCNA与PIGK在成釉细胞瘤富细胞区域中的表达
Fig.4Expression of PCNA and PIGK in ameloblastomawith abundant cells
最终,我们总结发现免疫组化染色中,PIGK的阳性表达为3例,且为弱阳性表达,其他均为阴性表达。这种表达现象可以出现在瘤体的牙源性上皮中,见图5b,d。图5a,c是PCNA在同一部位连续切片的免疫组化阳性表达。同时,PIGK也出现在外周的纤维结缔组织中(图6b,d)。值得注意的是PCNA(图6a,c)与PIGK(图6b,d)阳性表达都可出现在成釉细胞瘤间质丰富区域,不同的是PCNA多数在牙源性上皮呈现阳性表达,而PIGK仅仅在肿瘤间质中有清晰的阳性表达。
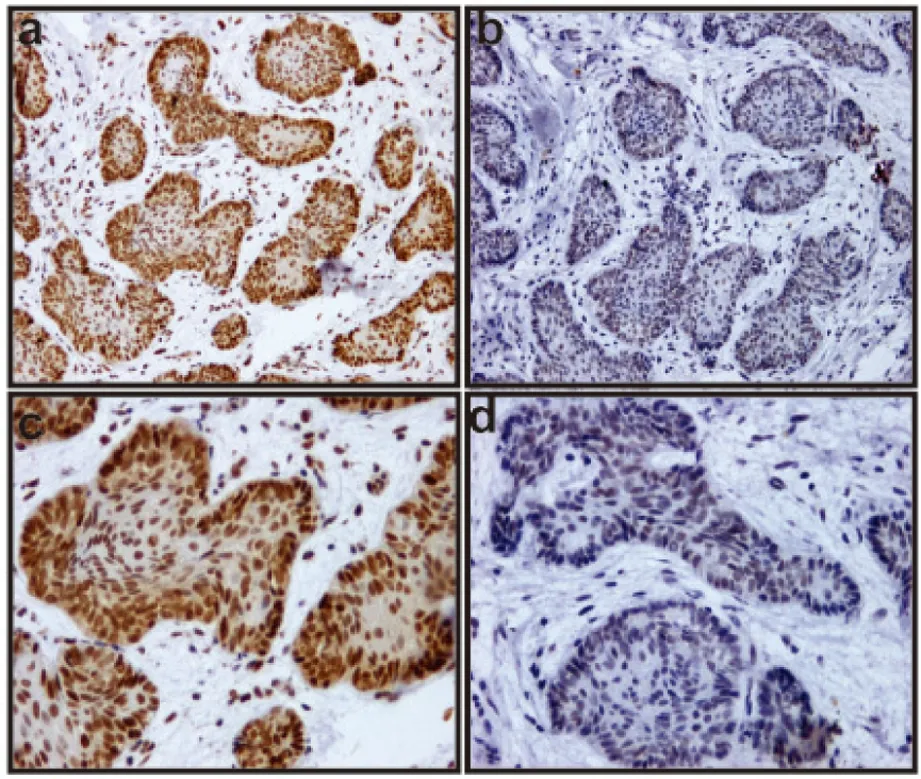
a:PCNA在成釉细胞瘤滤泡型中呈强阳性表达(IHC ×100);b:PIGK在成釉细胞瘤滤泡型中呈弱阳性表达(IHC ×100);c:PCNA在成釉细胞瘤滤泡型中呈强阳性表达(IHC ×200);d:PIGK在成釉细胞瘤滤泡型中呈弱阳性表达(IHC ×200)
图5PCNA与PIGK在成釉细胞瘤免疫组化染色强度对比
Fig.5Immumohistochemical staining intensity comparisonbetween PCNA and PIGK in ameloblastom

a:成釉细胞瘤中,PCNA在牙源性上皮边缘的纤维结缔组织中出现阳性表达(IHC ×100),牙源性上皮无阳性表达;b:PIGK在牙源性上皮边缘的纤维结缔组织中出现阳性表达,牙源性上皮无阳性表达(IHC ×100);c:成釉细胞瘤中,PCNA在牙源性上皮边缘的纤维结缔组织中出现阳性表达,牙源性上皮有阳性表达(IHC ×100);d:PIGK在牙源性上皮边缘的纤维结缔组织中出现阳性表达,牙源性上皮无阳性表达(IHC ×100)
图6PCNA与PIGK在成釉细胞瘤间质中的阳性表达
Fig.6Expression of PCNA andPIGK in stromaof ameloblastoma
PCNA的阳性表达结果见表1,PIGK的阳性表达结果见表2。PCNA表达与病理分型不存在相关性(P>0.05);PIGK表达与病理分型不存在相关性(P>0.05)。

表1 PCNA染色结果

表2 PIGK染色结果
2.3 PIGK与PCNA相关性
在现有病例中,我们没有发现PIGK与PCNA共同表达于同一病例的情况,虽然通过Spearman相关分析发现PCNA与PIGK存在相关性(r=-0.306,P=0.041)(等级资料信息见表3),但由于病例数限制和PIGK的极低阳性表达,无法认定两种蛋白在成釉细胞瘤中的表达呈负相关。

表3 Spearman分析等级相关资料
3 讨 论
GPI锚定氨基转移酶是一个家族蛋白,主要负责辅助多种真核生物大分子锚定于细胞膜上。GPI锚定氨基转移酶复合物有五个亚基,分别为PIGU、PIGT、GPAA1、PIGS和PIGK[4],在5个亚基中,PIGK(GPI18)在GPI蛋白功能发挥中扮演重要角色[9,14-19]。
PIGK可以通过催化内切蛋白酶过程及酰胺化作用实现GPI转运蛋白的目的[14]。我们前期的实验结果发现PIGK在口腔癌变的过程中基因出现转录增多的情况(未发表),由此推测PIGK可能参与口腔黏膜上皮癌变过程。最近Dasgupta等也发现结肠癌、肝细胞癌和泌尿道上皮细胞癌病人都会出现PIGK低度表达的情况[20]。这些研究结果在一定程度上提示PIGK有可能参与调节细胞中不同蛋白的修饰及转运功能,进而改变细胞的功能状态,参与细胞的侵袭迁移。成釉细胞瘤虽属良性肿瘤,但其生长具有局部侵袭性,术后复发率较高,本次研究以PCNA作为参考,了解成釉细胞瘤中牙源性上皮的增殖能力,对比观察PIGK的表达情况。
从实验结果中发现,PCNA在不同病理分型的成釉细胞瘤中都呈现清晰的阳性表达,表达结果集中出现在牙源性上皮的细胞核中。而与之对应的PIGK几乎没有出现阳性表达。在一例包膜侵犯的病例中,PIGK在牙源性上皮的外围纤维结缔组织中出现阳性表达,这些阳性细胞均出现在小血管周围。因此我们推测PIGK影响的细胞性质改变可能与疾病的炎症存在关联。此外,我们在两例滤泡型成釉细胞瘤中观察到PIGK呈现低表达,相比之下,带有富细胞区的病例没有出现阳性表达,提示成釉细胞瘤的复发或恶变与肿瘤性的牙源性上皮细胞的自身性质密切相关。为此推断成釉细胞瘤易复发或者恶变的特点可能与肿瘤实质细胞或肿瘤间质炎症性状均存在相关性。这种推论需要更多的临床病例及机制验证。
同时我们也发现PCNA作为增殖能力的标记物,几乎在本次研究的所有病例中都出现广泛阳性表达,这说明PCNA在预判成釉细胞瘤是否复发或恶变方面可能不具有显著特异性,PCNA在成釉细胞瘤中的非显著特异性在其他研究中也有提及[21]。还需要随访资料的支持。
总结:本次研究中并未发现PIGK可以大量表达于成釉细胞瘤中,阳性表达率较低,虽然这些肿瘤可能具有较强的增殖能力。因为PCNA的表达水平很高且与PIGK之间的表达不存在相关性,因此PIGK表达对成釉细胞瘤局部侵袭的意义还需进一机制研究加以证实。

