牙龈卟啉单胞菌对db/db小鼠骨髓来源巨噬细胞极化作用的初步探究
杨亚楠,于时卉,闫香珍,罗礼君
牙周优势致病菌如牙龈卟啉单胞菌(porphyromonasgingivalis,Pg)入侵组织后引发的一系列炎症反应和巨噬细胞极化在牙周炎发病过程中至关重要。巨噬细胞在牙周组织中广泛存在,可以通过识别清除病原体、杀伤靶细胞、抗原提呈、免疫调节等功能维持机体的稳态。巨噬细胞主要有两种不同的激活状态:经典活化型巨噬细胞(classically activated macrophages, CAMs),即M1型;选择性活化型巨噬细胞(alternatively activated macrophages, AAMs),也称M2型。在感染初期,巨噬细胞呈现促进炎症反应的M1表型,当直接危险因素去除后,逐渐转变为抵抗炎症的M2表型,以适应机体对炎症消除和损伤修复的需要。M1、M2激活失衡或表型转换的时机错乱都可能导致机体无法对感染和损伤做出合理的免疫反应,促进牙周炎的发展和组织损伤的加重。
目前,超过90%的糖尿病(diabetes mellitus, DM)是以胰岛细胞功能受损、胰岛素抵抗为特征的2型糖尿病(type 2 diabetes mellitus, T2DM)。而巨噬细胞极化在胰岛素抵抗中的作用尤其显著[1-2]。在肥胖人群中,T2DM的发生往往以慢性炎症为特征。现有研究表明,被招募到脂肪组织的巨噬细胞表现为M1型激活,导致一系列细胞因子(包括TNF-α、IL-6、IL-1β)介导炎症反应和胰岛素抵抗[3-5]。另一方面M2型巨噬细胞不仅抑制炎症细胞因子的表达,而且还通过分泌转化生长因子β1(transforming growth factor-β1, TGF-β1)抑制脂肪前体细胞的增殖,从而维持胰岛素的敏感性。目前, 许多研究已经证实了糖尿病与牙周炎的双向关系,二者疾病严重程度往往呈现相关性[6-9],提示控制血糖、血脂代谢对伴T2DM 慢性牙周炎患者牙周治疗效果意义重大。另一方面,牙周炎作为慢性炎症对糖尿病的代谢控制具有负面影响,慢性牙周炎目前被公认是导致血糖控制不佳的危险因素之一。
本课题组前期研究证实在C57BL/6J野生型小鼠中,Pg感染巨噬细胞可引起其向M1极化,加重组织损伤,而诱导M1巨噬细胞去极化或促使其向M2极化转变对减少损伤和促进组织修复具有重要意义[10]。本研究旨在初步探讨Pg对db/db小鼠(2型糖尿病小鼠)骨髓来源巨噬细胞(bone marrow-derived macrophages, BMDMs)的极化作用。
1 材料和方法
1.1 实验材料
1.1.1 主要仪器 C1000 TouchTMThermal Cycler PCR仪(Bio-rad,美国),Lightcycler480型荧光定量PCR仪(Roche,美国)。
1.1.2 主要试剂 DMEM高糖培养基(HyClone,美国),胎牛血清(Gibco,美国),青霉素链霉素溶液(Invitrogen, 美国),Trizol(Life Technologies, 美国),逆转录试剂盒(Takara, 日本),SYBR Green qRT-PCR试剂盒(Toyobo,日本),脑心浸液肉汤培养基(康润,中国),无菌脱纤维羊血(康润,中国),厌氧袋(三菱,日本),氯化血红素(国药,中国),维生素K1注射液(阿拉丁,中国)。
1.2 实验方法
1.2.1 小鼠骨髓来源巨噬细胞获取与培养 分别选取6~8周龄的C57BL/6J WT小鼠(来自南京生物医药研究院)和此来源的db/db小鼠,颈椎脱臼法处死,将小鼠浸泡于75%乙醇中30 s~1 min充分消毒,转移至超净台中。无菌下分离股骨头与髋骨,去除腿骨表面皮肤,将股骨与胫骨完整取出后置于PBS溶液中,剥除骨骼上附着的肌肉组织,分离股骨与胫骨。剪去骨骼两端后,将装有DMEM培养液1 mL无菌注射器针头插入骨髓腔,将骨髓反复冲洗至15 mL离心管中,直至骨髓腔变白。室温下,500g、10 min离心细胞后,弃上清,加入含20 ng/mL的M-CSF的DMEM培养液[11-13],以1×106个/孔铺于12孔板。在37 ℃、5% CO2条件下,用含10%胎牛血清的DMEM培养液进行培养。
1.2.2 牙龈卟啉单胞菌培养 无菌条件下,将PgATCC33277(上海交通大学医学院口腔医学研究所李鸣宇教授馈赠)溶于80~100 μL的羊血后均匀涂布于血平板上,置于厌氧罐内,37 ℃培养。4~5 d后,血平板上见黑色光亮、圆形的单个菌落,用无菌接种环挑取单克隆至无菌脑心浸液肉汤培养基中,在厌氧条件下培养24~48 h。通过菌落形态、革兰阴性染色等方法鉴定Pg为纯培养后,5 000 r/min、5 min离心,弃上清,PBS清洗3遍,液体培养基重悬。比浊仪检测菌液在波长600 nm处吸光值约0.5时,Pg浓度约1×109个/mL。
1.2.3 qRT-PCR 法检测db/db小鼠BMDMs中极化标志物基因表达情况 (1)将WT和db/db小鼠来源的BMDMs铺板,设立空白对照组、Pg组、IL-4组和Pg+IL-4组,分别加入Pg(MOI=50)和/或IL-4(20 ng/mL)刺激后置于培养箱中培养。之后在4、16 h时收样,-20 ℃保存。(2)采用Trizol提取总RNA,紫外分光光度计测定浓度与纯度并逆转录合成cDNA。使用基因特异性引物和SYBR Green qRT-PCR试剂盒进行实验。引物见表1。
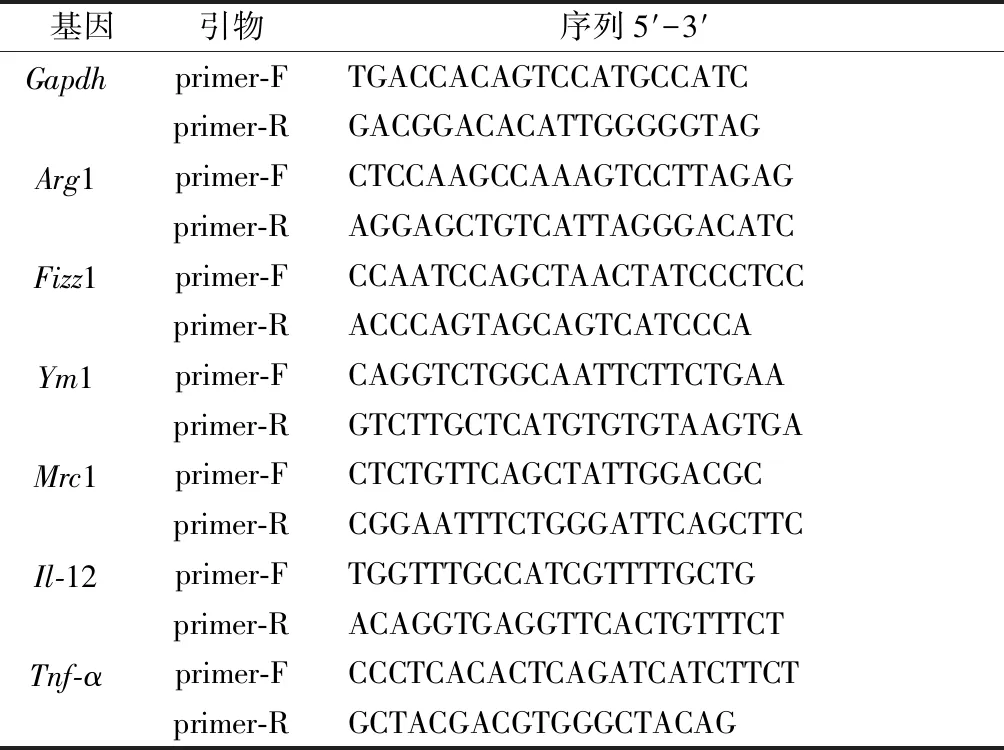
表1 实时荧光定量PCR引物序列
1.3 统计学方法

2 结 果
2.1 Pg对db/db小鼠BMDMs向M2极化的抑制作用减弱
糖尿病是牙周炎的高危因素,为了探讨糖尿病对Pg诱导下的巨噬细胞M1极化的影响,我们从db/db小鼠中分离出BMDMs进行实验。检测在Pg或/和IL-4的刺激下,db/db小鼠BMDMs中M1标志物Tnf-α、Il-12以及M2标志物Arg1、Ym1、Fizz1和Mrc1的基因相对表达量。
实验结果表明,WT小鼠的BMDMs在IL-4以及IL-4+Pg诱导下,M2极化标志基因Arg1、Fizz1和Mrc1的表达显著降低;而db/db小鼠BMDMs在IL-4诱导下,有无Pg感染,上述基因的表达水平无统计学差异(图1A,1B,1C),Ym1的表达明显下降(图1D),表明糖尿病能够部分削弱Pg对巨噬细胞向M2极化的抑制作用。

Arg1(A)、Fizz1(B)、Mrc1(C)和Ym1(D)mRNA的相对表达量。*:P< 0.05, **:P<0.01, N.S.指无统计学差异
图1Pg对IL-4诱导下的BMDMs表达M2标志基因的影响
Fig.1Effects ofPgon expression of M2markergenes of IL-4induced BMDMs
2.2 Pg促进db/db小鼠BMDMs向M1极化的作用减弱
实验同上,WT组,Pg上调M1极化标志基因Tnf-α的表达,且在IL-4的同时作用下,M1基因表达无明显下降;然而,db/db组Pg与IL-4协同刺激时,Tnf-α的表达量明显下调(图2A)。相较于WT小鼠,db/db小鼠Pg诱导BMDMs表达M1标志物Il-12的能力显著下调(图2B)。结果显示Pg促进db/db小鼠BMDMs向M1极化的作用减弱。综上所述,Pg对同种极化类型的BMDMs标志基因的影响并不是完全一致的,但在db/db小鼠中,巨噬细胞向M1极化整体呈现衰减的趋势。
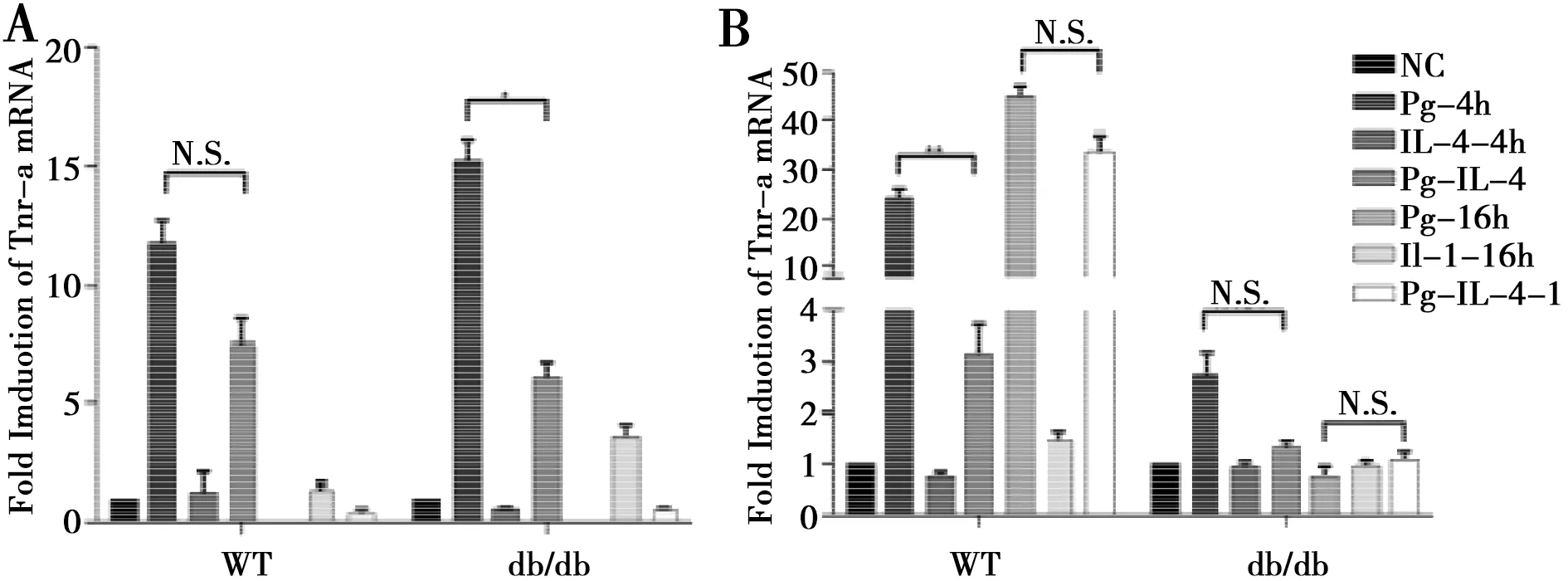
Tnf-α(A)和Il-12(B)mRNA的相对表达量。*:P< 0.05, ** :P<0.01, N.S.指无统计学差异
图2Pg对IL-4诱导下的BMDMs表达M1标志基因的影响
Fig.2Effects ofPgon expression of M1marker genesof IL-4induced BMDMs
3 讨 论
两种不同激活状态的巨噬细胞分别对应不同的病原刺激物,细菌脂多糖(lipopolysaccharide, LPS)和受损组织释放的损伤相关分子模式(damage-associated molecular patterns, DAMP)等病原成分刺激巨噬细胞发生经典激活,合成并释放大量的炎症性细胞因子,如肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)、白细胞介素-1(interleukin-1, IL-1)、IL-6和诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)等,参与细胞内病原体的清除和牙周组织的损伤及破坏[14];而IL-4和IL-13诱导巨噬细胞发生选择性激活,激活后的M2型巨噬细胞表达抵抗素样分子-α(resistin-like-α, RELMα/Fizz1)、壳多糖酶3样蛋白-3(chitinase 3-like 3, CHI3L3/Ym1)、精氨酸酶-1(arginase 1, Arg1)、甘露糖受体C-1(mannose receptor C-Type 1, Mrc1)和IL-10等分子,抑制寄生虫感染和炎症反应,促进损伤的修复和组织重建[15]。我们前期研究表明Pg通过抑制αKG代谢通路中相关基因的表达,诱导巨噬细胞向M1极化[10]。本研究结果显示,在糖尿病小鼠来源的同种极化类型的骨髓巨噬细胞中,M1和M2标志基因的表达趋势并不是完全一致的,Pg对M1极化的促进功能和IL-4对M2极化的诱导作用都遭到了一定程度的削弱,
db/db小鼠指瘦素受体突变的小鼠,这种基因敲除小鼠提供了一种单基因T2DM动物模型,具有肥胖和早期胰岛素抵抗的特征[16-17]。瘦素调节多种免疫和炎症过程[18-19],炎症刺激如TNF-α, IL-1或LPS刺激脂肪组织表达瘦素,反过来,瘦素促进细胞增殖、生存、迁移、趋化作用,细胞因子、蛋白酶和粘附分子的表达以及氧化应激。因此,瘦素受体的突变可能影响炎症因子的表达。5~28周龄的db/db小鼠不仅有典型糖尿病临床表现,也表现出心肌病、周围神经病变、糖尿病肾病、糖尿病视网膜病变、伤口愈合迟滞等糖尿病的并发症[20],这些疾病的常见表现是过度纤维化和组织重构,通常与M2巨噬细胞有关,而非炎性M1巨噬细胞,所以db/db小鼠中M2巨噬细胞的表达可能是增加的[21]。研究发现糖尿病的发展与db/db小鼠胃黏膜组织中巨噬细胞数量的增加和这些巨噬细胞中血红素氧合酶-1(heme oxygenase-1, HO-1)的上调有关,这些巨噬细胞呈CD206阳性即M2巨噬细胞[22]。
瘦素信号在维持吞噬功能中似乎是必需的,具有促进单核细胞和巨噬细胞产生炎症介质的能力[23]。有研究提出假设,肥大细胞(MCs)产生的IFN-γ和IL-6可能导致ob/ob 小鼠(即瘦素基因突变小鼠)来源的BMDMs减少向M1极化,来自ob/ob 骨髓肥大细胞的IFN-γ,IL-6和IL-13和其他未经检测的介质可能有助于增强巨噬细胞IL-4表达和M2巨噬细胞极化[24]。MCs与BMDMs体外共培养后,IL-4刺激后精氨酸酶-1和IL-10表达增加,但是抑制了脂多糖(LPS)刺激后诱导型一氧化氮合酶(iNOS)和IL-6的表达[24]。而ob/ob和db/db小鼠均是理想的2型糖尿病动物模型,由此我们推测db/db小鼠骨髓中的肥大细胞产生的细胞因子,可能促使BMDMs在Pg作用下仍高表达部分M2标志基因。
综上所述,Pg对db/db小鼠的BMDMSs向M1极化的促进作用减弱可能是由于在瘦素受体突变下IL-4诱导M2型的作用更敏感。但是Pg对糖尿病小鼠巨噬细胞极化机制的影响尚需深入研究。

