CTS-g-PAA/ATP水凝胶制备及对染料的吸附性能
段贤扬,何梦奇,徐继红,杨忠连
(安徽理工大学 化学工程学院,安徽 淮南 232001)
0 引 言
染料作为着色剂已在纺织、印刷、皮革、油漆、食品等许多工业领域得到了广泛的应用[1-3]。近年来染料废水正成为环境污染的主要来源之一[4-5],同时也给人们的身体健康带来很多的不良影响,因此,污染废水的处理变得至关重要。
壳聚糖是一种天然碱性多糖生物质,壳聚糖分子中的氨基和羟基能够通过氢键、静电引力等作用对金属离子和染料分子进行吸附,壳聚糖作为低廉可再生吸附剂在废水处理中受到了高度重视[6-7]。Mckay等研究了壳聚糖对染料的吸附性能,研究表明染料种类、温度、pH及吸附时间等因素对吸附效果影响较大[8]。但是单一的壳聚糖存在易溶胀、可溶于稀酸及力学性能差等缺点。因此在实际应用中,通过对壳聚糖进行交联、接枝及用有机/无机复合等改性方法来增强其吸附性和稳定性能是壳聚糖吸附剂研究的方向。高分子水凝胶是一种拥有轻度交联三维网状结构的新型材料。由于具有适当的吸水性、吸附性及易回收利用等特点,高分子水凝胶在染料废水的处理方面引起了人们广泛的关注[9]。壳聚糖是制备水凝胶的理想原料,通过交联和添加无机组分制备的壳聚糖基水凝胶在提高壳聚糖的机械强度、降低壳聚糖的酸溶性以及提高对染料的吸附能力已显示出较大的优越性[10-12]。
本研究以N,N-亚甲基双丙烯酰胺(NMBA)作为交联剂,通过自由基溶液聚合法接枝聚合制备了壳聚糖-g-聚丙烯酸/凹凸棒粘土(CTS-g-PAA/ATP)复合水凝胶吸附剂,以亚甲基蓝(MB)水溶液作为模型溶液,利用静态吸附法考察了溶液pH、MB初始浓度、电解质溶液浓度等因素同水凝胶吸附染料性能的关系,并探讨水凝胶对染料的吸附动力学和吸附等温线,为壳聚糖基水凝胶在染料废水处理领域的应用提供一些相关参考数据。
1 实验部分
1.1 试剂与仪器
壳聚糖(CTS),分析纯,浙江金壳生物化学有限公司;凹凸棒石黏土(ATP),工业品,安徽博硕科技有限公司;丙烯酸(AA),十二烷基硫酸钠(SDS),分析纯,天津市博迪化工有限公司;亚甲基蓝(MB),N,N-亚甲基双丙烯酰胺(NMBA),过硫酸钾(KPS)、氢氧化钠(NaOH)、盐酸(HCl),均为分析纯,西陇化工有限公司。
LWMC-201型微波反应器,南京陵江科技开发有限责任公司;UV-2550型紫外-可见分光光度计,日本岛津公司;Nicolet-380型傅里叶变换红外光谱仪(FTIR);S-3000N型扫描电子显微镜(SEM),日本日立公司;Scientz-10N型冷冻干燥机,宁波新芝生物科技股份有限公司。
1.2 CTS-g-PAA/ATP水凝胶的制备
准确称取0.6 g ATP ,移液管量取4 mL AA共同加入装有10 mL去离子水体积为200 mL的烧杯中搅拌溶解,之后加入1.63g的NaOH调节溶液的中和度为70%。另取0.4g的CTS溶于5%(wt,质量分数)的冰乙酸中,完全溶解之后倒入到上述烧杯中与溶液混合,然后在混合均匀的溶液中分别添入0.055 g的KPS和0.028 g的NMBA,再加入5 mL去离子水搅拌均匀混合,然后将烧杯快速转移到微波反应器中,设定微波功率325 W、反应时间2.5 min,开启微波反应器,反应完成后将反应物在干燥箱中于80 ℃下烘至恒重得CTS-PAA/ATP水凝胶,将凝胶在去离子水中浸泡、搅拌、洗涤,干燥,粉碎后得较纯凝胶。
1.3 吸附剂吸附性能的测定
1.3.1 水凝胶对MB溶液吸附量的测定
配制不同浓度的MB溶液,取200 mL MB溶液置于烧瓶中,加一定质量水凝胶到烧杯后密封瓶口,在室温下进行静态吸附,待吸附平衡后,取上清液1 mL经稀释后用紫外-分光光度计在MB最大吸收波长664 nm处测定吸光度,利用标准曲线法及式(1)计算吸附量(Qe,mg/g)
式中:Qe为MB的平衡吸附量,mg/g;C0和Ce分别为吸附前后MB溶液的浓度,mg/L;V为MB溶液的体积,L;m为树脂的质量,g。
1.3.2 溶液浓度对吸附量的测定
在体积200 mL、浓度为200 mg/L的MB溶液加入不同浓度的NaCl或SDS,加入0.15 g的水凝胶在室温下静态吸附,吸附平衡后按(1)式计算吸附量。
1.3.3 溶液pH对吸附量的测定
把1.3.2中体积浓度下的MB溶液配制不同pH后加入0.15 g水凝胶,测定吸附量。
1.3.4 时间对吸附量的测定
在200 mL、浓度分别为50和200 mg/L的MB溶液中加入0.15 g水凝胶,分别每隔一定时间取样,测定吸光度,按(1)式计算吸附量。
1.4 高吸水性树脂的结构表征
使用FTIR对样品结构进行表征,样品经KBr压片处理,扫描波长范围500~4 000 cm-1,分辨率2cm-1;利用SEM对水凝胶进行形貌结构表征。
2 结果与讨论
2.1 FTIR分析
CTS、ATP原料及CTS-g-PAA、CTS-g-PAA/ATP水凝胶吸附剂的红外光谱见图1和图2。
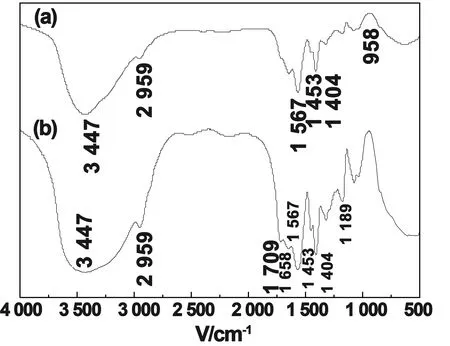
图1 CTS (a)和ATP (b) 的FTIR谱图
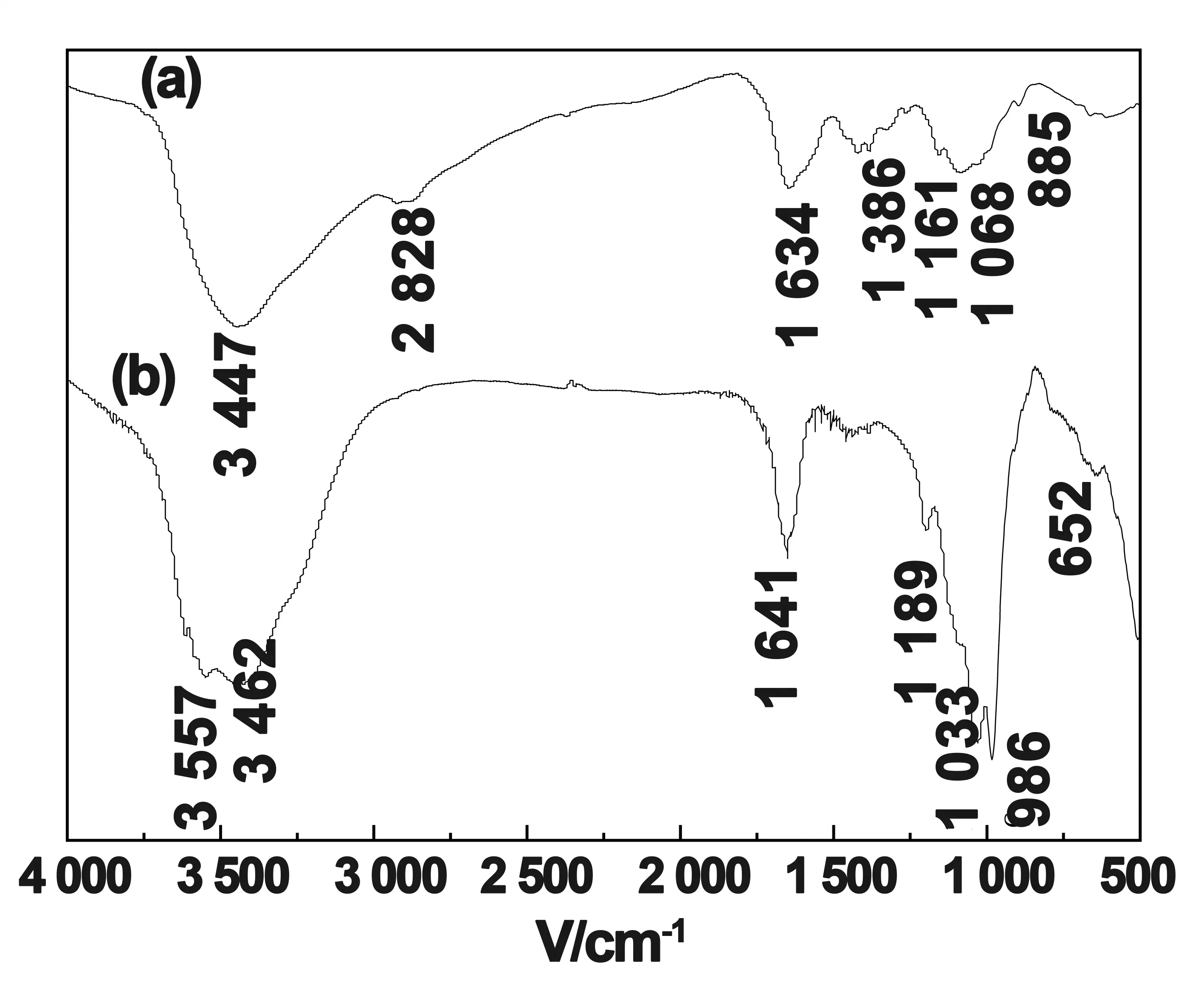
图2 (a) CTS-g-PAA和(b) CTS-g-PAA/ATP的FTIR谱图
在图1(a)CTS的的谱图中,3 438 cm-1是O-H和和N-H的伸缩振动峰,1 641cm-1是C=O伸缩振动峰,1 600 cm-1是一NH2的弯曲振动峰。在1 383cm-1是CH3弯曲振动吸收峰,说明壳聚糖含有一定量的乙酰氨基[13]。图1(b)ATP的谱图中,在3 681、3 557、3 462 cm-1是Si—OH伸缩振动峰,1 641cm-1是凹凸棒层间水伸缩振动峰,1 033、652 cm-1是Si—OH的弯曲振动峰,1189 cm-1是Si—O—Si伸缩振动峰。
在2(a)CTS-PAA谱图中,1 700cm-1是C=O振动吸收峰,1 567和1 453、1 404cm-1出现—COO-不对称和对称振动吸收峰,而壳聚糖中1 641cm-1特征峰消失,说明CTS中的NH2参与了接枝反应,AA已经接枝到CTS的骨架上。从图2(b)中可以看出,在1 189cm-1处出现了Si-O-Si的吸收峰,图2(b)其他吸收峰与CTS-g-PAA相同。同时ATP在3 681、3 557cm-1特征吸收峰消失,这说明ATP上的Si-OH 参与了反应[14]。上述分析表明AA、CTS和ATP 共同参与了接枝聚合反应,形成了CTS-g-PAA/ATP复合水凝胶。
2.2 SEM分析
CTS、APT、CTS-g-PAA/ATP 吸附MB前、后水凝胶的SEM见图3。
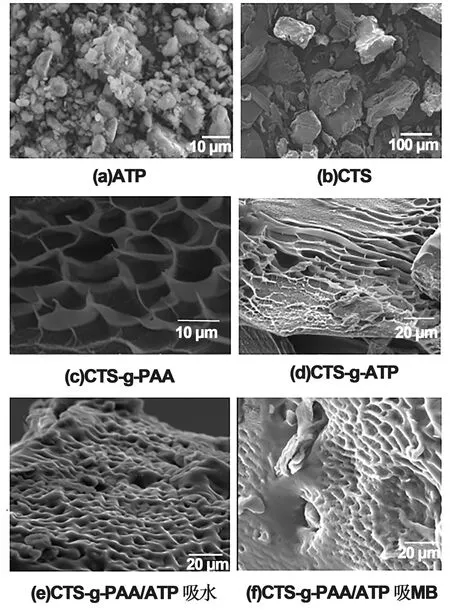
图3 ATP (a)、CTS(b)、CTS-g-PAA/ATP(c)、(d)、CTS-g-PAA/ATP吸水(e)和吸MB(f)的SEM图
图3(a)和(b)是原料ATP和CTS的形貌图。从图中可以看出,ATP是尺寸从0.1~1 μm左右大小不等,表面粗糙的絮状颗粒。CTS的表面凹凸不平,具有不规则形貌的片状结构,基本尺寸大约在100 μm左右。反应聚合后的水凝胶的形貌见图3(c)和(d),图3(c)显示,冷冻干燥后水凝胶表面呈典型的蜂窝状形状,形成三维网状分子链状结构,图3(d)可以看出,水凝胶断面由许多长条的孔洞组成,孔洞内部有许多的皱折或细条相连。
为进一步讨论MB分子对凝胶结构的影响,对吸水和吸附MB分子的凝胶进行常温干燥,凝胶的形貌图见图3(e)和3(f)。由图3(e)看出,吸水凝胶表面仍然呈现光滑的网络结构,孔洞依然清晰可见。由3(f)可以看出吸附MB后,凝胶的三维网络结构也没有完全被破坏,只是凝胶表面不再呈光滑状,孔洞内有许多细小粗糙的颗粒状物质,孔洞尺寸也有所减小,部分孔洞出现塌陷。吸水和吸附MB的凝胶干燥后结构有所不同,是因为MB阳离子与凝胶内部的阴离子强烈的静电相互作用形成的。通过一次吸附后,凝胶的网络结构依然存在,这也说明通过脱附再生后,水凝胶还可以进行回收使用。
2.3 溶液pH对吸附量的影响
溶液pH的变化影响吸附剂表面电荷分布和电荷密度,从而对吸附量产生影响,是研究吸附性能不可忽略的因素,溶液pH对吸附量的影响见图4。
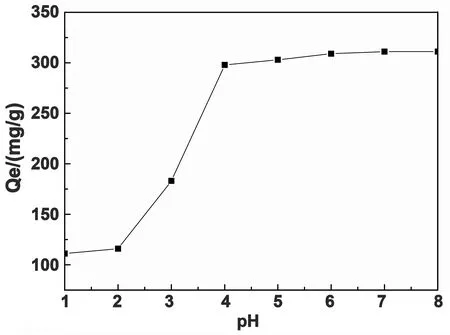
图4 溶液pH对MB吸附量的影响
从图4可以看出,随着溶液pH的增大,水凝胶对MB的吸附量增大,在pH>4时以后,吸附量随着pH的增大而急剧增大,pH=4~8之间时,树脂对MB的吸附量达到300 mg/g,并且保持基本不变。这是因为水凝胶对MB的吸附机理主要是静电吸引力和离子交换作用[15],而pH值的改变会引起凝胶表面的电荷分布和电荷密度的变化。在pH<4时,—COO-被质子化,导致羧基和羟基之间发生氢键作用,网络结构收缩,阻碍了MB分子的扩散,同时溶液中H+与带正电荷的MB分子在水凝胶的吸附位点存在较强的竞争吸附,凝胶与MB之间静电排斥作于增强;当pH>4后,凝胶结构中—COO-数量增多,高分子链段上的—COO-与阳离子染料的静电吸引作用起主导作用,吸附效果变得较为稳定,受溶液pH的影响较小,因此吸附量pH在4~7之间能维持一个恒定的范围[16]。
2.4 电解质溶液对吸附量的影响
通常印染废水中的无机盐、表面活性剂等电解质含量较高,研究盐离子存在对吸附平衡的影响有很大意义。以NaCl、SDS溶液为例考察水凝胶对MB吸附性能的影响见图5。
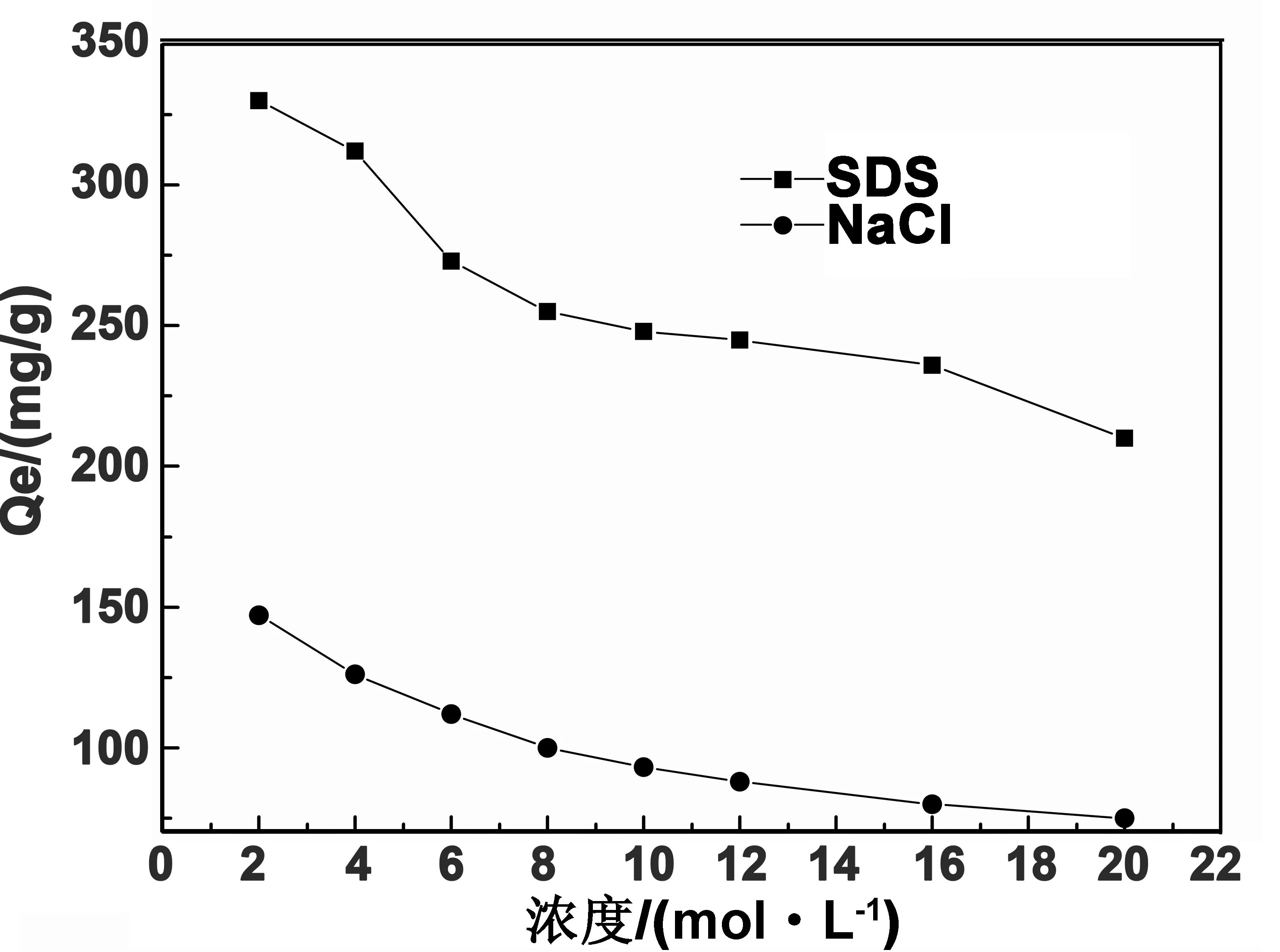
图5 电解质溶液对MB吸附量的影响
从图5可以看出,水凝胶对MB的吸附量随着NaCl、SDS溶液浓度的增大而减小,当电解质溶液浓度从2 mmol/L变化到20 mmol/L时,MB在NaCl、SDS溶液中的吸附量分别从147、330 mg/g变化到75、210 mg/g。凝胶聚合物链内外部溶液之间的渗透压差会随着外界盐溶液浓度的增加而减小,从而导致MB进入凝胶内部的推动力减少。同时电解质溶液中的阴、阳离子影响MB到达吸附位点的能力。溶液中Na+对带正电负荷的MB分子存在较强的竞争吸附,导致凝胶对MB吸附量下降。SDS是阴离子表面活性剂,水凝胶分子链里的阴离子与SDS阴离子有较强的排斥作用,与MB离子不存在较强的竞争吸附,因此吸附量较在NaCl溶液大。从实验可知,在处理印染废水中MB时,需要考虑废水中电解质溶液对染料吸附能力的影响[17]。
2.5 MB初始浓度对吸附量的影响
不同温度下,凝胶对MB的吸附效果随其初始浓度的影响见图6。
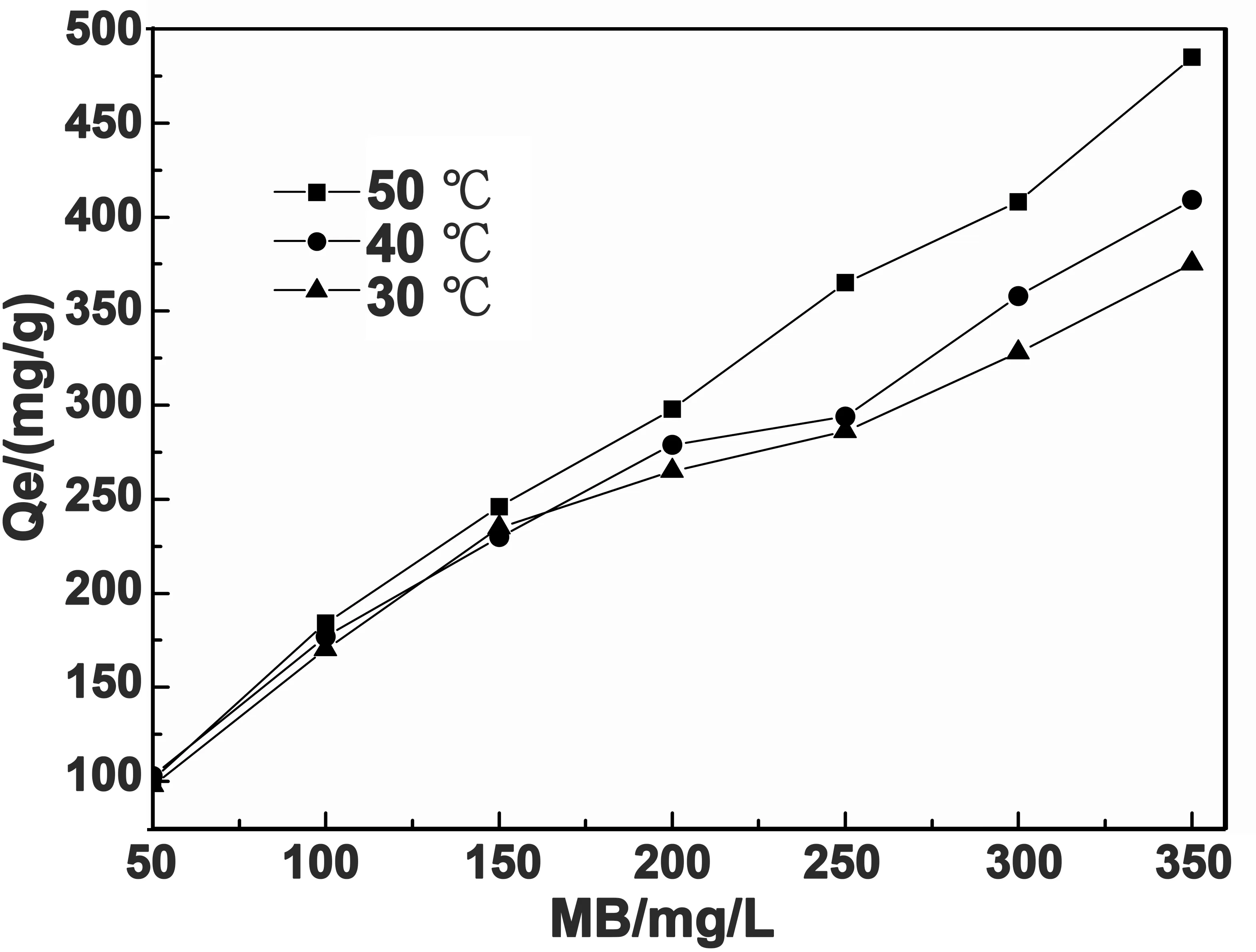
图6 MB初始浓度对吸附量的影响
由图6可以看出,随着MB初始浓度从50 mg/L增加到350 mg/L,水凝胶对MB的吸附量分别从101、103、98 mg/g增加到485、407、375mg/g;当达到一定之后,吸附量变化量减少最终基本趋于恒定。这是因为在吸附位点一定时,MB浓度增加,吸附位点能吸附更多的MB,从而引起吸附量的增加。随着MB初始浓度进一步增加,空余吸附位点逐渐减少,当吸附位点被MB完全占用后,MB浓度继续增大,吸附量也不再增加。从图6看出,温度升高利于水凝胶吸附MB,水凝胶对MB的吸附是个吸热过程。
2.6 吸附动力学
为研究水凝胶对MB分子的吸附机理,寻求描述吸附的动力学规律,凝胶对MB的吸附量随吸附时间的变化趋势见图7。
本研究分别采用准一级动力学和准二级动力学模型对图7实验数据进行拟合,方程可分别用(2)和(3)式表示[18]:
(2)
(3)
式中:K1为准一级模型的吸附速率常数,min-1;K2为准二级模型的吸附速率常数,g/(mg·min);Qt为吸附时间t时的吸附量,mg/g;Qe为平衡吸附量,mg/g;表2中Qe,cal为实验计算平衡吸附量。
拟合曲线结果见图8和图9,方程中的吸附速率常数、平衡吸附量和回归相关系数的计算结果见表1。
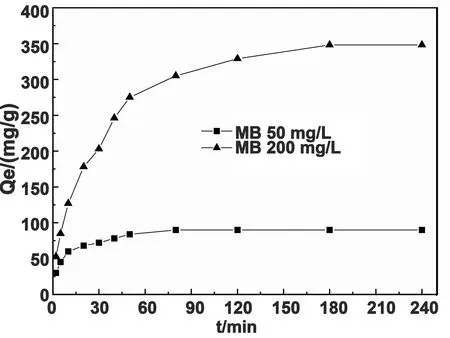
图7 吸附时间对吸附量的影响
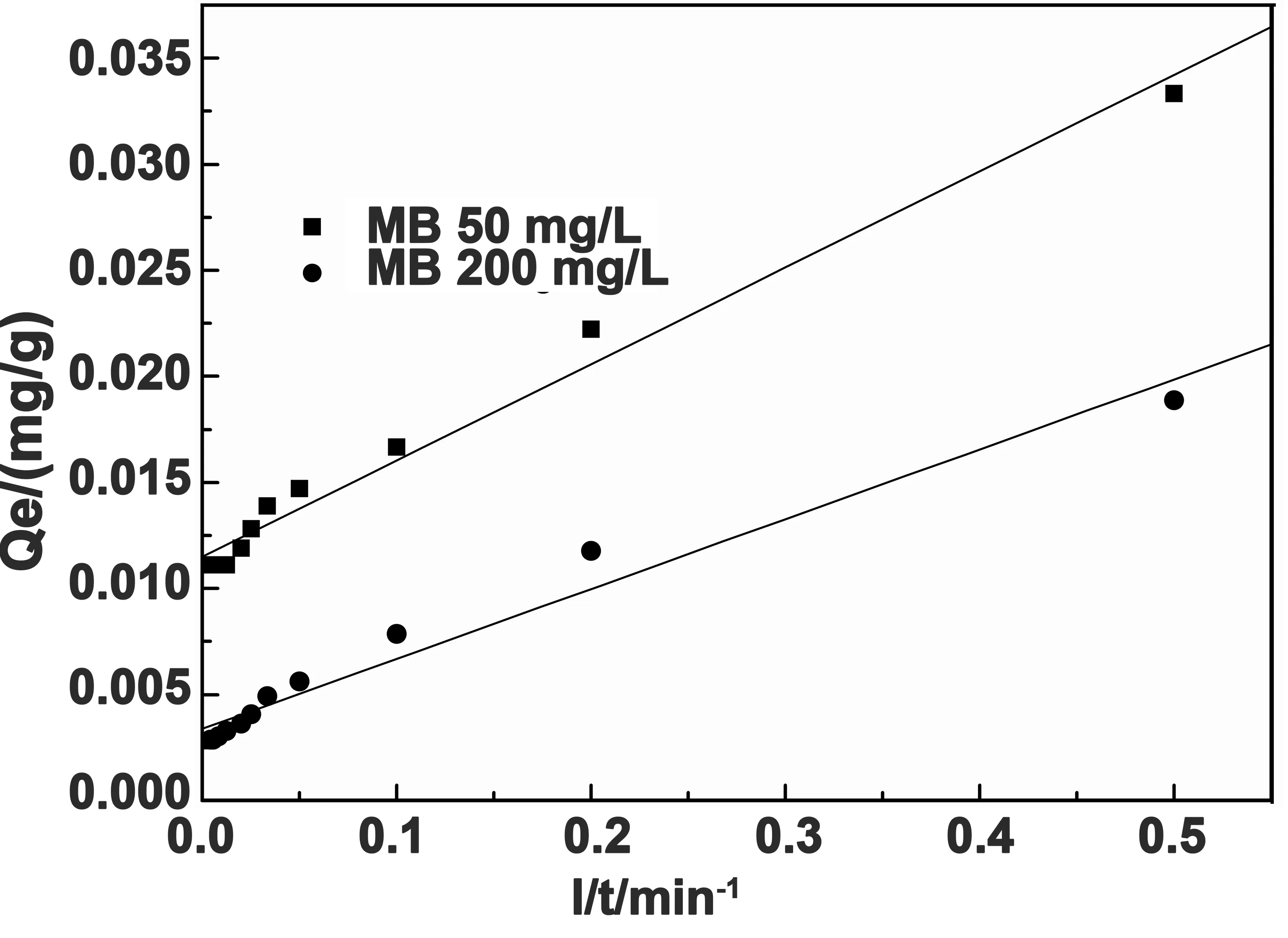
图8 吸附动力学准一级拟合曲线
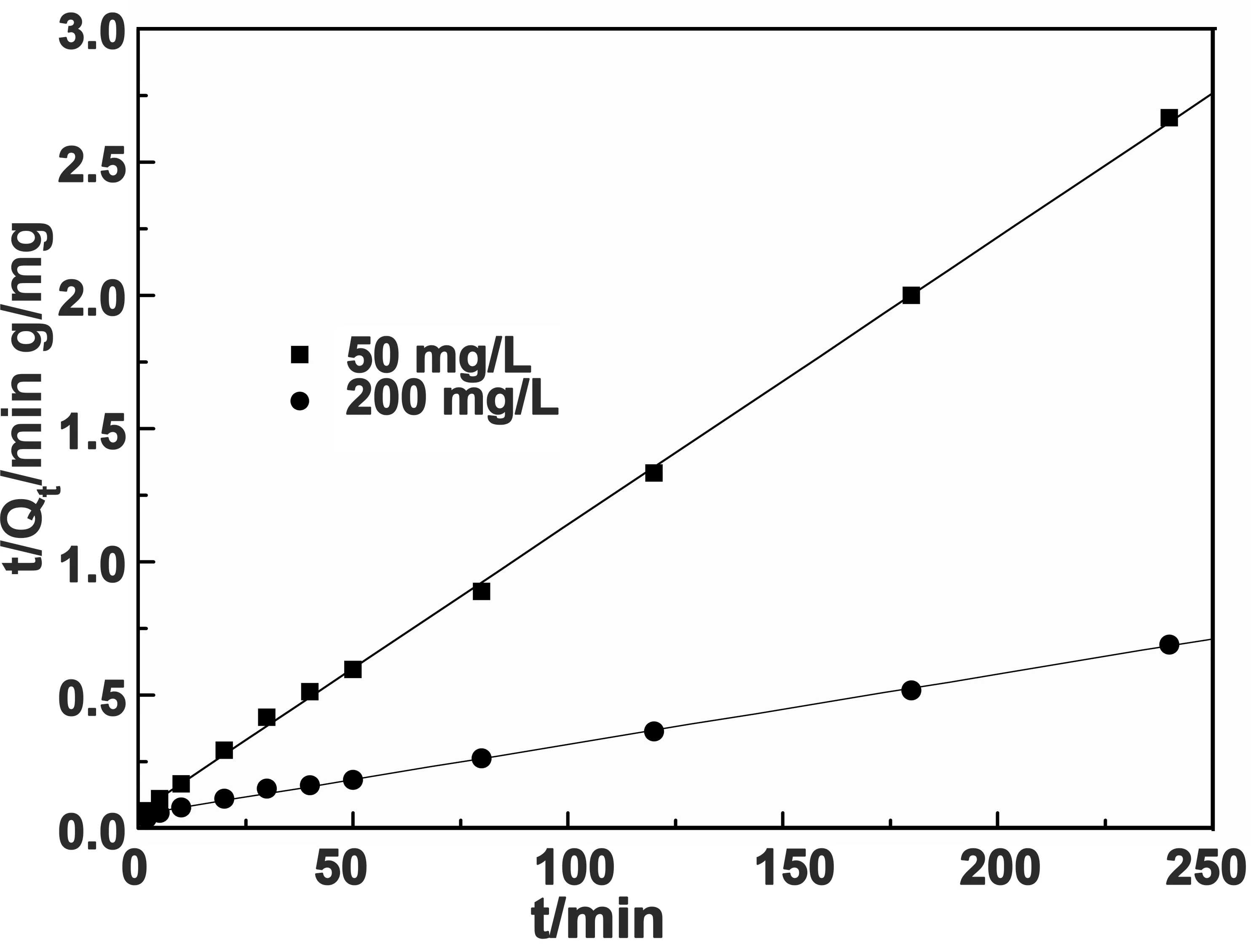
图9 吸附动力学准二级拟合曲线
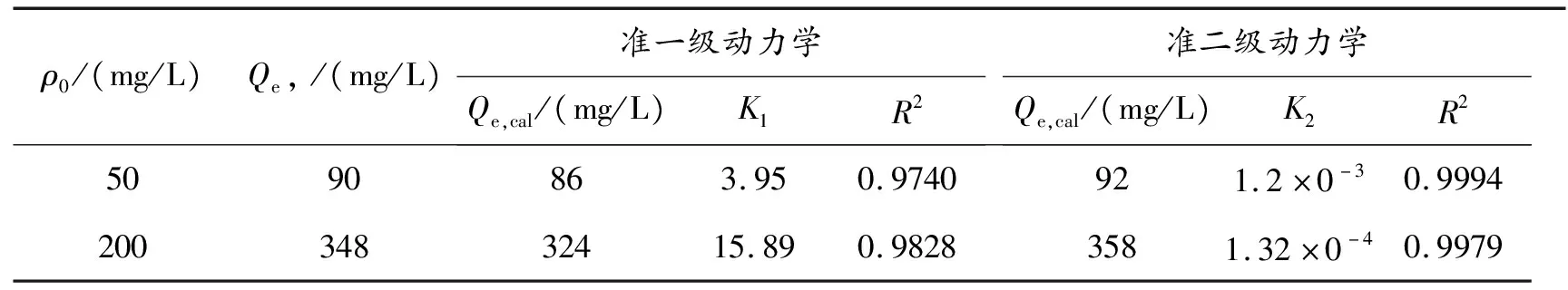
表1 凝胶对MB的准一级和准二级动力学参数
从图8、图9及表1可以看出,水凝胶对MB的吸附过程用准一级及准二级动力学方程拟合后,其R2都大于0.97,说明水凝胶对MB的吸附可以用这两种动力学模型能进行描述,相比之下,准二级动力学的R2>0.997,同时,用准二级动力学模型计算的两种浓度溶液中的Qe,cal与Qe更为接近,这说明所制备的水凝胶对MB的吸附行为应用准二级动力学模型描述更为准确。动力学研究表明水凝胶对MB的吸附主要属于化学吸附过程。
2.7 吸附等温方程
为研究水凝胶对MB的吸附机理,本研究对实验数据进行Langmuir、Freundlich等温吸附方程线性拟合。其线性拟合方程可分别用(4)、(5)表示[16]:
(4)
lgQe=lgKF+1/nlgρe
(5)
式中:Qo为单层平衡吸附量,mg/g;KL为Langmuir常数,L/mg;KF为吸附能力常数,mg/g;n为吸附剂的吸附强度;n>1表示吸附易于发生,n<1表示吸附进行较慢。
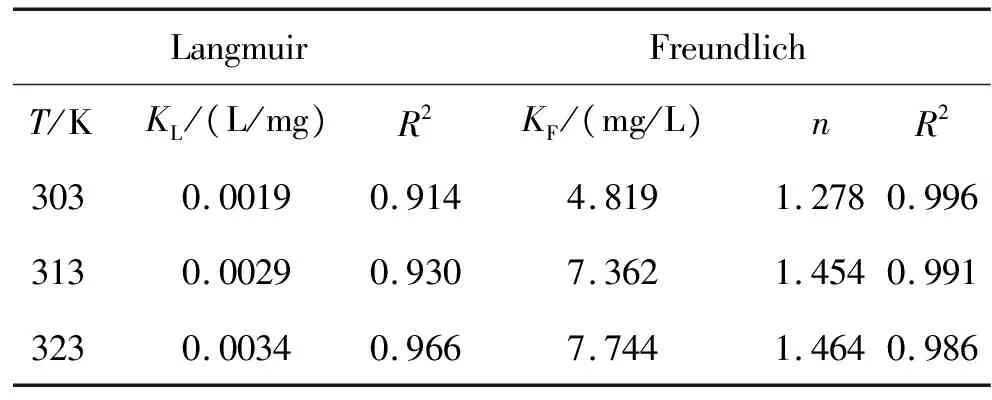
两种等温模型在不同温度下的吸附实验结果见图10、图11和表2。从图10、图11和表2可知, Langmuir和Freundlich方程的相关系数均高于0.90,表明这两种等温模型均可以用来描述水凝胶对MB的吸附行为。在温度变化(303-323 K)时, Freundlich方程的相关系数保持在0.98以上(R2=0.981-0.996),分别大于对应温度下Langmuir的相关系数,说明Freundlich模型更能准确反映凝胶的吸附特征。KF随温度升高而增大,说明升高温度有利于提高凝胶对MB的吸附能力,该吸附是个吸热过程。与此同时,Freundlich等温吸附方程中n在3个温度下的值都大于1,说明水凝胶对MB的吸附过程很容易进行。
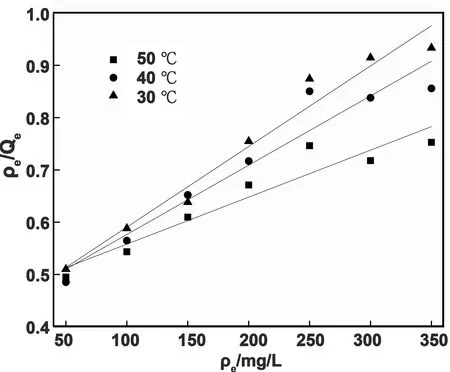
图10 Langmuir吸附等温方程拟合曲线
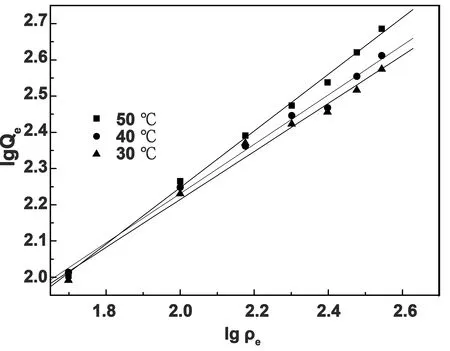
图11 Freundlich 吸附等温方程拟合曲线
3 结 论
通过自由基聚合法合成了CTS-g-PAA/ATP水凝胶,FTIR和SEM显示AA和CTS、ATP发生了接枝共聚反应,形成具有均匀的三维交联网状结构的凝胶,MB对凝胶的结构具有一定的收缩作用。电解质溶液浓度、溶液pH对MB的吸附影响较大,浓度为2 mmol/L的NaCl、SDS溶液中,凝胶对MB的吸附量分别147、330 mg/g。pH在4~7之间维持一个恒定的吸附能力,吸附量为300 mg/g。水凝胶对MB的平衡吸附满足Freundlich吸附等温方程,吸附过程能较好地遵循准二级动力学规律,吸附过程属于化学吸热反应过程。
表2凝胶对MB的Langmuir和Freundlich等温参数和判定系数
Table2LangmuirandFreundlichisothermconstantsandcorrelationcoeffcientsfortheadsorptionofMBontohydrogel
LangmuirFreundlichT/KKL/(L/mg)R2KF/(mg/L)nR23030.00190.9144.8191.2780.9963130.00290.9307.3621.4540.9913230.00340.9667.7441.4640.986

