微波消融治疗晚期恶性肿瘤
李 红 闫 雷
随着恶性肿瘤发病率的逐年上升,晚期的患者也越来越多。晚期患者往往有全身多个脏器受累涉及,对于已经失去手术机会的晚期患者,合理地选择适当的微创姑息治疗可以减瘤、改善症状,从而为患者提供更好的生活质量。消融治疗肿瘤是近年来新兴的微创治疗技术,经皮穿刺微波消融(PMAT)作为局部热消融的一种,已广泛应用于各种实体肿瘤的治疗。本研究对我院用PMAT技术治疗的67例晚期恶性肿瘤患者的结果报道如下:
1 资料与方法
1.1 一般资料 本研究收治2017 年1 月-2019 年1 月在我院住院治疗的IV期恶性肿瘤患者67 例,分别住在肿瘤内科和外科,均有病理证实患有恶性肿瘤,KPS评分≥70 分,评估生存期>6 个月。其中肺癌患者15 例,肝癌患者18 例,结直肠癌9例,乳 癌 患 者7 例,胃 癌4 例。男44 例,女23 例,年龄38~81 岁;130 枚病灶,位于肝脏部位病灶62枚,肺部病灶38 枚;病灶直径1.6~12.0 cm。对于超过6 cm的病灶都采用多次消融的治疗方法。排除标准:精神异常、腹水、凝血功能差、邻近重要血管、侵及胆囊、膈肌或肠管、体积过大并边缘不清的肿瘤。所有患者术前签署知情同意书。
1.2 仪器与方法 应用西门子256 排螺旋CT,南京维京九洲医疗器械研发中心生产的微波消融仪,治疗前对患者进行包括血常规、肝肾功能、凝血功能、心电图等常规检查;常规备急救药物、胸腹腔穿刺引流包;CT扫描确定病灶部位深度及范围,在体表做好穿刺点和进针角度标记,计算穿刺针进针路径及深度;2%利多卡因穿刺进针点局部麻醉,热消融探针通过标记点皮肤直接穿刺进入靶组织中。通过CT影像反复确认消融探针处于正确位置,接通电极线,打开微波发生器的电源,调节消融时间及功率后打开消融电源。一般的时间为4~10 min,功率为40~60W。消融范围应超过肿瘤边缘0.5~1.0 cm,≤3 cm肿瘤采用1 点消融,>3 cm采用多点消融。完成治疗后,拔出消融探针时要注意消融穿刺针道。消毒包扎伤口后CT扫描,观察病灶变化及有无出血等并发症。在整个治疗中应用心电监护仪监测生命体征。
1.3 效果评定 通过KPS评分表评定患者术前及术后30 d的体力情况,KPS评分增加≥20,并且持续4 周认为有效;治疗后第30 天、90 天、120天复查CT并观察病灶变化,一般在消融后3 个月评价疗效,按照改良的实体瘤疗效评价标准(RECIST)。通过随访1 年生存率及2 年生存率评定患者的远期疗效。
2 结 果
2.1 近期疗效 本研究67 例共130 枚病灶接受了104 次PMAT治疗,成功率100%。消融后CT平扫均为边界清楚、均质的低密度区,病灶范围较治疗前稍大,增强扫描内部无强化。肿瘤完全消融率为68.46%(89/130)。治疗后1 个月患者的体力改善率95.52%(64/67)。行CT检查,和治疗前相比,病灶体积改变不明显,有些病灶中存在液化坏死或空洞。3 个月复查CT,稳定、进展的病例分别为53 例、14 例,总有效率79.23%(53/67)。见图1。
2.2 远期疗效 随访至2019 年11 月,1 年生存率80.60%(54/67),2 年生存率71.43%(20/28)。
2.3 并发症 治疗过程中38 例出现穿刺部位轻至中度疼痛,2 例重度疼痛,7 例少量气胸,2 例少量胸腔积液,1 例持续性发热,均在对症治疗后情况改善。无大出血、休克。
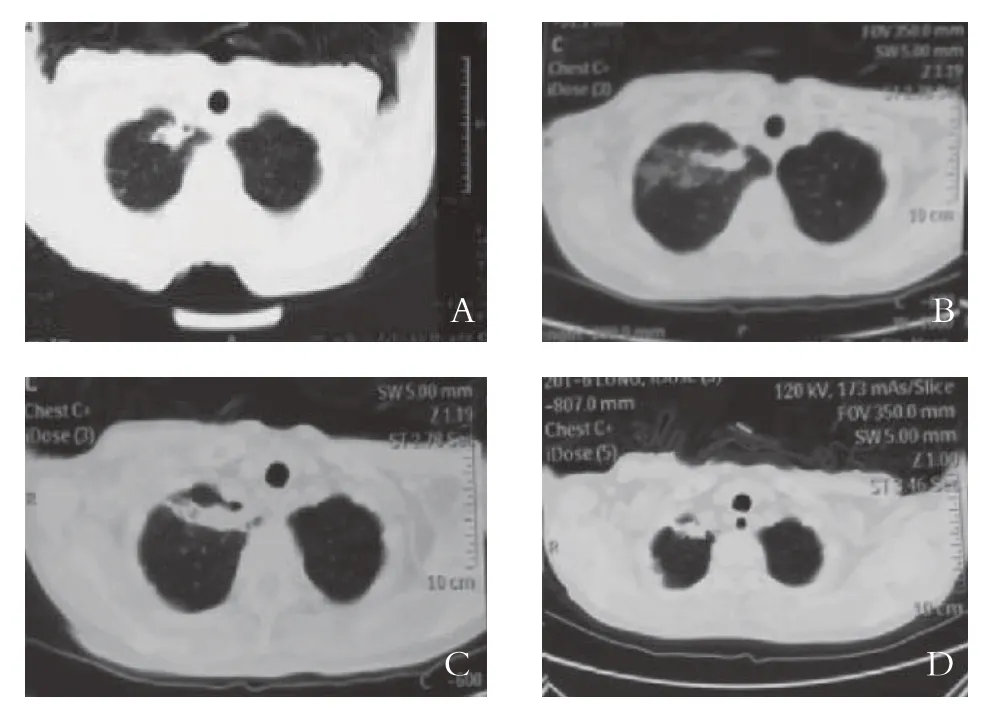
图1 微波消融治疗晚期恶性肿瘤的CT特征
3 讨 论
对于处于IV期的晚期肿瘤患者,已经经历过手术、放疗、化疗等综合性治疗,多线治疗后进展,姑息性手术作为一种局部的治疗方式,一般要联合靶向治疗、免疫治疗、支持治疗或者化疗等全身治疗方式,改善症状,减轻疼痛,提高存活期的生活质量。
ASCO基于7 项随机对照研究和专家共识,提出,有充分证据表明姑息治疗和标准抗癌治疗联合会给患者和照顾者更好的结局[1]。而姑息性手术的目的通常是为了提高生活质量或是提高对化、放疗的敏感性,提高疗效。消融术是近年来发展迅速的姑息性手术方法。国内外常见的消融手段有热消融,包括微波消融(MAT)、射频消融(RFA),另外还有冷冻消融术。MAT主要是其热效应:生物组织被微波辐射后,导致该区组织细胞内的极性分子发生高速振荡,与相邻分子频繁摩擦而将微波能量转变为热能,使组织坏死、凝固。对病灶区域给予915 MHz或2450 MHz 频率的微波,局部迅速达到高温(60 ℃~100 ℃),组织发生脱水、凝固及坏死[2]。MAT快速升温、瘤内温度高,对周围正常组织的损伤小[3],优势明显。
目前国内MAT术尚处于发展期,其综合治疗肿瘤后晚期患者的适应证主要有:经病理学或细胞学证实的恶性实体瘤患者,瘤种不限,转移性癌灶,术后复发灶或多发性癌灶,尤其可用于无法手术或化疗治疗失效的病例;KPS评分≥70 分,预计生存期6 个月以上;无主要器官的功能障碍。在微波消融治疗时,一般应依据肿瘤的位置、大小、深浅和数目安排微波消融针的顺序。治疗中遵循先深部后浅部,先疑难后容易部位,先主要病灶后次要病灶的原则。对于较大的瘤体采用多点位治疗分次进行。本研究有24 例患者,因瘤体大而采用多次消融治疗,最大直径12 cm,先后五次消融治疗,消融间隔时间根据患者身体状况及疗效,一般间隔时间超过1 个月。采用分次治疗是由于在治疗中微波消融产生组织高温使靶区组织出现强回声,干扰后点位微波消融的超生显像的定位和治疗。对于大病灶的多次消融治疗,是在有效的全身治疗的前提下,通过局部多次消融达到减瘤的目的。关于大病灶的多次消融治疗目前国内外尚无相关方面的报道,24例患者多为肝癌或肝转移癌,采用多次消融治疗后,结果证实是安全有效。多采用TACE PMAT 联合治疗取得了较好的疗效[4],TACE能阻断肿瘤的供血动脉,可以治疗目标肿瘤周围病灶包括卫星病灶,而PMAT高温也可能会增加化疗药物细胞毒性作用。本研究治疗后1 个月95.52%的患者体力状况得到改善,3 个月CT评估73.32%好转,近期疗效尚满意。全组患者1 年生存率达到80.60%(54/67),比相关报道偏高[5],可能是和瘤种相关,我们研究中纳入了EGFR突变的肺腺癌或者预后较好的乳癌,虽然全组患者均是在多线治疗后进展的IV期,但是在PMAT术同时予以化疗、靶向治疗、内分泌治疗等全身治疗相结合,仍有很好的疗效。PMAT主要目的就是降低肿瘤的负荷,配合全身治疗。PMAT治疗最常见并发症是穿刺点疼痛,另外还有少量胸腔积液、气胸,针道种植转移、继发性感染等少见。
综上所述,PMAT是近年来快速发展的肿瘤治疗技术,对晚期肿瘤患者,无根治机会,联合适当的全身治疗,具有较好的近期疗效,值得进一步推广应用。对于较大的病灶实行多次的消融治疗也是一个减轻肿瘤负荷的有效的措施。

