甲状腺良恶性结节性病变的MRI诊断及鉴别诊断
易 和 陈刘成 周广春 徐卫东
甲状腺结节是人体内分泌系统常见及多发病变,近年来发生率呈上升趋势,我国发病率约为10%,在甲状腺结节性病变中,以结节性甲状腺肿的发病率最高,甲状腺腺瘤、甲状腺癌等发病率居后[1],正确诊断对患者的治疗及预后有重要临床意义。甲状腺病变的影像诊断方法以超声及CT在临床应用较多,MRI应用相对较少。磁共振扫描能多方位、多序列观察,对正常组织和病变组织能提供较丰富的诊断信息,同时,MRI增强扫描可以在一定程度上反映甲状腺结节的血供情况,有助于甲状腺良恶性结节的诊断及鉴别诊断[2]。鉴于MRI以上优点,本研究通过给予甲状腺结节患者检查,以病理结果为对照,探讨MRI对良恶性甲状腺结节的诊断价值。
1 资料与方法
1.1 一般资料 收集本院2014 年2 月-2018 年9 月经手术病理诊断的甲状腺结节性病变患者共43 例,男9 例,女34 例,年龄25~72 岁,所有病例均行MRI检查。其中39 例患者是偶尔发现颈部肿块或者体检发现甲状腺结节就诊,其余4 例患者因为肿块压迫出现呼吸不畅或者吞咽不适伴疼痛感就诊。
1.2 检查方法 采用西门子1.5T Essenza超导磁共振仪器,使用头颈部联合线圈,患者取仰卧位,嘱咐患者均匀呼吸,在扫描过程中勿做吞咽动作。扫描层面采用横断位、及冠状位;平扫均采用TSE序列:T1WI(TR 490 ms,TE 11 ms),T2WI(TR 3800 ms,TE 85 ms),T2WI压 脂(TR 6750 ms,TE 64 ms),DWI序 列(TR 3000ms,TE 104ms,b=1000 s/mm2),层厚3 mm,层间距为0.5 mm,矩阵256×256,视野FOV 230×230 mm。扫描对比剂使用钆喷酸葡胺(Gd-DTPA),剂量0.2 mmol/kg,首先采用T1WI压脂预扫,增强扫描参数与平扫T1WI相同,采用静脉团注后行2 次横轴位及1 次冠状位扫描。
1.3 读片分析 由两位高年资经验丰富的MRI诊断医师进行读片分析,观察甲状腺结节形态、边界、大小、信号、颈部淋巴结等影像学特征,最后得出诊断结论,若存在分歧,将由另一位同等资历医师读片,最终以少数服从多数原则确定结论。测量ADC值时,首先在 DWI 图像上选择病灶最大层面,然后在ADC图上画出感兴趣区,测量出ADC值,取病灶最大层面及其上下两层,分别测量3 次,后取最小值。
2 结 果
结节性甲状腺肿患者19例,其中腺瘤型甲状腺肿3例,病灶位于两侧甲状腺5例、发生囊变9例,病灶直径0.6~5.5 cm,平均(2.32±1.05)cm。本组有3 例甲状腺肿患者术前误诊为甲状腺腺瘤,其余均与术后病理诊断相符。甲状腺腺瘤患者14 例,均为滤泡性腺瘤,所有病例均发生在一侧,其中6 例囊变,病灶直径2.5~6 cm,平均(4.07±0.93)cm;单纯性桥本甲状腺炎患者1 例;甲状腺癌患者9例(乳头状癌8例、髓样癌1例),1例发生在甲状腺峡部,其余均发生在一侧甲状腺,病灶直径0.6~ 4.0 cm,平均(2.06±1.00)cm。本组术前漏诊1例1 cm大小的甲状腺乳头状癌。
本组患者所有病变的ADC值测定,b值均取1000 s/mm2。其中良性结节性病变的ADC值范围:(1.150~2.130)×10-3mm2/s,平均ADC值1.200×10-3mm2/s;恶性结节性病变的ADC值范围:(0.610~0.380)×10-3mm2/s,平均ADC值0.510×10-3mm2/s。
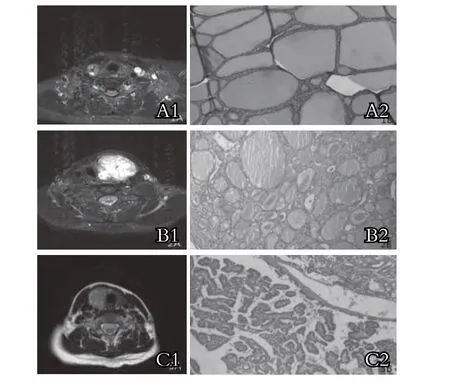
图1 甲状腺良恶性结节性病变的特征
3 讨 论
甲状腺病变的病理基础大多为甲状腺滤泡及其周围结缔组织的破坏、增生以及滤泡上皮细胞的分化变异,从而在影像与病理上出现了各种不同表现。甲状腺结节较小,虽然超声检查可以早发现,但缺乏特征性的影像表现,定性较困难。与其他传统影像学方法相比,MRI具有较高的软组织分辨率,其多方位、多参数及功能成像,可以提供更多的影像信息,优势更加显著[2]。
3.1 结节性甲状腺肿的发病原因与碘的摄取、各种炎症及甲状腺素代谢异常等因素有关 结节性甲状腺肿病理切片显示:甲状腺滤泡多发结节增生(图A2)。腺体内滤泡呈萎缩改变,胶质潴留,由于腺体内滤泡增生与萎缩交替发生,滤泡周围纤维化不断进展,进而影响了滤泡的血液供应,病变区出现坏死、囊变。甲状腺肿在MRI上多表现为大小不等的结节,信号欠均匀,病灶在T1WI序列为等低或略高信号,在T2WI序列为稍高信号,在T2WI压脂序列病灶较清楚,表现为不均匀高信号(图A1),部分病灶可见低信号包膜,但包膜往往不清楚或不完整。由于结节性甲状腺肿病灶的滤泡间隙小,相邻滤泡之间的阻隔减少,有利于水分子的自由扩散[3],故病灶在DWI序列为等低信号,ADC图为高信号;增强后,病灶中等度强化,病灶较平扫清楚,囊变区无强化,病灶周围由于纤维组织存在,可出现渐进延迟强化。本组有3 例患者,因为病灶强化明显,周围可见包膜,术前误诊为甲状腺腺瘤,究其原因,可能是病灶内结节增生显著,加之病灶周围纤维成分增多所致。
3.2 甲状腺滤泡性腺瘤是甲状腺最常见的良性肿瘤 镜下显示:甲状腺滤泡瘤样增生,部分可见假乳头状结构,有较完整包膜,周围腺体组织受压(图B2)。甲状腺腺瘤在T1WI序列为等或略高信号,T2WI序列表现为均匀或欠均匀高信号,囊变区呈明显高信号(图B1),由于甲状腺腺瘤内滤泡间隙较甲状腺组织有所扩大,细胞外间隙水分子无明显扩散受限,所以,DWI序列均表现为等低信号,ADC图为高信号;增强后病灶明显强化,高于正常甲状腺组织,包膜显示清楚。需要指出的是,在实际工作中甲状腺腺瘤需与腺瘤样甲状腺肿鉴别,因为两者在手术方式及病变切除范围存在一定差异。腺瘤一般单发多见,且有较完整的包膜,而腺瘤样甲状腺肿多发常见,包膜往往不完整。
3.3 桥本甲状腺炎多合并甲状腺结节 桥本甲状腺炎镜下显示:甲状腺滤泡上皮嗜酸性变,间质淋巴细胞和浆细胞浸润。其主要的病理改变为甲状腺滤泡的萎缩与纤维增生交替发生,随着滤泡周围纤维化进展,从而形成网状结构及大小不等的结节,但在桥本甲状腺炎的背景下,结节的性质较难辨别[4]。病灶呈片状或弥漫性分布,病灶信号比较均匀,T1WI及T2WI序列呈等信号,T2WI压脂序列表现为稍高信号,内可见纤细的低信号分隔,DWI及ADC图为等低信号,增强后病灶基本趋于均匀强化,其内分隔及部分结节可见延迟强化。本病需要与甲状腺肿相鉴别,甲状腺肿的信号相对不均匀,囊变坏死更多见。
3.4 甲状腺癌的类型 甲状腺癌按组织学分为5 种类型:乳头状、滤泡状、髓样、巨细胞及许特尔氏细胞,以甲状腺乳头状癌最常见,起源于甲状腺滤泡上皮,镜下显示:肿瘤细胞呈乳头状、筛状及管状浸润生长(图C2);髓样癌(本组1 例)镜下肿瘤细胞呈巢状、不规则片状及器官样排列。甲状腺癌在T1WI呈等低信号,T2WI呈稍高信号(图C1),增强后,肿瘤大多中等度强化,低于正常甲状腺组织,病灶与周围正常甲状腺信号差较平扫有所缩小,瘤体显示模糊,当肿瘤突破包膜,于甲状腺边缘可见弱强化区,形如“咬饼”[5]。另外,颈部中央区淋巴结的观察也非常重要,因为中央组淋巴结是甲状腺癌转移的前哨。由于甲状腺癌灶内部的纤维组织较良性病变增多[6],肿瘤细胞的核浆比大,细胞之间拥挤重叠,细胞外间隙变小,水分子扩散受阻,因而甲状腺癌在DWI为较明显高信号,ADC图等低信号。有学者指出[7],DWI序列在鉴别甲状腺良恶性病变的敏感度超过90%,特异性达89%。这主要是由于甲状腺良恶性结节在生长活跃性、细胞的密度、以及生物膜对水分子运动的限制不同,使两者在DWI序列的表现及ADC值方面产生了差异。但MRI对甲状腺小癌灶的发现及钙化灶的判别方面不及超声及CT[8]。
综上所述,甲状腺良恶性结节性病变在MRI各序列表现上有一定的特征,其扩散加权(DWI)成像及病灶的ADC值,为我们在判断病变性质方面提供了重要的参考信息[9]。甲状腺结节在T1WI序列表现为等、高信号,病灶囊变较明显,DWI为等低信号,ADC图为高信号,ADC平均值大于1.200×10-3mm2/s时,多考虑为良性结节性病变;甲状腺结节在T1WI呈等低信号,T2WI呈稍高信号,DWI为高信号,ADC图为低信号,ADC平均值小于0.510×10-3mm2/s时,多倾向于恶性结节性病变。

