不同温度烘烤坛紫菜的体外模拟消化研究
陈再德 骆其君 见 凯
(1宁波大学食品与药学学院,浙江 宁波 315832;2宁波大学海洋学院,浙江 宁波 315211)
坛紫菜是我国江浙及福建地区主要栽培的经济海藻之一,年产量较高[1]。坛紫菜富含大量人体所需的蛋白质、氨基酸、多糖,是一种高蛋白、高纤维、低热值、低脂肪的高营养海藻[2]。此外,坛紫菜还具有抗氧化[3-5]、抗肿瘤[6]、降血压[7]、降血脂[8]等生物活性功能,已经为人们日常所食用。
体外模拟消化反应是一种以合适的消化条件来仿生人体消化道的反应[9],其以快速、方便、低成本、可控性高等优点已广泛应用于食品安全、食品营养以及食品加工等方面[10]。Rabah 等[11]发现干酪基质在体外消化过程中可提高费氏丙酸杆菌存活率并保护免疫调节表面蛋白免受消化蛋白水解。Parimelazhagan等[12]研究发现海苔经胃蛋白酶水解消化后具有更强的抗氧化活性。姚兴存等[13]用6种不同的方法提取条斑紫菜的藻胆蛋白,通过体外模拟消化研究了藻胆蛋白在消化过程中变化规律。刘恋[14]也通过制备条斑紫菜多糖研究了体外模拟消化的整个过程。
烤紫菜是紫菜二次加工后的一种产品,具有鲜、香、酥、脆的口感,深受消费者喜爱[15]。目前关于烘烤坛紫菜在消化过程中营养物质的可消化情况、食物成分的释放以及结构的变化情况鲜有报道。为探究高温烘烤坛紫菜的消化情况,本研究对坛紫菜进行了不同温度烘烤处理,并构建体外模拟消化模型,探讨不同消化阶段坛紫菜细胞形态、营养物质含量及抗氧化活性等方面的变化规律,以期为坛紫菜的加工应用提供数据支持。
1 材料与方法
1.1 材料与试剂
坛紫菜干品,2018年12月购于宁波市鄞州藤叶海藻专业合作社;唾液淀粉酶(powder,300~1 500 U)、胃蛋白酶(powder,≥250 U solid)、胰酶(4×USP)、胆汁盐,美国Sigma 公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸[2,2′-Azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS],上海麦克林生化科技有限公司;其他试剂,国药集团化学试剂有限公司。
1.2 仪器与设备
Nikon Eclipse Ti 倒置荧光显微镜,尼康仪器(上海)有限公司;T3-L385B 黑色烤箱,美的集团股份有限公司;Varioskan Flash 酶标仪、1-16K 低温高速冷冻离心机,美国Thermo Fisher Scientific 公司;DT-100 高速粉碎机,上海机械设备有限公司;MQT-60R 摇床,上海旻泉仪器有限公司。
1.3 试验方法
1.3.1 样品预处理 以坛紫菜干品为原料,经高速粉碎机粉碎,筛选60~80 目的坛紫菜粉,分别于120、140、160、180、200℃高温下烘烤30 s,从未经烘烤的坛紫菜粉为对照组。
1.3.2 体外模拟消化 参考文献[14,16-17]的方法,略作修改。配制1.035 g·800 mL-1唾液(pH值6.8),2.12 g·800 mL-1胃液(pH值1.2),1 g·100 mL-1肠液以及4 g·100 mL-1胆盐。
口腔消化过程:准确称取0.5 g 坛紫菜样品于50 mL 离心管中,加入12.5 mL 已配制的唾液(37℃预热10 min),充分混合后于37℃、150 r·min-1恒温摇床中消化5 min,消化完成后立即70℃水浴5 min 灭酶活终止反应,4℃、10 000 r·min-1离心10 min,上清液和残渣分别于-80℃保存待测。
口胃连续消化过程:经口腔消化后的消化液用1 mol·L-1HCl 调pH值至1.2,将消化液转移至100 mL 锥形瓶中,加入15 mL 已配制好的胃液,充分混合后于37℃、150 r·min-1恒温摇床中消化4 h,之后立即70℃水浴5 min 灭酶活终止反应,4℃、10 000 r·min-1离心10 min,上清液和残渣分别于-80℃保存待测。
口胃肠连续消化过程:经口胃连续消化后的消化液用1 mol·L-1NaOH 调节pH值至7.0,将消化液转移至150 mL 锥形瓶中,加入37.5 mL 已配制的肠液和10 mL 胆盐,充分混合后于37℃、150 r·min-1恒温摇床中消化5 h,之后立即70℃水浴5 min 灭酶活终止反应,4℃、10 000 r·min-1离心10 min,上清液和残渣分别于-80℃保存待测。所有试验均设3 次平行并避光操作。
1.3.3 坛紫菜细胞形态学观察 取不同阶段消化后的消化液残渣于载玻片上,用蒸馏水稀释后盖上盖玻片,于倒置荧光显微镜上观察,并拍照。
1.3.4 营养物质含量的测定 取上清液采用邻苯二甲醛法(o-phthaldialdehyde,OPA)[13,18]测定游离氨基酸含量。可溶性蛋白含量采用考马斯亮蓝法[19]测定。可溶性糖含量采用苯酚硫酸法[20]测定。还原糖含量采用DNS[21]测定。
1.3.5 抗氧化活性的测定 DPPH·清除率的测定[22]:配制0.2 mmol·L-1DPPH 乙醇溶液,取100 μL消化液加入到100 μL的DPPH 乙醇溶液中,室温下避光反应30 min,于517 nm 波长处测定吸光度值。
ABTS+·清除率的测定[23]:取10 μL 消化液加入190 μL ABTS+溶液,摇匀,暗反应10 min后,于734 nm波长处测定吸光度值。
铁氰化钾还原能力的测定[24]:取100 μL 消化液与250 μL 0.2 mol·L-1磷酸盐缓冲溶液(phosphate buffer solution,PBS,pH值6.6)混合,然后加入250 μL 1%铁氰化钾[K3Fe(CN)6]溶液,50℃水浴20 min,然后快速冷却。再加入250μL10%三氯乙酸(CCl3COOH)混匀,4 000 r·min-1离心10 min。取250 μL 上清液、250 μL 蒸馏水与50 μL 0.1%氯化铁(FeCl3)溶液充分混匀,于700 nm 波长处测定吸光度值。
FRAP(ferric ion reducing antioxidant power)还原能力的测定[25]:取5 μL 消化液加入180 μL FRAP 工作液室温反应6 min后于593 nm 波长处测定吸光度值。
以上抗氧化酶活性均在消化液中坛紫菜粉含量为6.3 mg·mL-1条件下测定。
1.4 数据分析
采用Microsoft Excel 2010 整理数据,并使用SPSS 22.0 进行单因素ANOVA分析,Origin 2019 进行绘图。
2 结果与分析
2.1 坛紫菜细胞形态学观察
不同温度烘烤坛紫菜细胞形态有差异,温度越高对坛紫菜细胞形态破坏越大。180℃和200℃处理组坛紫菜经口胃肠连续消化后细胞形态遭到严重破坏,内容物流出,无完整细胞可见。详见表1和图1。
2.2 坛紫菜营养物质含量变化情况
2.2.1 不同温度烘烤坛紫菜的游离氨基酸含量 由表2可知,不同温度处理组坛紫菜所释放的游离氨基酸含量存在差异。在4个不同消化阶段中,坛紫菜所释放的游离氨基酸含量存在差异,随着消化的进行,游离氨基酸含量呈上升趋势。消化前,对照组坛紫菜释放的游离氨基酸含量为32.38 mg·g-1,其他温度处理组均较对照组上升,200℃处理组游离氨基酸含量较120℃、140℃、160℃和180℃处理组下降。经口腔消化后,坛紫菜释放的游离氨基酸含量较消化前上升,各温度处理组变化趋势与消化前相同,随处理温度升高游离氨基酸含量呈先上升后下降趋势。坛紫菜经口胃连续消化后,其游离氨基含量上升,对照组游离氨基酸释放量为69.89 mg·g-1,各温度处理组游离氨基酸含量较对照组均显著上升,180℃处理组达到最高(86.61 mg·g-1),为对照组的1.24倍,200℃处理组含量较180℃处理组下降,为对照组的1.06倍。坛紫菜经口胃肠连续消化后,其游离氨基酸含量较口胃连续消化后上升,对照组游离氨基酸含量为205.50 mg·g-1,各温度处理组较对照组均显著上升,180℃处理组游离氨基酸含量达到最高(289.90 mg·g-1),为对照组的1.41倍,160℃与200℃处理组无显著差异。表明,180℃处理组消化效果最佳,且坛紫菜氨基酸主要在胃肠道中释放。
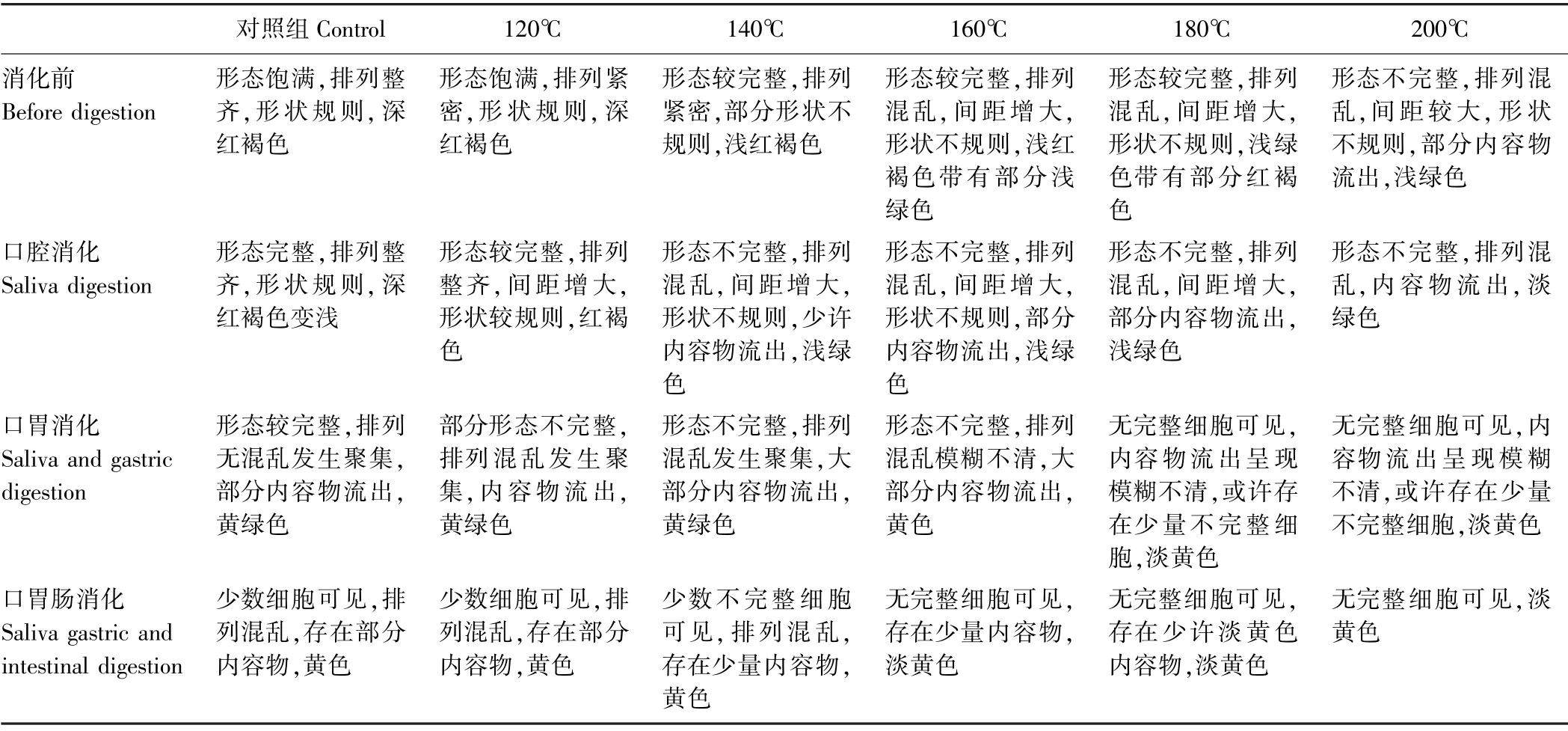
表1 不同温度烘烤坛紫菜细胞形态变化情况Table1 Changes of cell morphology of P.haitanensis at different temperatures
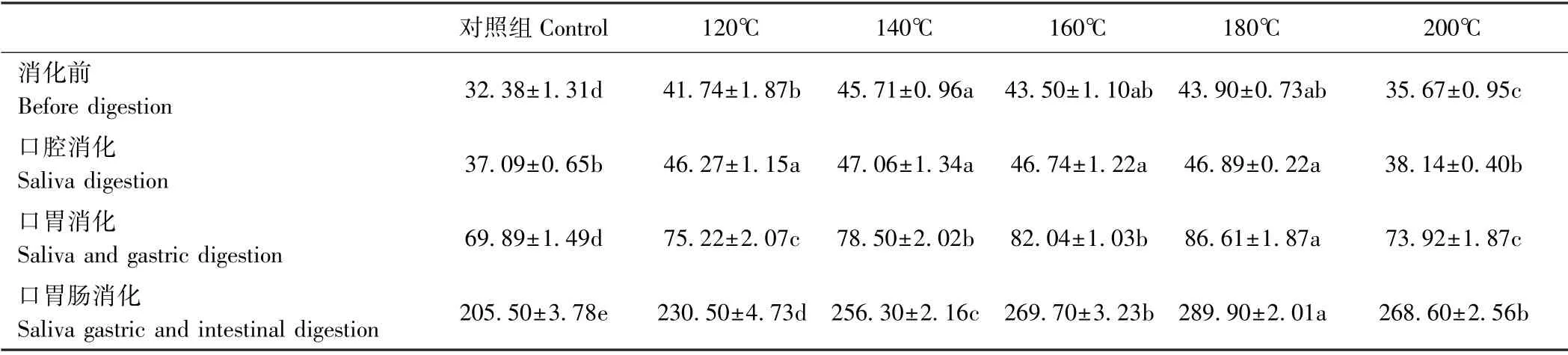
表2 不同温度烘烤坛紫菜的游离氨基酸含量Table2 Contents of free amino acids of P.haitanensis at different temperatures /(mg·g-1)
2.2.2 不同温度烘烤坛紫菜的可溶性蛋白质含量 由表3可知,坛紫菜在消化前,随着处理温度的升高,其可溶性蛋白质含量呈下降趋势,对照组可溶性蛋白含量为5.78 mg·g-1,180℃和200℃处理组为对照组的0.70和0.45倍,说明温度的升高导致部分藻胆蛋白(特别是藻红蛋白)变性。坛紫菜经口腔消化后,部分温度处理组(120~180℃之间)可溶性蛋白含量较消化前下降,介于3.49~3.77 mg·g-1之间,200℃处理组含量最低。坛紫菜经口胃连续消化后,各温度处理组可溶性蛋白含量较口腔消化后均有所上升,对照组的可溶性蛋白含量较口腔消化条件下增加了50.15%,180℃处理组可溶性蛋白含量较口腔消化条件下增加了25.79%,200℃处理组可溶性蛋白含量较口腔消化条件下增加了61.49%,说明坛紫菜经口胃连续消化后,释放出部分蛋白质。坛紫菜经口胃肠连续消化后,对照组可溶性蛋白质含量较口胃连续消化后上升,各温度处理组可溶性蛋白质含量随处理温度的升高呈现先上升后下降的趋势,对照组可溶性蛋白质含量为10.03 mg·g-1,180℃处理组可溶性蛋白含量达到最高(17.31 mg·g-1)。综上,坛紫菜蛋白质主要在胃肠道被释放出来,且180℃处理组的消化效果最好。
2.2.3 不同温度烘烤坛紫菜的可溶性糖含量 由表4可知,坛紫菜经不同温度和不同消化处理后可溶性糖含量存在一定差异。在消化前,随着处理温度升高(120~180℃之间)坛紫菜可溶性糖含量呈上升趋势,对照组可溶性糖含量为14.39 mg·g-1,180℃处理组可溶性糖含量达最大值(52.14 mg·g-1),为对照组的3.62倍,200℃和180℃处理组差异不显著(P>0.05)。坛紫菜经口腔消化后,其可溶性糖含量较消化前增幅较小,各温度处理组可溶性糖含量变化趋势与消化前大致相同,其中,200℃和180℃处理组含量差异不显著(P>0.05),但远高于其他温度处理组。坛紫菜经口胃连续消化后,各温度处理组的可溶性糖含量均较口腔消化增加明显,随着处理温度的升高,不同温度处理组可溶性糖含量呈上升趋势;对照组可溶性糖含量为252.56 mg·g-1,180℃和200℃处理组可溶性糖含量分别为对照组的1.22和1.23倍,说明胃消化环境使坛紫菜释放出大量的可溶性糖。坛紫菜经口胃肠连续消化后,其可溶性糖含量基本上与口胃连续消化后一致,增幅不明显,进一步说明胃是可溶性糖释放的主要部位。
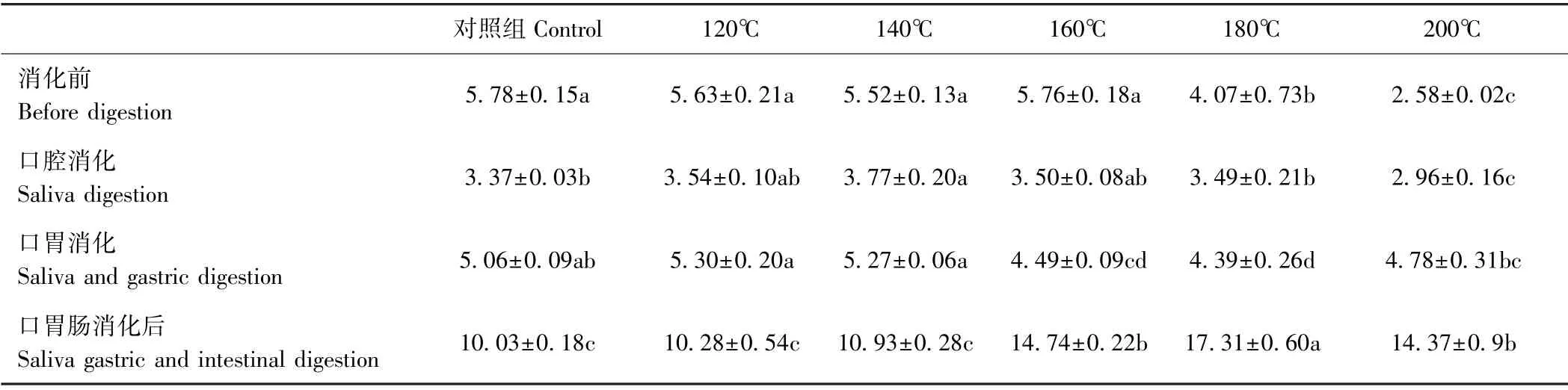
表3 不同温度烘烤坛紫菜的可溶性蛋白含量Table3 Contents of soluble protein of P.haitanensis at different temperatures /(mg·g-1)
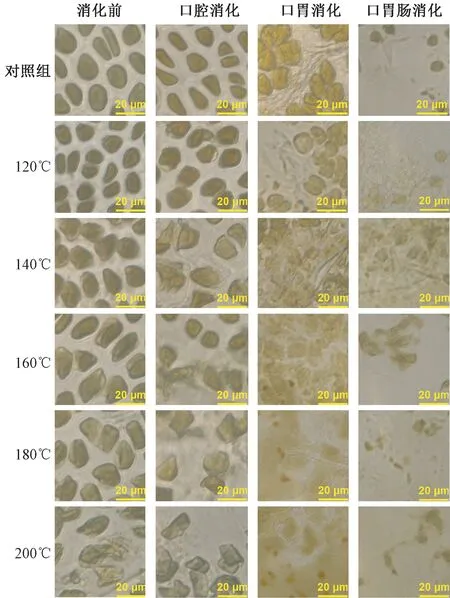
图1 不同温度烘烤坛紫菜细胞形态变化情况Fig.1 Changes of cell morphology of P.haitanensis at different temperatures
2.2.4 不同温度烘烤坛紫菜的还原糖含量 由表5可知,消化前,坛紫菜还原糖含量随着处理温度的升高呈上升趋势,对照组还原糖含量仅为1.36 mg·g-1,180℃处理组还原糖含量为对照组的1.36倍,200℃处理组还原糖含量最高(2.34 mg·g-1),为对照组的1.72倍。坛紫菜经口腔消化后,各温度处理组变化趋势与消化前基本一致,且与消化前的差异较小,说明口腔环境对坛紫菜多糖消化作用较弱。坛紫菜经口胃连续消化后,其还原糖含量明显增加,对照组还原糖含量由4.01 mg·g-1增加至47.30 mg·g-1,180℃处理组由4.88 mg·g-1增加至51.32 mg·g-1,说明部分坛紫菜多糖在胃中可被消化分解。坛紫菜经口胃肠连续消化后其还原糖含量较口胃连续消化无明显变化,且各温度处理组间的差异较小。说明高温烘烤对坛紫菜多糖消化分解影响不大,且胃才是分解多糖的主要部位。
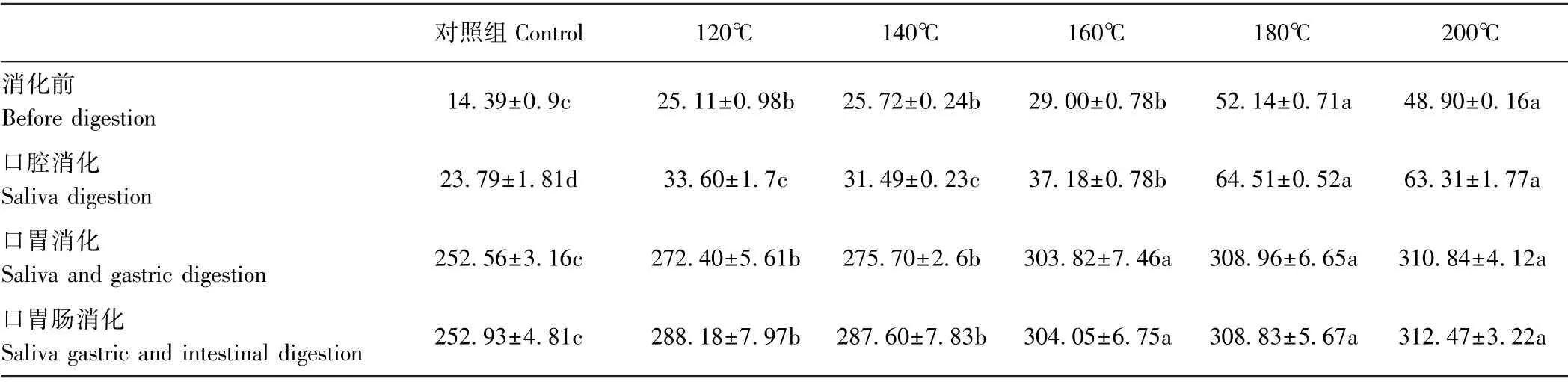
表4 不同温度烘烤坛紫菜的可溶性糖含量Table4 Contents of soluble sugar of P.haitanensis at different temperatures /(mg·g-1)
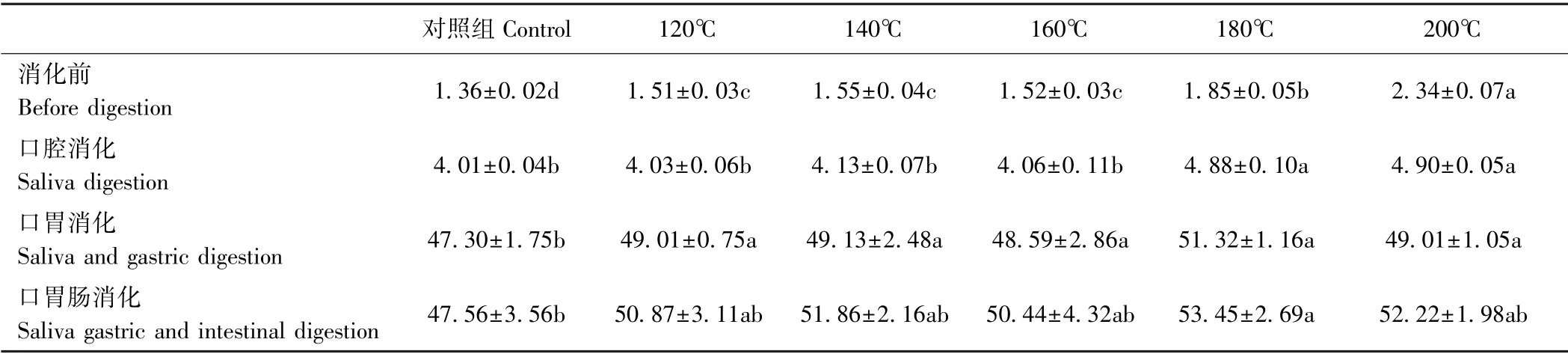
表5 不同温度烘烤坛紫菜的还原糖含量Table5 Contents of reducing sugar of P.haitanensis at different temperatures /(mg·g-1)
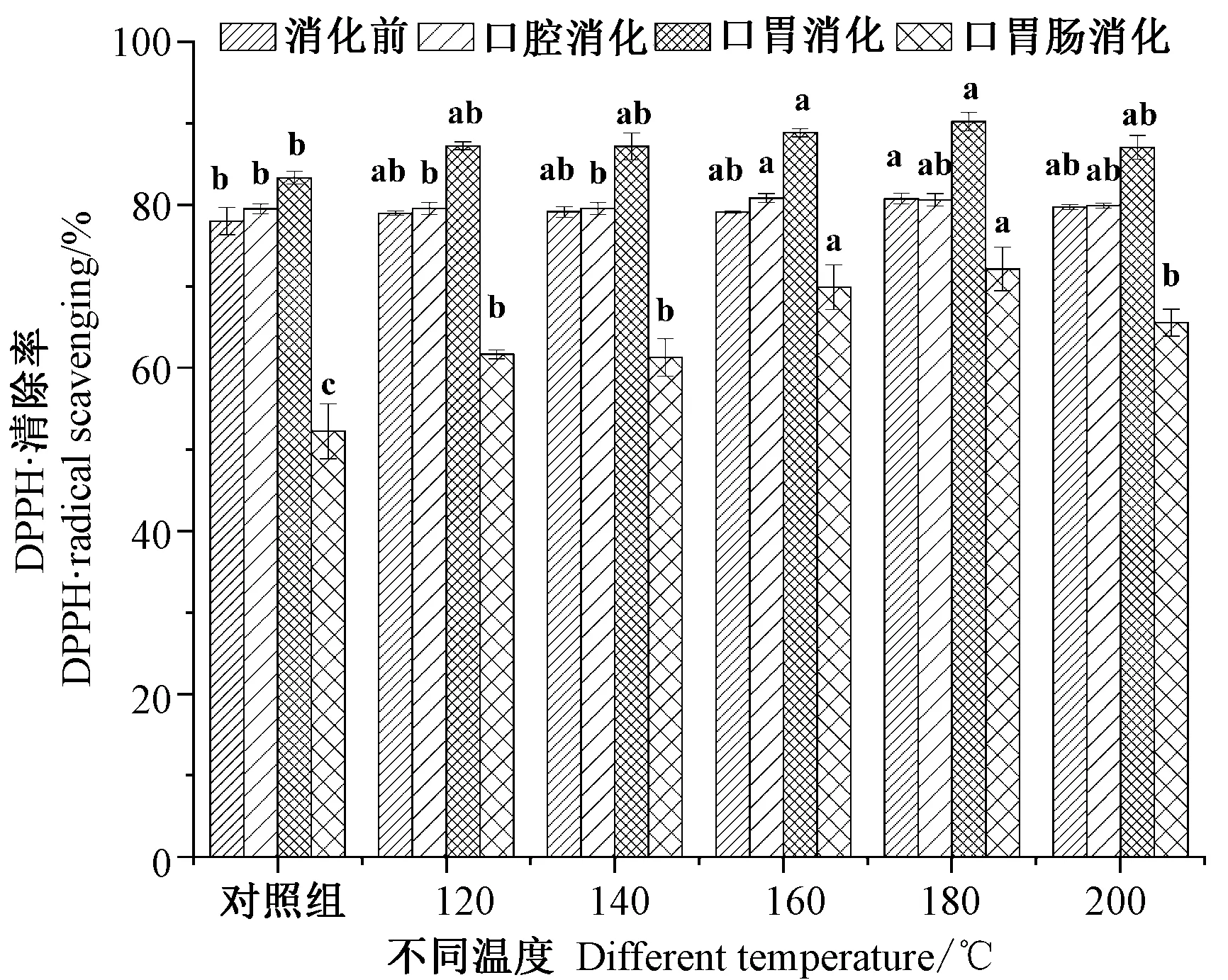
图2 不同温度烘烤坛紫菜DPPH·清除率Fig.2 DPPH· radical scavenging of P.haitanensis at different temperatures
2.3 不同温度烘烤坛紫菜抗氧化活性
2.3.1 不同温度烘烤坛紫菜的DPPH·清除率 由图2可知,坛紫菜消化前,不同温度处理组间的差异不显著(P>0.05),DPPH·清除率介于78%~80%之间。坛紫菜经口腔消化后,较消化前变化不明显,且不同温度处理组间的差异较小。坛紫菜经口胃连续消化后,DPPH·清除率较口腔消化后有所增加,对照组DPPH·清除率由79.52%增加至83.35%,160℃处理组DPPH·清除率也由80.86%增加至88.86%,且随着处理温度的升高,不同温度处理组DPPH·清除呈先增加后减少的趋势,180℃处理组DPPH·清除率最高,为90.23%,增加近10个百分点。坛紫菜经口胃肠连续消化后,DPPH·清除率较口胃连续消化后明显降低,对照组DPPH·清除率由83.35%降至52.24%,180℃处理组DPPH·消除率由90.23%降至72%,且随着处理温度的升高,不同温度处理组间变化趋势与口胃消化处理一致。表明,180℃烘烤坛紫菜的DPPH·清除率在经口胃连续消化后能达到最大效果。
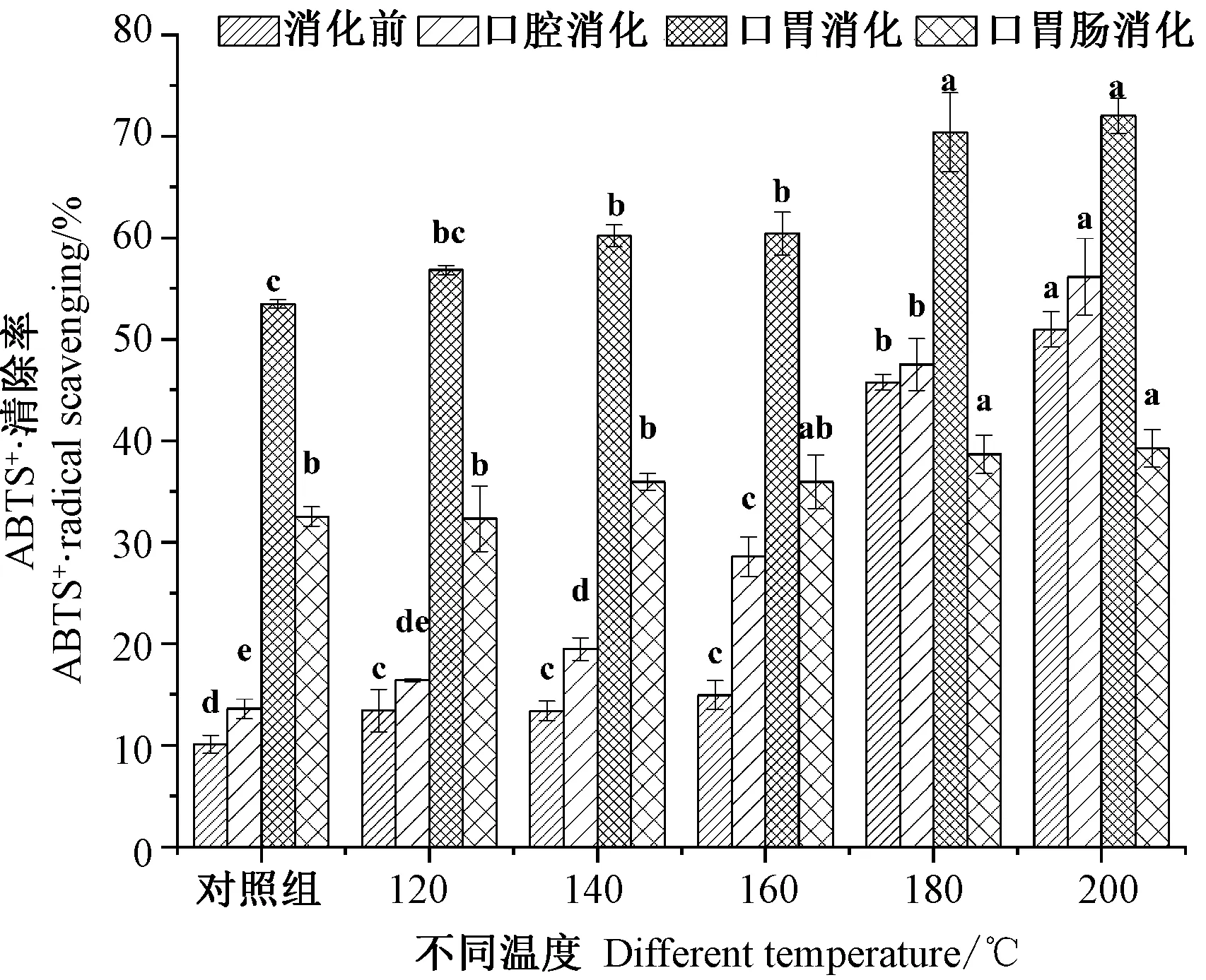
图3 不同温度烘烤坛紫菜ABTS+·清除率Fig.3 ABTS+·radical scavenging of P.haitanensis at different temperatures
2.3.2 不同温度烘烤坛紫菜的ABTS+·清除率 ABTS+·清除率是抗氧化体系中重要的指标之一。由图3可知,4个消化阶段的ABTS+·清除率呈先增后降的趋势。坛紫菜消化前,与对照组相比,随着处理温度的升高,ABTS+·清除率显著增强,180℃和200℃处理组的ABTS+·清除率分别达到45.75%和50.95%。坛紫菜经口腔消化后,ABTS·清除率较消化前增强,不同温度处理组变化趋势与消化前一致,180℃和200℃处理组ABTS+·消除率显著高于对照组。坛紫菜经口胃连续消化后,ABTS+·清除率较口腔消化后增强,且各温度处理组间差异缩小,ABTS+·清除率随处理温度升高仍呈现上升趋势,180℃和200℃处理组效果最好,ABTS+·清除率达到70.39%和72.03%。坛紫菜经口胃肠连续消化后,ABTS+·清除率较口胃连续消化后下降,各温度处理组之间的差异性减小,对照组的ABTS+·清除率降至32.53%,180℃和200℃处理组也下降至38.70%和39.24%。表明,当处理温度达到180℃时,坛紫菜ABTS+·清除率经口胃连续消化后达到最大效果。
2.3.3 不同温度烘烤坛紫菜的铁氰化钾还原能力 由图4可知,坛紫菜经消化前,不同温度处理组铁氰化钾还原能力随处理温度的升高呈上升趋势,对照组铁氰化钾还原能力吸光度为0.068,180℃处理组铁氰化钾还原能力为对照组的3.25倍,200℃处理组的铁氰化钾还原能力为对照组的3.35倍。坛紫菜经口腔消化后,铁氰化钾还原能力较消化前增幅不大,各温度处理组铁氰化钾还原能力仍随处理温度升高呈上升趋势。坛紫菜经口胃连续消化后,铁氰化钾还原能力明显增加,为未消化前的1.42~1.89倍;对照组和120℃处理组差异较小,180℃和200℃处理组铁氰化钾还原能力分别为对照组的2.28和2.27倍。坛紫菜经口胃肠连续消化后,铁氰化钾还原能力呈下降趋势,为口胃连续消化后的0.69~0.88倍;各温度处理组间差异明显,对照组、120℃处理组之间差异较小,180℃和200℃处理组铁氰化钾还原能力均为对照组的1.9倍。表明,当处理温度达到180℃时,坛紫菜铁氰化钾还原能力经口胃消化后达到最大效果。
2.3.4 不同温度烘烤坛紫菜的FRAP 还原能力 在抗氧化机制中,FRAP 还原能力是一个重要的指标。由图5可知,不同消化阶段的FRAP 还原能力呈先升后降的趋势。坛紫菜经消化前,对照组的FRAP 还原能力为0.03,160℃处理组FRAP 还原能力为对照组的2.01倍,180℃和200℃处理组FRAP 还原能力吸光度为对照组的5.4和6.0倍。坛紫菜经口腔消化后FRAP 还原能力较消化前变化不大,其中,180℃和200℃处理组FRAP 还原能力最强。坛紫菜经口胃连续消化后,FRAP 还原能力明显增强,为消化前的1.43~2.05倍,180℃和200℃处理组分别为对照组的3.71、3.72倍。坛紫菜经口胃肠连续消化后,FRAP 还原能力下降,为口胃连续消化后的0.65~0.97倍,180℃和200℃处理组效果最好,分别为对照组2.48和2.49倍。表明,当处理温度达到180℃时,坛紫菜FRAP 还原能力经口胃消化后达到最大效果。
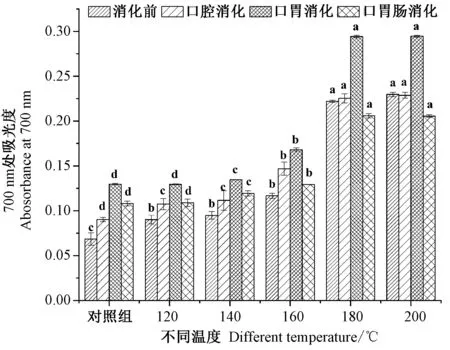
图4 不同温度烘烤坛紫菜铁氰化钾还原能力Fig.4 K3Fe(CN)6reduction capacity of P.haitanensis at different temperatures
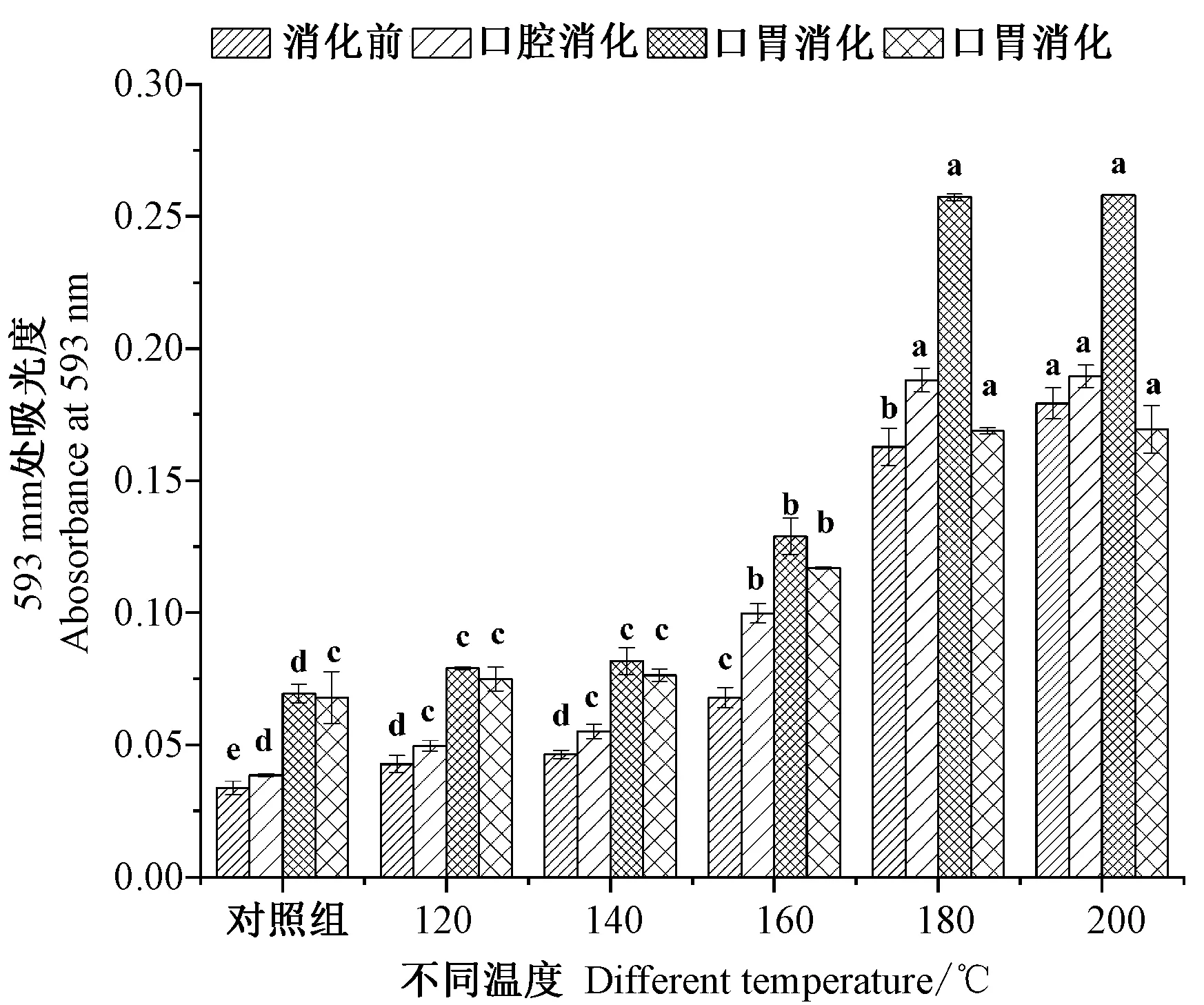
图5 不同温度烘烤坛紫菜FRAP 还原能力Fig.5 FRAP reduction capacity of P.haitanensis at different temperatures
3 讨论
本研究对不同温度烘烤的坛紫菜进行了体外模拟消化试验,结果表明180℃处理组的坛紫菜经口胃肠连续消化后,细胞被破坏,细胞内容物被分解,淡黄色物质逐渐褪去,营养物质(游离氨基酸、可溶性蛋白、可溶性多糖、还原糖)含量释放最高,表明180℃烘烤的坛紫菜最适合消化。郑芳[15]和俞静芬等[26]也认为180℃为条斑紫菜最佳的烘烤温度。这可能是由于高温会破坏紫菜细胞的半透膜、细胞壁和细胞间结构,导致细胞压力和细胞间粘黏作用丧失,同时改善了紫菜的品质和特性,提高了紫菜营养成分的可利用性和可消化性[27]。
本研究结果表明,坛紫菜在口-胃-肠消化过程中释放的营养物质含量存在差异。坛紫菜经口胃连续消化后,180℃处理组可溶性蛋白含量最低,但游离氨基酸含量最高。可能是因为蛋白质在酸性环境下暴露出酶切位点被胃蛋白酶分解,导致氨基酸含量骤升,这与姚兴存等[13]报道的结果一致,说明蛋白质在胃消化环境中被大量消化。经口胃肠连续消化后,180℃处理组游离氨基酸含量达到各处理组中的最高值,可能是胃蛋白酶和胃酸作用后的多肽被胰酶强降解成游离氨基酸,导致氨基酸含量骤升,这与陈晨等[24]报道的结果类似。
坛紫经菜口腔消化前后,可溶性糖及还原糖含量变化不明显。可能是口腔消化环境温和、唾液淀粉酶专一性以及消化时间较短的原因。这与刘恋[14]、Hu等[28]和张冠亚等[29]等报道的条斑紫菜多糖、车前子多糖、铁皮石斛多糖在体外模拟口腔消化中的结果相一致。而经口胃连续消化后,180℃和200℃处理组可溶性糖含量和还原糖含量被大量释放,这与刘恋[14]报道的条斑紫菜多糖在胃中消化的结果一致。结合刘恋[14]、Hu 等[28]、Chen 等[30]的观点推断,在胃消化环境条件下,坛紫菜细胞壁破裂,多糖含量骤增,且多糖的糖苷键发生断裂,大分子聚合物发生聚集,导致还原糖含量骤升。经口胃肠连续消化后,可溶性多糖和还原糖含量基本未变化,可能是肠道中的弱碱性环境,导致多糖和还原糖形成的絮状物消失,说明多糖在肠道环境中不易被消化。这与闵芳芳等[31]报道青钱柳多糖在肠道中消化的结果一致。
抗氧化活性物质可以通过阻碍自由基产生和干预自由基作用的方式抑制其对机体的伤害[32],从而起到延缓人体衰老,抵抗疾病,增强体质的作用。因此,氧化还原能力是极其重要的活性指标。本研究表明,坛紫菜经口胃连续消化后,180℃和200℃处理组4种氧化还原能力明显提升。可能与坛紫菜细胞在酸性环境和胃蛋白酶作用下发生破裂或皱缩后导致抗氧化物质在消化过程中被释放有关。这与Tagliazucchi[33]的研究结果类似。此外,多肽[34]、多糖[35]、多酚[36]具有清除细胞活性氧,降低自由基,修复氧化损伤,抑制氧化的作用。同时由于蛋白质被破坏,一些以共价键形式与蛋白质结合的多酚、黄酮类物质由结合态转化为游离态得到释放,从而使抗氧化活性显著增强[37-38]。且酚类物质通常也会以糖苷配体或酯的形式存在,在经过胃液较低pH 环境作用下会水解释放出大量的自由酚,进一步提高抗氧化活性。坛紫菜经口胃肠连续消化后,4种氧化还原能力有所下降。这可能是由于部分酚类物质易受到肠环境或消化酶的影响,且部分多肽物质被降解成了氨基酸,从而导致其抗氧化活性下降[12,40]。
在后续的研究中,可继续探究消化残渣进行结肠发酵的情况,以便更好的研究食物成分及活性物质与肠道微生物之间的关系。
4 结论
本研究以未处理坛紫菜为对照组,以120、140、160、180及200℃高温烘烤坛紫菜为处理组,通过体外模拟消化,研究了坛紫菜细胞形态、营养物质及抗氧化活性的变化规律。结果发现,坛紫菜细胞主要在胃肠道中裂解,可溶性糖和还原糖主要在胃中释放,蛋白质和游离氨基酸主要在胃肠道中释放,抗氧化活性在胃中表现最强。180℃和200℃处理组与对照组相比,细胞裂解程度更大,营养物质释放更好,抗氧化活性更强。综合产业效益和能耗方面的因素,认为经180℃烘烤的坛紫菜最适宜消化,可大大提高坛紫菜的生物利用率。本研究结果对烤紫菜的生产及加工具有指导性意义。

