球等鞭金藻三级培养过程中细菌群落多样性分析
孔周雁 张羽帆 凌 婷 曹嘉懿 徐继林
(1宁波大学海洋学院,浙江 宁波 315211;2浙江省海洋生物工程重点实验室,浙江 宁波 315211)
优质饵料微藻对提高水产养殖的产量和质量至关重要,也是影响该产业健康发展的关键因素之一。饵料微藻除具有营养全面、易于消化、摄食方便等特点,对水质也具有调控作用,是水产养殖中必不可少的天然优质饵料[1]。常用的饵料微藻包括小球藻(Chlorellasp.)、假微型海链藻(Thalassiosira pseudonana)、角毛藻(Chaetoceros gracilis)、扁 藻(Platymonas sp.)、球等鞭金藻(Isochrysis galbana)等。其中,球等鞭金藻是水产养殖业中最重要的饵料微藻之一,其体形小,富含多糖、胡萝卜素及高能量的脂类物质,尤其富含水产动物生长发育所需的不饱和脂肪酸二十二碳六烯酸(docosahexenoic acid,DHA)、二十碳五烯酸(eicosapentaenoic acid,EPA)等,且具有无细胞壁容易被水生动物幼体消化吸收的特点[2]。目前,球等鞭金藻已被广泛用于饲喂贻贝、扇贝等双壳类动物幼虫,被认为是双壳类贝苗、刺参幼虫及对虾幼体的优质饵料[3-5]。作为一种具有DHA、EPA 生产潜力的藻种,球等鞭金藻既是水产育苗的良好饵料,也是开发生物活性物质的重要原料,同时也被认为是最有可能实现产业化的微藻之一。因此,关于球等鞭金藻的研究越来越受到重视。
目前国内外对球等鞭金藻的培养仍处于基础研究阶段,尚未实现高效扩繁,微藻高效扩繁的关键是控制其培养过程中的环境条件。诸多学者致力于研究光照、盐度、温度等环境因素对球等鞭金藻的影响[6-11]。但即使尽量控制适合的环境条件,球等鞭金藻实际培养过程中仍然存在诸多问题。这是因为球等鞭金藻的生长除了受到这些非生物环境因素影响之外,还存在其他重要的影响因子。Bell 等[12]研究发现,藻类在生长过程中会向环境释放大量的碳水化合物、氨基酸、酶、脂类等多种代谢产物,形成独特的藻际(phycosphere)微环境,这种藻际环境会吸引大量以细菌为主的微生物,最终组成具有独特结构与功能的藻际微生物群落。越来越多研究发现海洋微藻与细菌之间存在着非常紧密的联系,主要表现为协同、共生、抑制、竞争等,且这种紧密联系具有明显的种间特异性[13-17]。近年来,藻菌关系的重要性越来越受到重视,相关研究主要集中于水质调控、赤潮或水华防治、重金属富集等生态问题[18-23],而关于饵料微藻与细菌相互关系的研究较少。
目前,关于不同培养环境下同种微藻的藻际细菌群落多样性的研究还相对较少。如,有研究分析比较了甲藻(Prorocentrum minimum)不同生长时期(滞后期、指数期和平台期)的藻际细菌群落组成,发现指数期的甲藻其藻际细菌群落多样性最丰富[24];Fiona等[25]研究了三角褐指藻(Phaeodactylum tricornutum)在四个生长时期和两种不同的培养基(最小营养培养基和完全营养培养基)中藻际细菌群落分布的差异,发现不同生长时期及两种不同的培养基中生长的三角褐指藻藻际细菌群落组成均存在显著差异;Gregory等[26]研究了两种硅藻,星杆藻和菱形藻(Asterionell opsis,Nitzchia)藻际细菌群落在培养20、200和400 d之间的动态变化,发现硅藻在实验室培养时,其藻际微生物群落在组成上是相似的,特别是在培养了一年之后,其细菌群落组成保持相对稳定。但目前尚未有利用16S rRNA基因扩增子测序方法系统分析球等鞭金藻藻际细菌群落特征的报道。因此,本研究基于16S rRNA基因扩增子测序技术,分析三级培养过程中的球等鞭金藻藻际细菌群落的多样性,以期为推进藻菌相互关系的深入研究及提高水产养殖过程中饵料微藻的产量和质量提供参考。
1 材料与方法
1.1 藻种来源和培养条件
球等鞭金藻3011 来自宁波大学海洋生物实验室合作单位——福建宝智水产科技有限公司生产基地。按NMB3#配方[27]配置基础培养基,高温灭菌后用于一级培养。用于二级培养的海水用漂白精进行简单灭菌,用于三级培养的海水未进行任何灭菌处理。
1.2 DNA 提取、扩增子测序及分析
收集三级培养过程中的球等鞭金藻3011 藻液,各组分别收集3个样品重复,样品采集完成后迅速带回实验室。藻液样品经0.2 μm 无菌聚碳酸酯膜(Millipore,Boston,MA,SA)抽滤,获得藻际游离和粘附的总细菌。滤膜上的总DNA 利用Power soil® DNA试剂盒(MO BIO Laboratories,美国)按试剂说明书要求进行提取,具体操作参照Xiong 等[28]的方法。将获得的基因组DNA 送至北京诺禾致源科技股份有限公司进行细菌16S rRNA 测序,测序区间为16S rRNA基因的V3-V4 高可变区,扩增上下游引物分别为341F(5′-CCTAYGGGRBGCASCAG-3′)和806R(5′-GGACTA CNNGGGTATCTAAT-3′)。使用TruSeq DNA PCR-Free Sample Preparation Kit 建库试剂盒(诺禾致源,北京)进行文库构建,使用Qubit@ 2.0 Fluorometer(Thermo Scientific)和Agilent Bioanalyzer 2100 system对文库进行质量评估,最后在Illumina HiSeq 2500 平台上进行双末端测序。
从测序公司获得原始数据,使用QIIME(version 1.9.0) 程序对测序结果进行序列过滤[29],利用usearch算法剔除嵌合体。将得到的高质量有效序列采用UCLUST方法聚类成分类操作单元(operational taxonomic units,OTUs),聚类相似度要求为97%[30]。随后利用RDP Classifier方法将每个OTU 里丰度最高的序列与SILVA 数据库进行物种注释分析[31];删除古菌(archaea)、叶 绿 体(chloroplast)和未 知 序 列(unclassified)。为了消除测序深度不同引起的多样性评估偏差,将每个样品的序列数随机选取均一化到9 911 条(所有样品中最低测序深度)序列进行后续分析。根据聚类分析结果,进行Alpha 多样性分析,分析包括以下4种Alpha 多样性指数:Chao 指数(Chao1)、ACE(ACE 指数)、香浓指数(Shannon)和辛普森多样性指数(Simpson)。采用基于weighted UniFrac 距离的主坐标分析(principal coordinates analysis,PCoA)和多因素方差分析(Adonis)比较组间群落结构上的差异及显著性检验。
1.3 三级培养过程中可培养细菌的分离
三级培养过程中的球等鞭金藻藻液,按照10倍梯度稀释成10-1~10-5,将100 μL 各稀释度样品均匀涂布于2216E 固体培养基上。28℃恒温培养箱内倒置培养数日,每天观察平板上的菌落颜色、形态和大小,挑取代表性单菌落,在新的2216E 固体培养基上进行数次四区划线分离,直至得到纯的单克隆菌株。将确认纯化的菌株接种于2216E 液体培养基并加入20%甘油,然后置于-80℃冰箱保存备用。
1.4 三级培养过程中可培养细菌的鉴定
对分离所得的菌株进行菌体形态观察、染色反应、培养性状和生理生化测定。采用细菌基因组DNA 抽提试剂盒分别提取所有供试菌株的总DNA。以各细菌提取的DNA为模板,以通用引物27F(5′-AGAGTTT GATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTT ACGACTT-3′)进行PCR 扩增,扩增反应体系及条件参考朱亚珠等[32]的方法。用1.0%琼脂糖凝胶电泳检测PCR 扩增产物,使用凝胶回收试剂盒纯化,并连接至pMD19-T 载体后送至杭州有康生物技术有限公司测序。
将测序获得的16S rRNA基因全长序列在NCBI网页(http:/ /www.ncbi.nlm.nib.gov/)进行BLAST 序列分析及同源性比较,找到同源性最高的序列信息用于构建系统树来确定分离菌株的分类地位。本研究利用MEGA 5.0软件的邻接法(neighbor-joining method,NJ)构建进化树,自举值(Boot-strap)设为1 000。
2 结果与分析
2.1 基于16S rRNA基因V3-V4 区域高通量测序的数据统计
本研究通过16S rRNA 扩增子测序鉴定了三级培养过程中球等鞭金藻藻际细菌群落多样性。采用Illumina HiSeq 测序平台得到原始下机数据(Raw PE),进行拼接和质控,得到Clean Tags,再进行嵌合体过滤,得到可用于后续分析的有效数据(effective tags)。数据处理过程中各步骤得到的序列统计结果见表1。9个样品中共产生65 999~80 745 条有效数据,其中一级、二级和三级培养中有效数据的均值分别为77 476、74 286和70 988。所有样品的有效数据平均长度均为407 或408 nt,且Q20和Q30 都在97%以上,有效数据占原始下机数据的百分比均高于80%。以上结果表明,测序结果质量符合要求,满足后续分析要求。
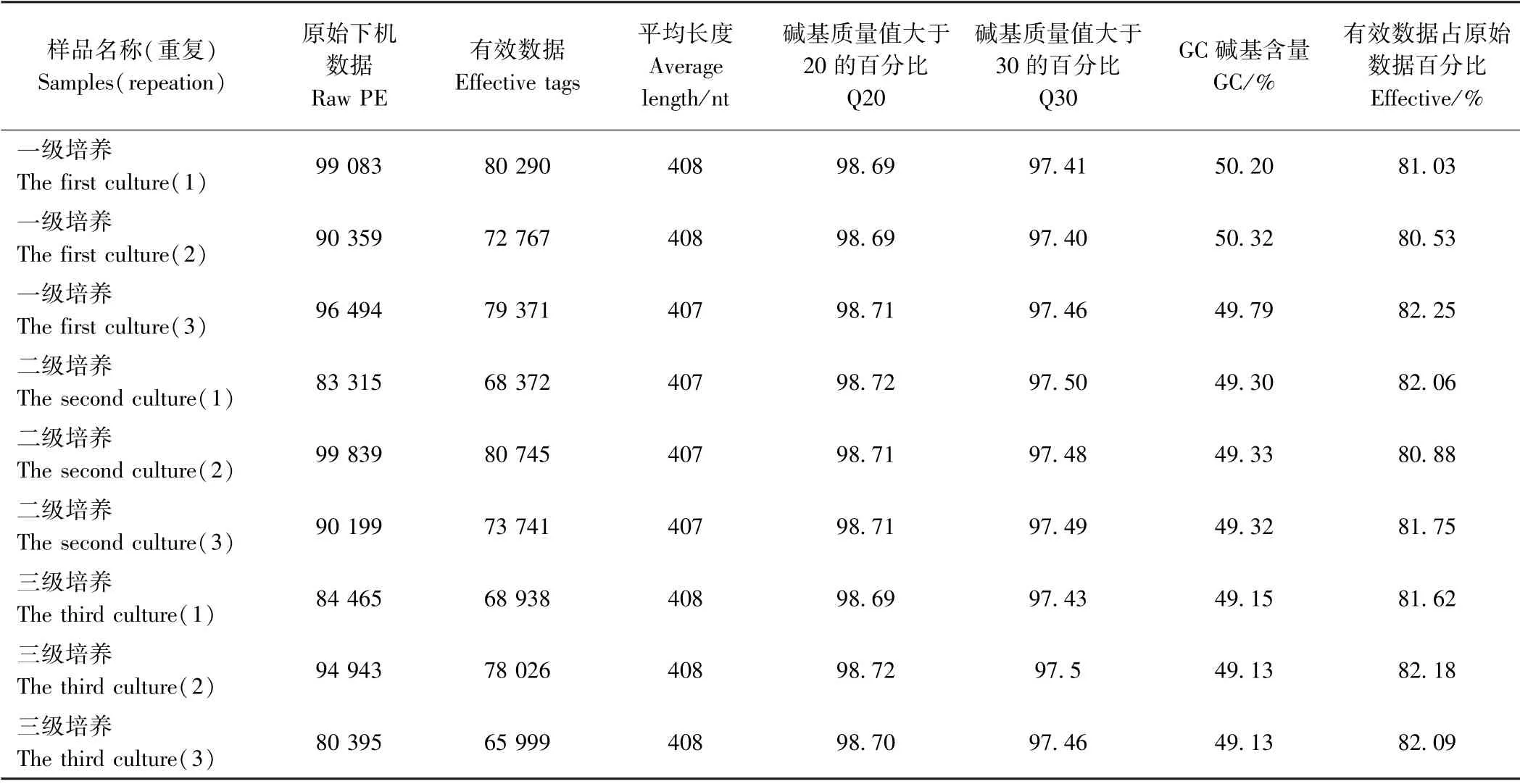
表1 高通量测序数据统计Table1 Overview of the high-throughput sequencing result
2.2 球等鞭金藻三级培养过程中藻际细菌群落组成差异分析
利用RDP classifier对注释的序列进行门、纲、目、科、属、种6种分类水平上的分析,结果表明,三级培养过程中球等鞭金藻藻际细菌在门类水平上具有较高的相似性(图1-A)。变形菌门(Proteobacteria)细菌是各级培养中最丰富的细菌群落,它在一级、二级和三级培养组中的相对丰度分别为83.02%、79.38%和74.60%。拟杆菌门(Bacteroidetes)细菌在这三组样品中的相对丰度仅次于变形菌门,它在一级、二级和三级培养组中的相对丰度分别为11.50%、12.00%和19.11%。球等鞭金藻其他优势藻际细菌门类还包括酸杆菌门(Acidobacteria)、厚壁菌门(Firmicutes)、消化螺旋菌门(Nitrospirae)、绿 弯 菌 门(Chloroflexi)、疣 微 菌 门(Verrucomicrobia)等。在属水平上,3个培养组的藻际细菌群落组成差异明显(图1-B)。除未知属(Others)外,一级培养组中相对丰度最大的3个属分别为深海杆菌属(Thalassobaculum)、圆杆菌属(Cyclobacterium)和小海员菌属(Nautella);二级培养组中相对丰度最大的3个属分别为小海员菌属(Nautella)、海命菌属(Marivita)和科迪亚菌属(Kordia);而三级组中相对丰度最大的3个属分别为科迪亚菌属(Kordia)、居水菌(Glaciecola)和硫微螺菌属(Thiomicrospira)。
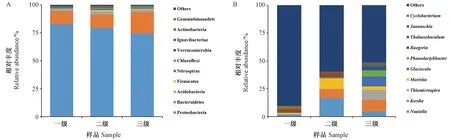
图1 球等鞭金藻三级培养过程中在门(A)和属(B)水平上细菌菌落的组成Fig.1 The composition of the bacterial community at the phylum (A) and genus (B)levels in tertiary culture process of Isochrysis galbana
2.3 球等鞭金藻三级培养过程中藻际细菌群落结构比较
为探究三级培养过程中球等鞭金藻藻际细菌群落丰富度和多样性,使用QIIME 程序计算获得9个样品的Chao 指数(Chao 1)、ACE 指数(ACE)、香农指数(Shannon)和辛普森多样性指数(Simpson)。由表2可知,三组样品间Chao 1和ACE 两个指数不存在显著差异,说明一级、二级和三级培养条件中细菌群落的丰富度相近。此外,二级和三级培养条件中Shannon和Simpson 指数也不存在显著性差异,而一级培养的Shannon和Simpson 指数显著低于二级和三级培养,说明一级培养组中细菌群落多样性显著低于二级和三级培养组。
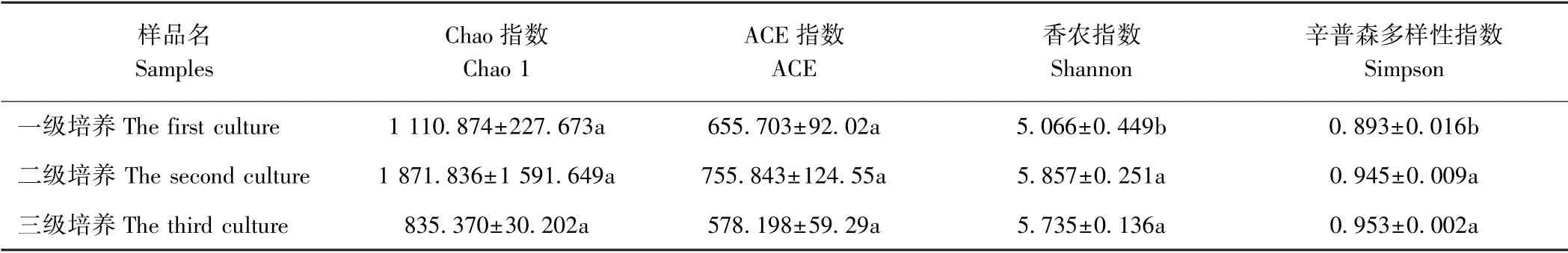
表2 球等鞭金藻藻际细菌群落多样性指数Table2 Diversity indices of bacterial community associated with Isochrysis galbana
主坐标分析发现,各级样品彼此明显分离,而同组的3个重复聚在一起,说明球等鞭金藻藻际细菌群结构按不同培养级聚类,其中第一轴和第二轴共同解释了91.02%的群落差异(图2)。多因素方差分析结果显示,一级培养和三级培养组之间的细菌群落结构达到了显著差异水平(R2=0.946,P值=0.001)(表3)。
2.4 球等鞭金藻三级培养过程中藻际细菌群落组间差异物种分析
为研究组间显著差异的物种,利用MetaStat方法对组间的物种丰度数据进行假设检验得到P值,通过对P值的校正,得到q值,最后根据q值筛选具有显著性差异的物种,并绘制差异物种(具有显著性差异的未知种除外)在组间的丰度分布热图(图3)。结果表明,隶属于变形菌门的麦氏交替单胞菌(Alteromonas macleodii)在三级培养组中的相对丰度明显高于其他两组,而隶属于放线菌门的红球菌(Rhodococcus erythropolis)在一级培养组中的相对丰度明显高于其他两组。一级培养组的球等鞭金藻生长显著好于三级培养组,由此推测麦氏交替单胞菌和红球菌可能分别是对球等鞭金藻有害和有益的菌种,但需要后续试验进一步验证。
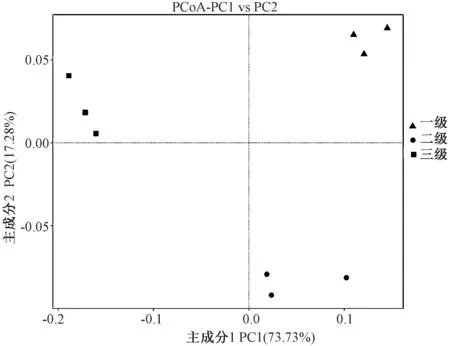
图2 主坐标分析(PCoA)球等鞭金藻藻际细菌在三级培养中的群落结构Fig.2 Principal coordinates analysis (PCoA) of bacterialcommunity associated with Isochrysis galbanaunder three different culture stages
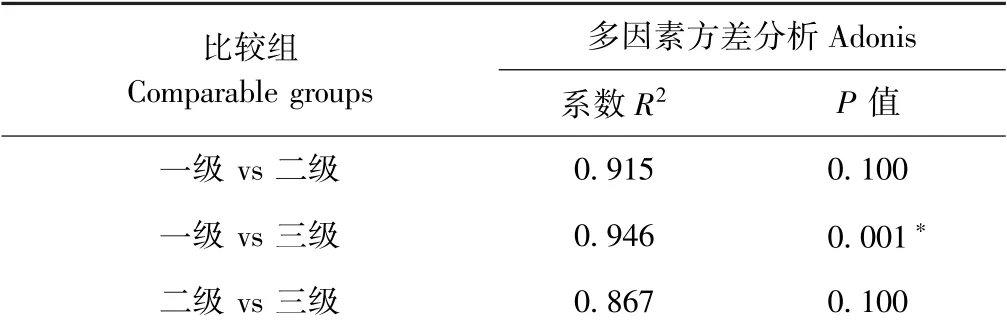
表3 多因素方差分析三组间细菌群落结构显著性检验Table3 Significance test of bacterial community structure among three groups by Adonis
2.5 球等鞭金藻三级培养过程中可培养细菌的分离与鉴定
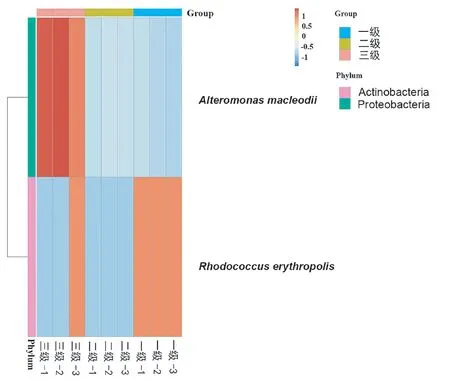
图3 球等鞭金藻三级培养下细菌的种水平上差异物种相对丰度热图Fig.3 Heat map showed the relative abundance of the significantly changed bacteria associated with Isochrysis galbana at the species taxonomic level
采用2216E 平板分离的方法对三级培养过程中球等鞭金藻藻际环境细菌进行分离,初步分离鉴定到17株外观明显差异的细菌(表4),分别编号为Ig-1、Ig-2、Ig-3、Ig-4、Ig-5、Ig-6、Ig-7、Ig-8、Ig-9、Ig-10、Ig-11、Ig-12、Ig-13、Ig-14、Ig-15、Ig-16、Ig-17。对上述17株细菌进行DNA 提取及16S rRNA基因的扩增和测序,将所测得的16S rRNA基因全序列输入NCBI网页,用BLAST方法进行序列分析及同源性比较,结果如表4所示。将17株细菌及NCBI 数据库上与它们相似性最高的细菌的相应分子序列信息用于构建系统进化树,结果显示(图4),整个系统发育树分成13个分支,分别对应13个属,包括交替单胞属(Alteromonas)、假交替单胞属(Pseudoalteromonas)、海杆菌属(Marinobacter)等。其中,Ig-2、Ig-3和Ig-4 同属于交替单胞属的分支,Ig-2和Ig-3与麦氏交替单胞菌(Alteromona macleodii)亲缘关系最近,而Ig-4与交替单胞菌(Alteromonasp.)亲缘关系最近。以此类推,与分离得到的细菌亲缘关系最近的已知细菌分别对应如下:Ig-1与Bacillus jeotgali、Ig-5与Ruegeriasp.、Ig-6与Ruegeria pelagia、Ig-7与Marinobacter salsuginis、Ig-8与Nautellasp.、Ig-9与Loktanellasp.、Ig-10与Pseudoalteromonassp.、Ig-11与Staphylococcus caprae、Ig - 12与Hoeflea alexandrii、Ig - 13与Psychroserpenssp.、Ig-14与Marinobactersp.、Ig-15与Marinobacter alkaliphilus、Ig-16与Leisingerasp.、Ig-17与Algoriphagus marincola。
3 讨论
前期试验发现球等鞭金藻在三级培养过程中生长差异明显,在完全灭菌的一级培养中生长最佳,在未灭菌的三级培养中生长最差,在不完全灭菌的二级培养中生长介于两者之间。为了探究球等鞭金藻生长差异与藻际细菌的关系,本研究通过16S rRNA基因扩增子测序分析了各级培养藻液中细菌群落多样性,结果显示,变形菌门细菌在各级培养中均是最丰富的细菌群落。已有不少研究发现变形菌门细菌是藻际环境中最重要的细菌类群之一,其中包含不少对微藻生长有益的细菌[13]。如,隶属于变形菌门Roseobacter-clade的海洋细菌(Phaeobacter inhibens) 在赫氏颗石藻(Emiliania huxleyi)生长初期为藻提供生长激素,而赫氏颗石藻为细菌提供营养物质,两者互利共生[33]。此外,同样隶属于变形菌门的一株亚硫酸杆菌(Sulfitobactersp.)可以通过分泌吲哚乙酸(indoleacetic acid,IAA) 促进多列拟菱形藻(Pseudo-nitzschia multiseries)的生长[34]。本研究结果进一步证明变形菌门细菌是微藻藻际细菌群落中非常重要的组成部分。

表4 三级培养球等鞭金藻藻液中分离到的细菌信息Table4 The information of bacteria isolated from Isochrysis galbana culture in tertiary culture process
本研究结果表明,三级培养过程中球等鞭金藻藻际细菌在门类水平上具有较高的相似性,但在属水平上差异较明显。如,隶属于Kordia、Thiomicrospira等属的细菌在三级培养组中的相对丰度最高;而Cyclobacterium属的细菌在一级培养组中的相对丰度最高。这些在各级培养组之间相对丰度差异明显的细菌可能与球等鞭金藻生长差异相关。主坐标分析和多因素方差分析结果表明,三级培养环境下的球等鞭金藻藻际细菌组成之间存在明显差异。关于不同培养环境中的微藻藻际细菌群落分布,之前有类似研究,如室外培养和实验室培养下的扁藻藻际细菌群落分布存在较大的差异[35]。
本研究利用MetaStat方法对三组间差异物种进行分析,种水平上发现2株相对丰度显著差异的细菌(未知种除外),其中麦氏交替单胞菌在球等鞭金藻三级培养条件下相对丰度明显高于一级培养,而红球菌在一级培养条件下相对丰度明显高于三级培养。结合球等鞭金藻在各级培养中的生长情况,藻相对丰度高的一级培养中,红球菌的相对丰度高;而藻相对丰度低的三级培养中,麦氏交替单胞菌的相对丰度低。推测,麦氏交替单胞菌和红球菌可能分别是对球等鞭金藻生长有害和有益的细菌。为验证猜想,首先对三级培养条件下可培养细菌进行了分离鉴定。本研究共分离鉴定了17株不同的藻际细菌,其中包括麦氏交替单胞菌,但红球菌未分出。鉴于以上结果,本研究从两方面进行分析:一方面,由于2216E 固体培养基分离法比较单一,后续将会通过不同营养配比的改良2216E 培养基、其他培养基及优化培养条件等方法进行大批量的分离工作,以分离得到包括红球菌在内的其他藻际可培养细菌;另一方面,验证这一猜想需要进行藻菌共培养试验,而进行藻菌共培养试验需要获得无菌球等鞭金藻藻株。由于球等鞭金藻无菌纯化工作存在一定难度,尚未获得无菌藻株,相关工作还在推进中,因此未能验证麦氏交替单胞菌和红球菌对球等鞭金藻生长的影响作用。以上两方面工作及藻菌互作机制的深入研究将在后续工作中推进。
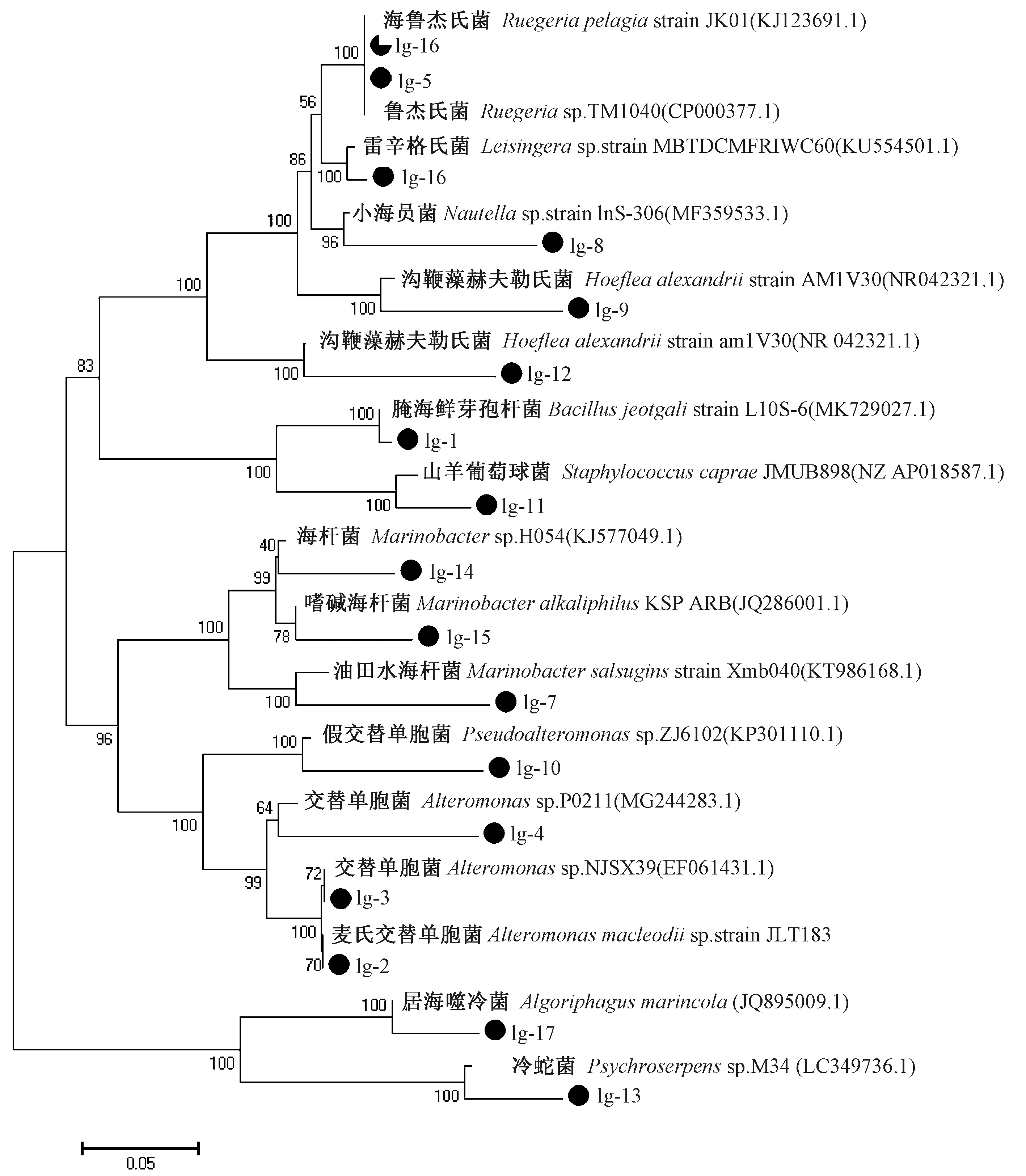
图4 基于16S rRNA 序列构建的球等鞭金藻藻际细菌系统发育树Fig.4 Phylogenetic tree of the bacteria associated with Isochrysis galbana based on 16S rRNA sequence
球等鞭金藻是水产养殖产业中最重要的饵料,但国内外对球等鞭金藻的培养仍处于基础研究阶段,尚未实现高效扩繁。藻际细菌作为影响微藻生长的重要因子,关于其影响微藻生长的研究越来越多[13-17]。然而,极少有关于藻际细菌如何影响球等鞭金藻生长等方面的报道,且只是个别菌株对其具有促进或抑制现象的研究[36],缺乏藻际细菌的系统研究,且未涉及互作机制的解释。本研究利用16S rRNA基因扩增子测序方法系统分析球等鞭金藻藻际细菌群落特征,并分离鉴定了17株球等鞭金藻藻际细菌,发现红球菌可能是对球等鞭金藻生长有益的细菌。这些结果为筛选促进球等鞭金藻生长的有益菌并探究其促进金藻生长的机制奠定了基础,将为球等鞭金藻及其他饵料微藻的进一步开发利用、贝类养殖行业的健康发展等提供科学指导。
4 结论
本研究基于16S rRNA基因扩增子测序,分析了三级培养过程中球等鞭金藻藻际细菌多样性。结果表明,三级培养过程中细菌群落存在显著差异,进一步分析发现一级和三级培养之间存在2株相对丰度显著差异的细菌,即麦氏交替单胞菌和红球菌,它们可能分别是对球等鞭金藻生长有害和有益的细菌。通过2216E平板涂布法分离并鉴定了麦氏交替单胞菌等17株球等鞭金藻藻际环境细菌。本研究结果为进一步探索藻菌关系奠定了基础,将有助于提高水产养殖过程中球等鞭金藻的产量和质量。

