幽门螺杆菌感染与非酒精性脂肪肝对2型糖尿病患者糖脂代谢的影响
田利华,薛亚男,涂 强
1.秦皇岛军工医院综合内科,河北秦皇岛 066000;2.河北港口集团有限公司港口医院内分泌科,河北秦皇岛 066000
幽门螺杆菌(Hp)感染可引起胃炎、消化性溃疡,消除Hp感染可作为胃癌一级预防措施[1]。有研究表明,Hp感染患者早期可能有胰岛素分泌受损,这可能会增加2型糖尿病(T2DM)的风险,且Hp感染可导致胰岛素抵抗发生[2]。非酒精性脂肪性肝(NAFLD)是一种复杂的疾病,受遗传和环境因素的影响。有研究表明,NAFLD患者糖脂代谢指标、空腹胰岛素及胰岛素抵抗指数较单纯肥胖者水平升高[3]。目前文献尚少见同时存在Hp感染并患有NAFLD和T2DM关系的报道。本文通过对同时存在NAFLD与Hp感染的T2DM人群糖脂代谢指标进行观察,旨在探讨T2DM人群中Hp感染、NAFLD和T2DM的关系,现报道如下。
1 资料与方法
1.1一般资料 选取2016年5月至2018年1月在河北港口集团有限公司港口医院内分泌科住院的179例T2DM患者作为研究对象,根据是否合并NAFLD及是否有Hp感染分为4组,Ⅰ组:T2DM合并NAFLD及Hp感染,65例;Ⅱ组:T2DM合并NAFLD,41例;Ⅲ组:T2DM合并Hp感染,43例;Ⅳ组:T2DM未合并NAFLD及无Hp感染,30例。本研究得到河北港口集团有限公司港口医院伦理委员会批准,所有研究对象均知情同意并签署知情同意书。
1.2纳入和排除标准
1.2.1纳入标准 (1)根据1999年WHO糖尿病诊断标准确诊为T2DM,且患者使用降糖药物治疗(胰岛素和/或口服降糖药物);(2)未使用任何特殊口服药物导致脂肪肝,无急性心脑血管等疾病,无尿路感染及近期无使用肾毒性药物史;(3)无长期使用抗菌药物、铋剂和质子泵抑制剂(PPI)等药物史;(4)无饮酒史或饮酒折合乙醇量<140 克/周(男),<70 克/周(女)。
1.2.2排除标准 (1)有病毒性肝炎、药物性肝病、全胃肠外营养、肝豆状核变性、甲状腺功能减退、自身免疫性肝病等可导致脂肪肝的特定疾病者;(2)有恶性肿瘤病史者;(3)有糖尿病酮症酸中毒、高糖高渗状态、急性感染等急性病变者。
1.3方法
1.3.1资料收集及实验室检查 对所有研究对象入院当日采集病史,测量血压[收缩压(SBP)、舒张压(DBP)]、身高、体质量和腰围;在最后一次进食12 h后,次日清晨空腹采集血液和尿液标本,测定空腹血糖(FPG)、糖化血红蛋白(HbA1c)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、三酰甘油(TG)、肌酐(Cr)、天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、尿酸(UA)、空腹胰岛素(Fins)(未使用胰岛素者)、空腹C肽,测量尿清蛋白肌酐比(ACR)。
1.3.2非酒精性脂肪性肝病诊断[4](1)肝脏影像学表现符合弥漫性脂肪肝的诊断标准且无其他原因可供解释。(2)影像学诊断:具备以下3项腹部超声表现中的2项者可诊断为弥漫性脂肪肝,①肝脏近场回声弥漫性增强“明亮肝”,回声强于肾脏;②肝内管道结构显示不清;③肝脏远场回声逐渐衰减。
1.3.3Hp检测 禁食12 h后采用北京海德润医药集团有限公司生产的13C-尿素呼气试验药盒和北京赛尔福知心科技有限公司SHB-300013C呼气分析仪检测Hp,诊断标准为超级准值≥4为阳性,视为Hp感染,<4为阴性。进行13C-尿素呼气试验检测Hp前必须停用PPI至少2周,停用抗菌药物、铋剂和某些具有抗菌作用的中药至少4周。
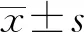
2 结 果
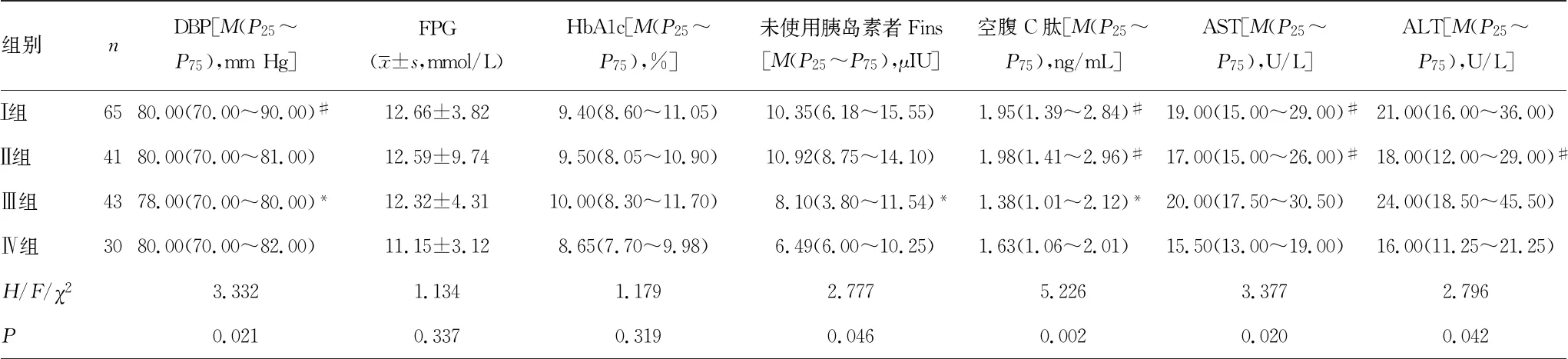
2.14组患者一般资料及实验室指标比较 见表1。与Ⅳ组比较,Ⅰ组体质量指数(BMI)、腰围(男性与女性)、DBP、空腹C肽、AST、TC、TG、LDL-C水平均升高,糖尿病病程较短,Ⅱ组BMI、腰围(女性)、ALT、AST、TG、空腹C肽水平均升高,糖尿病病程较短,HDL-C(女性)水平降低,Ⅲ组糖尿病病程较短,差异均有统计学意义(P<0.05)。与Ⅰ组比较,Ⅲ组患者BMI、腰围(男性)、DBP、TG、Fins、空腹C肽、UA水平均降低,HDL-C(女性)水平升高,差异均有统计学意义(P<0.05);而其他指标4组间比较,差异均无统计学意义(P>0.05)。
2.2NAFLD及Hp感染的影响因素 分别以NAFLD、Hp感染作为因变量,以年龄、糖尿病病程、空腹C肽、BMI、腰围、SBP、DBP、ALT、AST、Cr、UA、TG、TC、LDL-C、HDL-C、HbA1c、FPG作为自变量进行二元Logistic向前逐步回归分析发现,BMI、TC、TG、LDL-C是T2DM患者合并NAFLD的独立危险因素(OR=1.267、0.342、2.501、5.862,P<0.05),见表2;TC是T2DM患者合并Hp感染的独立危险因素,回归系数(β)=0.383,Wald=6.645,OR=1.467,P=0.039,95%CI=1.962)。
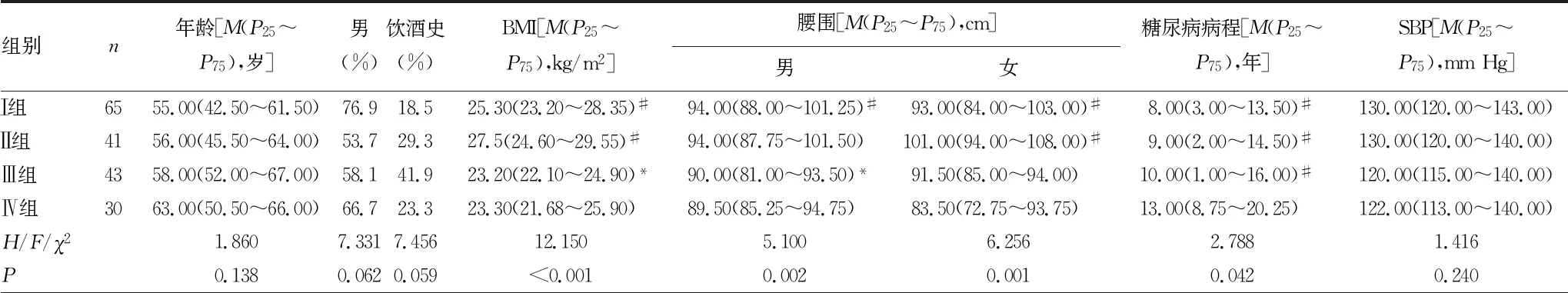
表1 4组患者一般资料及实验室指标比较
组别nDBP[M(P25~P75),mmHg]FPG(x±s,mmol/L)HbA1c[M(P25~P75),%]未使用胰岛素者Fins[M(P25~P75),μIU]空腹C肽[M(P25~P75),ng/mL]AST[M(P25~P75),U/L]ALT[M(P25~P75),U/L]Ⅰ组6580.00(70.00~90.00)#12.66±3.829.40(8.60~11.05)10.35(6.18~15.55)1.95(1.39~2.84)#19.00(15.00~29.00)#21.00(16.00~36.00)Ⅱ组4180.00(70.00~81.00)12.59±9.749.50(8.05~10.90)10.92(8.75~14.10)1.98(1.41~2.96)#17.00(15.00~26.00)#18.00(12.00~29.00)#Ⅲ组4378.00(70.00~80.00)*12.32±4.3110.00(8.30~11.70)8.10(3.80~11.54)*1.38(1.01~2.12)*20.00(17.50~30.50)24.00(18.50~45.50)Ⅳ组3080.00(70.00~82.00)11.15±3.128.65(7.70~9.98)6.49(6.00~10.25)1.63(1.06~2.01)15.50(13.00~19.00)16.00(11.25~21.25)H/F/χ23.3321.1341.1792.7775.2263.3772.796P0.0210.3370.3190.0460.0020.0200.042

组别nTC(x±s,mmol/L)TG[M(P25~P75),mmol/L]LDL-C(x±s,mmol/L)HDL-C[M(P25~P75),mmol/L]男女Ⅰ组654.65±1.12#2.19(1.63~3.76)#2.70±0.93#0.89(0.77~1.03)0.89(0.80~1.03)Ⅱ组414.27±1.151.74(1.15~2.99)#2.41±0.960.84(0.79~1.01)0.86(0.68~1.08)#Ⅲ组434.32±1.011.46(1.02~2.04)*2.50±0.800.98(0.85~1.16)1.13(0.84~1.40)*Ⅳ组303.84±0.871.15(0.92~1.73)2.13±0.611.04(0.83~1.16)0.99(0.85~1.429)H/F/χ24.1847.4543.0800.7293.656P0.007<0.0010.0290.5370.017

续表1 4组患者一般资料及实验室指标比较
注:与Ⅳ组比较,#P<0.05;与Ⅰ组比较,*P<0.05。
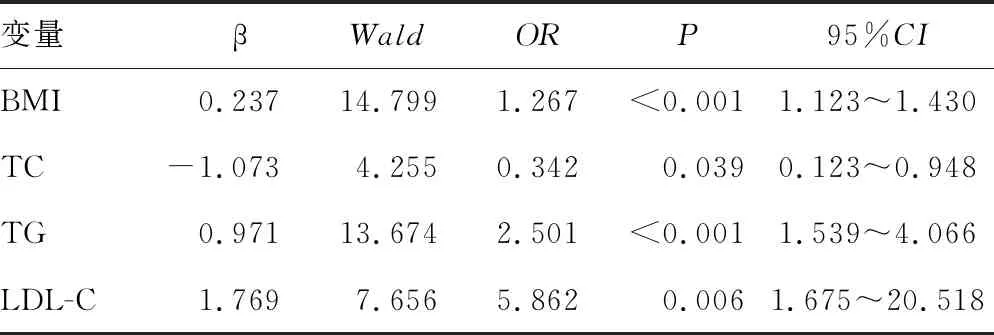
表2 T2DM合并NAFLD的Logistic回归分析
3 讨 论
随着饮食结构和生活方式的改变,导致肥胖发生率明显增加,也导致NAFLD发病率明显增加,在全球范围内已成为广泛危害健康的慢性疾病。近年研究证明,NAFLD患者通常代谢紊乱,与中心性肥胖、胰岛素抵抗和血脂异常有关,与T2DM紧密伴随[5]。在中国成人中NAFLD患病率为6%~27%[6],在T2DM患者中NAFLD患病率为57%~80%[7]。
本研究NAFLD在T2DM人群中发病率为59.2%,Hp感染在T2DM人群中发病率为60.3%,表明NAFLD及Hp感染在T2DM人群中发生率相似,而同时患NAFLD与有Hp感染者65例,其比例为36.3%。在T2DM人群中,同时患有NAFLD与Hp感染者BMI、腰围等指标升高,表明这类人群更易发生超重或肥胖;TC、TG、LDL-C等脂代谢指标水平升高,出现糖脂代谢紊乱的时间早,表明这类患者糖脂代谢紊乱较严重。
二元Logistic回归分析发现,BMI、TC、TG、LDL-C是T2DM患者合并NAFLD的独立危险因素(OR=1.267、0.342、2.501、5.862)。BMI是目前评价超重或肥胖的标准之一,超重或肥胖与T2DM、动脉粥样硬化、NAFLD关系密切,超重或肥胖患者体内脂肪组织中的巨噬细胞和其他免疫细胞增加,这些免疫细胞分泌促炎细胞因子,增加超重或肥胖患者胰岛素抵抗风险[8]。有研究发现,在初诊的T2DM患者中超重或肥胖可增加T2DM合并NAFLD的风险[9]。过多的脂质沉积,尤其是TG,是NAFLD形成和发展的先决条件;高三酰甘油血症患者游离脂肪酸增多,使胰岛素与胰岛素作用受体结合减少,胰岛素作用效率降低,导致胰岛素抵抗发生,高胰岛素血症和胰岛素抵抗又促进肝脏合成TG和极低密度脂蛋白,当肝中合成TG的速度超过了分泌TG入血的速度时,便出现肝中TG堆积,参与形成脂肪肝;T2DM与NAFLD相互影响,NAFLD导致T2DM患者的糖脂代谢紊乱更为严重,T2DM加速NAFLD的进展[10]。
最近研究结果表明,Hp感染不仅与消化系统疾病,如慢性胃炎、消化性溃疡、胃癌等相关,还与心脑血管疾病、结缔组织疾病、呼吸系统疾病及血液系统疾病等胃肠道以外疾病的发生密切相关。Hp感染会影响肠道菌群[11],导致胰岛素抵抗和糖代谢异常,认为Hp感染与NAFLD、胰岛素抵抗和代谢综合征相关[12]。
1996年芬兰的研究者首次提到Hp感染与血脂代谢的关系,在冠心病人群中,Hp感染者TG水平明显高于Hp阴性者,而HDL-C水平则低于Hp阴性者。有研究证明,Hp感染可能会导致血清TG、TC、LDL-C水平升高和HDL-C水平降低[13]。有研究结果发现,随着Hp感染程度加重,患者血清炎症因子[白细胞介素-6(IL-6)、IL-8、肿瘤坏死因子-α(TNF-α)]水平及TC、TG、LDL-C水平逐渐升高[14]。推测Hp感染影响患者体内炎性反应可能通过促使外周血单核细胞及黏膜固有淋巴细胞增生,从而诱导Th分化为Th2型细胞,而在参与黏膜表面的过敏反应和免疫应答时,Th2型细胞可分泌IL-6,导致机体IL-6水平升高;Hp影响患者体内脂代谢可能通过Hp携带的脂多糖刺激多种细胞因子产生,其中炎症因子占大多数,大量炎症因子释放可抑制脂蛋白酶降解,分离脂质与组织,造成血液中TC、TG、LDL-C水平升高。本研究结果显示,TC是T2DM患者合并Hp感染的独立危险因素(OR=1.467,P<0.05)。
综上所述,NAFLD与Hp感染均会影响血脂代谢及血糖代谢,加剧T2DM患者糖脂代谢紊乱。因此,有必要进行大量纵向随访研究,在T2DM人群中积极控制NAFLD的危险因素、开展Hp普查工作,从而为临床早期监测、预防和治疗T2DM及其相关疾病提供有效措施。