β淀粉样蛋白1-42寡聚体对人诱导性多能干细胞源性小胶质细胞炎症和氧化应激反应的影响
任 巧,张 林,刘小慧,蒋 宁,周文霞
(1.南京中医药大学,江苏 南京 210046;2.军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850)
阿尔茨海默病(Alzheimer disease,AD)是一种常见的神经退行性疾病,主要发生于老年人群,临床主要表现为认知功能障碍,如记忆力减退、失语、失认和视空间功能障碍等[1]。AD主要的病理特征是大脑中β淀粉样蛋白(β-amyloid protein,Aβ)聚集形成的老年斑、过度磷酸化的tau蛋白聚集而成的神经元纤维缠结、长期炎症反应以及神经元死亡等[2]。小胶质细胞是中枢神经系统固有的巨噬细胞样免疫效应细胞,在受损或炎症反应时可被活化。Aβ的异常聚集和沉淀会引起小胶质细胞的异常激活,导致神经炎症及氧化应激反应的发生,释放大量神经炎症因子[3]和活性氧(reactive oxygen species,ROS)[4]。近来研究认为,Aβ沉积激活小胶质细胞引起的炎症反应是AD患者脑结构改变的特征之一。因此,以小胶质细胞为靶标,抑制其激活和炎症反应已成为AD研究领域的热点之一。
目前用于AD研究的小胶质细胞主要有永生化小胶质细胞和原代小胶质细胞2种。永生化小胶质细胞虽然具有高度增殖特性,但只能部分模拟AD的病理变化[5];而原代人小胶质细胞获取困难,且在体外不能增殖[6]。因此,目前研究AD小胶质细胞的主要阻碍是缺乏足够的正常和带有疾病表型的小胶质细胞。人诱导性多能干细胞(human induced plurip⁃otent stem cells,hiPSC)具有与胚胎干细胞(embry⁃onic stem cells,ESC)类似的分化潜能[7],相较于ESC,hiPSC来源更丰富,携带患者的疾病信息[8-9],而且不涉及伦理学等问题,因此,hiPSC诱导分化的小胶质细胞(hiPSC-derived microglia-like cell,hiMGL)为研究人员提供了良好的细胞模型。当前hiMGL的研究多集中于诱导分化方法的优化及生理状态下hiMGL表型的探讨[10],或者选用携带致病性基因型突变的hiMGL,研究基因突变对hiMGL表型的影响[11]。但小胶质细胞作为脑内与Aβ清除及神经炎症最为密切相关的细胞,探讨Aβ对hiMGL表型和功能影响的研究尚未见文献报道。本研究将认知正常老年人(cognitively normal controls,CNC)和AD患者的hiPSC诱导分化为hiMGL,观察未给予刺激和给予Aβ1-42寡聚体(Aβ1-42-oligome,oAβ)刺激状态下对CNC和AD患者来源的hiMGL表型和功能的影响,以及oAβ刺激后的炎症反应和氧化应激反应。
1 材料与方法
1.1 试剂和仪器
mTeSR™1培养基(85850)和造血试剂盒(53100),加拿大Stemcell Technologies公司;小胶质细胞培养基(1900),美国ScienCell公司;胰岛素-转铁蛋白-硒添加剂(41400045)、B27(17504044)、N2(17502048)、谷氨酰胺(35050061)和非必需氨基酸(11140050),美国Thermo Fisher Scientific公司;1-硫代甘油(M175)和Aβ1-42(A9810),美国Sigma公司;四-α-螺旋束细胞因子(216-MC)、粒细胞-巨噬细胞集落刺激因子(215-GM)、白细胞介素(interleukin,IL)-34(5265-IL)、转化生长因子 β1(transforming growth factor β1,TGF-β1)(7754-BH)和类胰岛素样生长因子1(insulin-like growth factor-1,IGF-1)(291-G1)、OX-2膜糖蛋白(OX-2 membrane glycoprotein,CD200)(2724-CD-050)和CX3C趋化因子配体1(C-X3-C motif chemo⁃kine ligand 1,CX3CL1)(365-FR-025),美国R&D Systems公司;APC抗人CD43(343206)和PE/Cyanine7抗人CD34(343515),美国Biolegend公司;山羊抗离子钙接头蛋白分子1(ionized calcium binding adaptor molecule-1,IBA1)(ab5076)多克隆抗体和兔抗跨膜蛋白119(transmembrane protein 119,TMEM119)多克隆抗体(ab185337),美国Abcam公司;山羊抗兔AlexaFluorPlus 488(A32731)和驴抗山羊Alexa Fluor Plus 647(A32849)荧光IgG抗体,美国invitrogen公司;CCK-8试剂盒(CK04),日本同仁化学研究所;中性红(71028144),国药集团化学试剂有限公司;Aβ1-42ELISA试剂盒(Su-bn10279),北京成志科为生物科技有限公司;ROS检测试剂盒(S0033S),上海碧云天生物技术有限公司;蛋白酶抑制剂(P1265),北京普利莱基因技术有限公司;人细胞因子/趋化因子试剂盒(HCY⁃TOMAG-60K),美国Millipore公司;六氟异丙醇(H811026),上海麦克林生化科技有限公司。
EnSpire 多功能酶标仪(2300),美国 Perki⁃nElme公司;流式细胞仪(342975),美国BD公司;LuminexTM 200液相芯片,美国Millipore公司;离心机(D-37520),德国Heraeus公司;超声波仪(CH-300),北京创新德超声电子研究所;酶标板振荡器(ORBIT P4),美国Labnet公司;正置荧光显微镜(DM4000B),德国Leica公司。
1.2 细胞和细胞培养
6株hiPSC细胞系购于上海爱萨尔生物科技有限公司,具体信息见表1。hiPSC用mTeSR™1培养基在37℃,5% CO2的饱和湿度培养箱中培养,每天更换新的培养基,当细胞融合率接近70%~80%时传代。
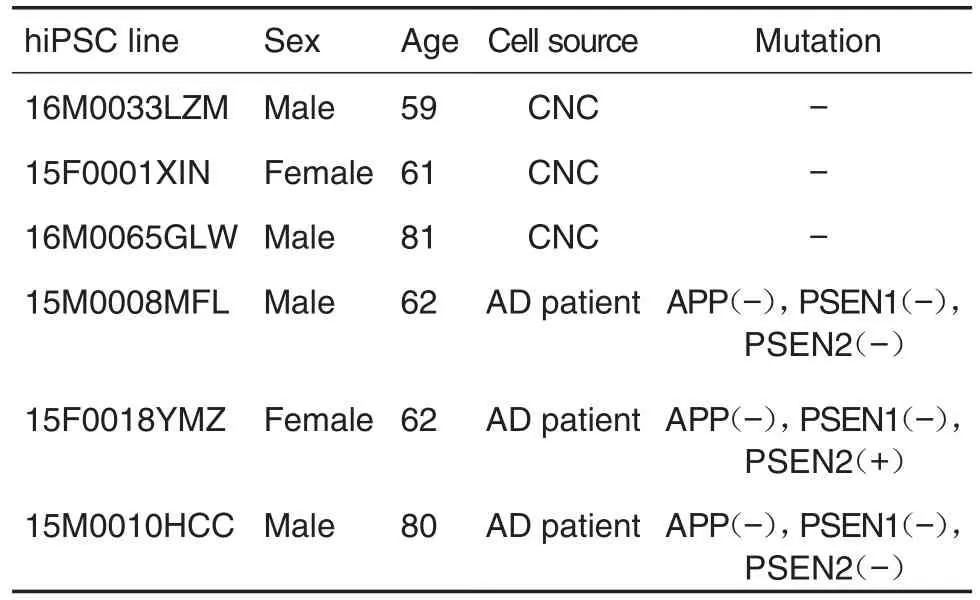
Tab.1 Demographic information of each human induced pluripotent stem cells(hiPSC)line
1.3 hiPSC诱导分化为hiMGL及细胞鉴定
按照本研究室前期建立的诱导分化方法[8],经2个步骤将6株hiPSC诱导分化成hiMGL。第一步,按造血试剂盒操作流程将hiPSC分化成造血祖细胞(hiPSC-derived hemopoietic progenitor cells,hiHPC),并采用流式细胞术检测表达hiHPC标志物CD34和CD43的阳性细胞率,以鉴定hiHPC阳性率;第二步,将hiHPC在完全分化培养基〔在小胶质细胞培养基中额外补充2%胰岛素-转铁蛋白-硒添加剂(V/V)、2% B27(V/V)、0.5% N2(V/V)、一硫代甘油(200 μmol·L-1)、谷氨酰胺(2 mmol·L-1)、非必须氨基酸(100 μmol·L-1)、四-α-螺旋束细胞因子(25 μg·L-1)、粒细胞-巨噬细胞集落刺激因子(25 μg·L-1)、IL-34(100 μg·L-1)、IGF-1(25 μg·L-1)和 TGF-β1(50 μg·L-1)〕中培养 23 d,而后更换含CD200和CX3CL1(各100 μg·L-1)的完全分化培养基继续培养3 d,将hiHPC诱导分化成hiMGL,并采用细胞免疫荧光法检测表达hiMGL标志物IBA1和TMEM119的阳性细胞率,以鉴定hiMGL阳性率。
1.4 ooAβ的制备
参照文献[12]操作流程制备oAβ。向Aβ1-42中加入六氟异丙醇,在室温下孵育60 min,于冰上放置5 min。将溶液分装,室温过夜,储存于-80℃。使用时加DMSO,水浴超声溶解。用PBS稀释后,37℃水浴孵育6 h。4℃,14 000×g离心10 min,将上清液(即oAβ)转移到新管备用。
1.5 CCK-8法检测hiMGL细胞存活
分别将2种来源的hiMGL消化后用小胶质细胞培养基重悬,以每孔2×104细胞的密度接种于96孔板中,在37℃、5% CO2的培养箱中培养24 h。分别将2种来源的hiMGL分为对照组和oAβ组(即CNC hiMGL对照组和AD hiMGL对照组,以及CNC hiMGL oAβ组和AD hiMGL oAβ组),分别加入含溶剂(DMSO 0.02%)或oAβ 1 μmol·L-1的培养基培养24 h。而后换不含oAβ的培养基,按试剂盒操作步骤加入10% CCK-8,37℃孵育2 h,使用酶标仪在450 nm处检测溶液吸光度(A450nm)值,表示细胞存活。每次实验设3个复孔,实验重复3次。
1.6 中性红吞噬实验检测hiMGL吞噬能力
细胞接种和分组处理同1.7。更换含0.5%中性红的培养基,37℃孵育30 min,PBS清洗3次。加入无水乙醇及冰醋酸(1∶1)配制的细胞裂解液,室温放置2 h。使用酶标仪检测细胞裂解液A540nm值,表示细胞内中性红的含量。
1.7 ELISA检测hiMGL清除oAβ的能力
将hiMGL以每孔5×105的密度接种于12孔细胞培养板并培养24 h。每孔加入oAβ(终浓度1 μmol·L-1)继续培养1.5 h,而后更换为不含 oAβ 的培养基。分别于去除oAβ后0,3,6和9 h加入细胞裂解液,4℃静置10 min后超声1 min,4℃、10 000×g离心10 min后取上清,用ELISA试剂盒测定细胞裂解液中oAβ含量。oAβ清除率(%)=(1-oAβ含量9h/oAβ含量0h)×100%。
1.8 荧光探针法检测hiMGL内ROS水平
细胞接种和分组处理同1.7。取hiMGL,按照ROS试剂盒操作流程处理,用多功能酶标仪检测细胞内荧光强度,表示hiMGL内ROS水平。
1.9 Luminex法检测hiMGL分泌细胞因子的能力
细胞接种和分组处理同1.7。收集各组细胞培养基,300×g离心3 min取上清,按照人细胞因子/趋化因子试剂盒操作流程进行处理,使用Luminex TM 200检测荧光强度,采用5-参数逻辑法或spline curve-fitting法计算细胞培养基中细胞因子IL-10、IL-1β、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、CC趋化因子配体7(C-C motif chemokine ligand 7,CCL7)和CXC趋化因子配体10(CXC chemokine ligand 10,CXCL10)的含量。
1.10 统计学分析
2 结果
2.1 细胞鉴定
基于课题组前期建立的诱导分化方案,首先将6株hiPSC诱导分化为hiHPC。流式细胞术检测结果显示,CNC和AD来源的各株细胞均可表达hiHPC标志物CD34和CD43,且阳性细胞率均>90%(图1A)。hiHPC进一步诱导分化为hiMGL,细胞免疫荧光检测结果显示,6株细胞均可表达小胶质细胞表面标志物IBA1和TMEM119(图1B),阳性细胞率均>90%,且CNC hiMGL和AD hiMGL阳性率无明显差异(图1C)。
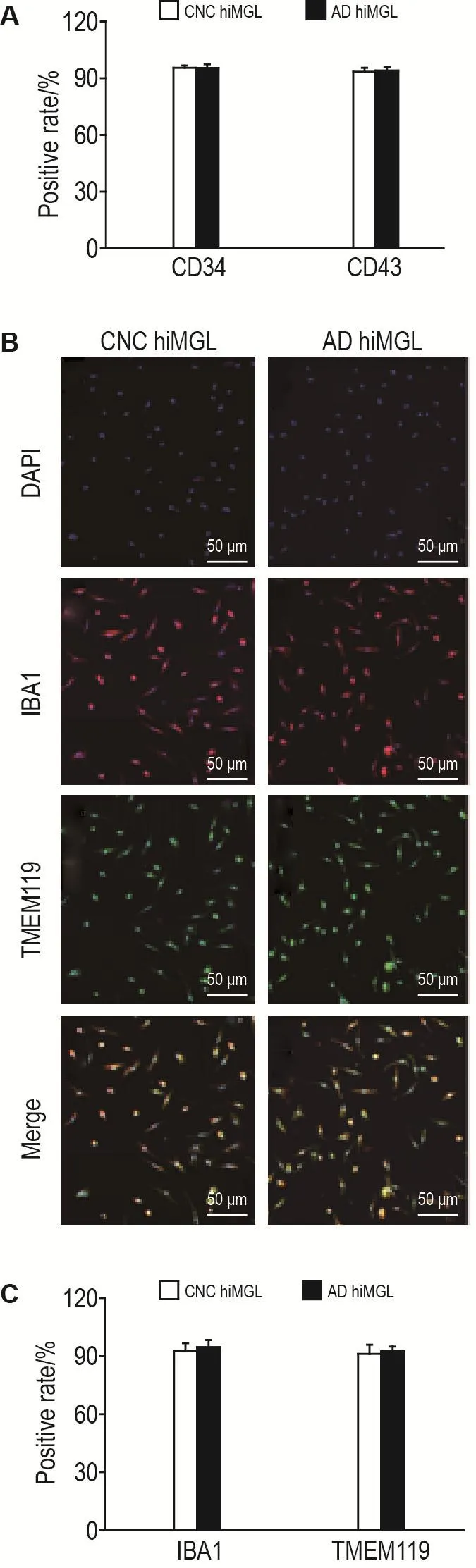
Fig.1 Authentication of human induced pluripotent stem cell(hiPSC)-derived hemopoietic progenitor cells(hiHPCs)and hiPSC-derived microglia-like cells(hiMGLs).The hiPSCs from cognitively normal controls(CNC)and Alzheimer disease(AD)patients were treated accord⁃ing to the differentiation protocol[8] established earlier by our research group.A:flow cytometry was used to detect hiHPCs from CNC and AD patients for hemopoietic progenitor cell-enriched protein CD34 and CD43.B:immunofluorescence label hiMGLs from CNC and AD patients for Ionized calcium binding adaptor molecule-1(IBA1)(red),transmembrane protein 119(TMEM119)(green)and nuclei(blue)on the 38thday respectively.C was the semi-quantitative result of B.hiMGL positive rate was assessed by cellular immunofluorescence of microglial-enriched protein IBA1 and TMEM119.±s,n=3.
2.2 oAβ对CNC hiMGL和AD hiMGL细胞存活的影响
由图2所示,在对照组中,AD hiMGL细胞存活显著高于CNC hiMGL(P<0.05);与各自对照组比较,CNC hiMGL oAβ组细胞存活增加了(51.6±5.7)%(P<0.01),AD hiMGL oAβ组细胞存活增加(62.8±11.2)%(P<0.01),表明AD hiMGL细胞存活增加更为明显;在oAβ组中,AD hiMGL细胞存活显著高于CNC hiMGL(P<0.01)。
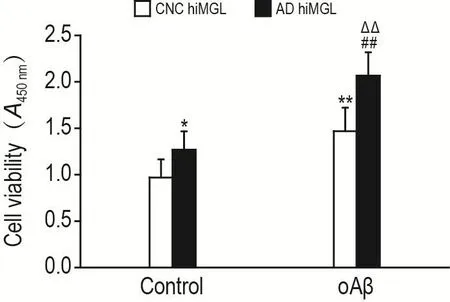
Fig.2 Effect of A β1-42-oligome(oAβ)on cell viability of CNC hiMGLs and AD hiMGLs by CCK-8 assay.CNC hiMGLs and AD hiMGLs were treated with oAβ 1 μmol·L-1or vehicle for 24 h,respectively.±s,n=3. *P<0.05,**P<0.01,compared with CNC hiMGL control group;##P<0.01,compared with AD hiMGL control group;△△P<0.01,compared with CNC hiMGL oAβ group.
2.3 oAβ对CNC hiMGL和AD hiMGL吞噬能力的影响
由图3所示,在对照组中,AD hiMGL对中性红的吞噬能力显著高于CNC hiMGL(P<0.05);与各自对照组比较,CNC hiMGL oAβ组吞噬能力增加(48.1±2.1)%(P<0.01),AD hiMGL oAβ组吞噬能力增加(47.2±2.7)%(P<0.01)。在oAβ组中,AD hiMGL吞噬能力显著高于CNC hiMGL(P<0.01)。
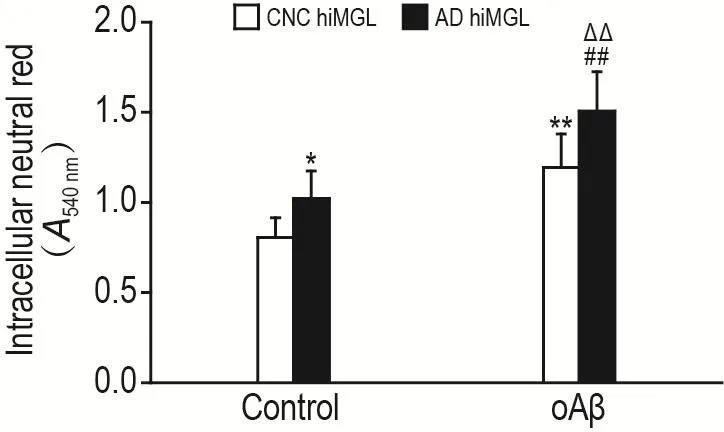
Fig.3 Effect of oAβ on phagocytic ability of CNC hiMGLs and AD hiMGLs by neutral red phagocytosis assay.See Fig.2 for the cell treatment.±s,n=3.*P<0.05,**P<0.01,compared with CNC hiMGL control group;##P<0.01,compared with AD hiMGL control group;△△P<0.01,compared with CNC hiMGL oAβ group.
2.4 oAβ对CNC hiMGL和AD hiMGL ROS水平的影响
由图4所示,在对照组中,AD hiMGL的ROS水平显著高于CNC hiMGL(P<0.05);与各自对照组比较,CNC hiMGL oAβ组ROS水平增加(140.0±24.7)%,AD hiMGL oAβ组增加(79.8±11.5)%(P<0.01),CNC hiMGL ROS水平上升更为明显。在oAβ组中,AD hiMGL的ROS水平仍显著高于CNC hiMGL(P<0.01)。
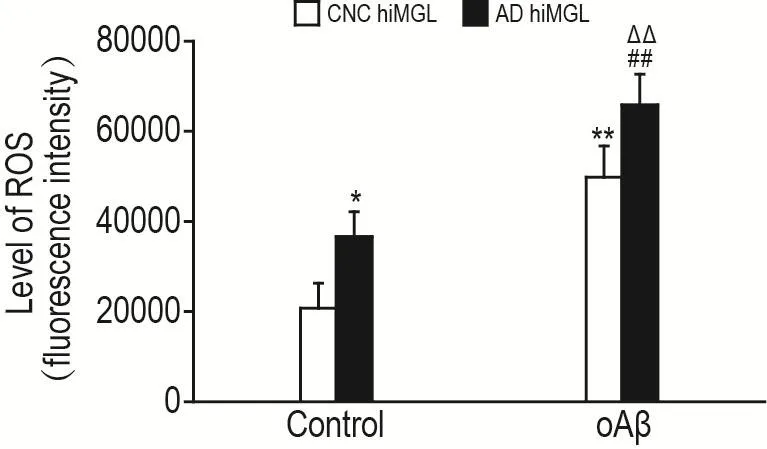
Fig.4 Effect of oAβ on reactive oxygen species(ROS)level of CNC hiMGLs and AD hiMGLs by ROS detection kit.See Fig.2 for the cell treatment.±s,n=3.**P<0.01,compared with CNC hiMGL control group;##P<0.01,compared with AD hiMGL control group;△△P<0.01,compared with CNC hiMGL oAβ group.
2.5 oAβ对CNC hiMGL和AD hiMGL分泌细胞因子水平的影响
由图5所示,在对照组中,AD hiMGL分泌5种细胞因子(IL-10,IL-1β,TNF-α,CCL7和CXCL10)的水平显著高于CNC hiMGL(P<0.05,P<0.01)。与各自对照组比较,CNC hiMGL和AD hiMGL的oAβ 组分泌 IL-10,IL-1β,IL-6,TNF-α,CCL7 和CXCL10的水平均显著升高(P<0.01)。在oAβ组中,AD hiMGL分泌6种细胞因子的水平均显著高于CNC hiMGL(P<0.01)。
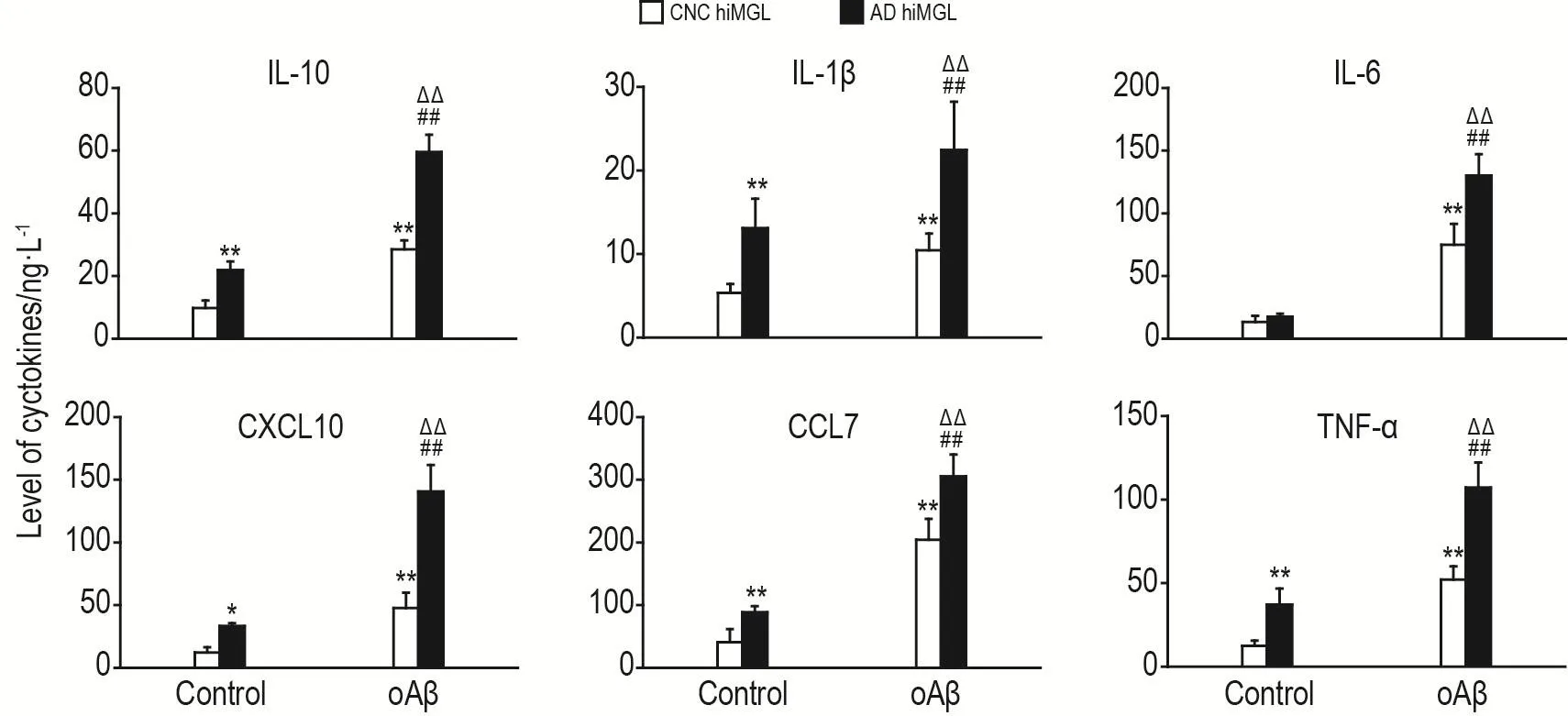
Fig.5 Effect of oAβ on levels of cyctokines in CNC hiMGLs and AD hiMGLs by Luminex assay.See Fig.2 for the cell treatment.IL:interleukin;CXCL10:CXC chemokine ligand 10;CCL7:CC chemokine ligand 7;TNF-α:tumor necrosis factor-α.±s,n=3.*P<0.05,**P<0.01,compared with CNC hiMGL control group;##P<0.01,compared with AD hiMGL control group;△△P<0.01,compared with CNC hiMGL oAβ group.
2.6 CNC hiMGL和AD hiMGL对oAβ的清除能力
由图6所示,终止孵育oAβ后0 h,AD hiMGL内oAβ含量高于CNC hiMGL(P<0.01)(图6A),表明AD hiMGL吞噬oAβ的能力强于CNC hiMGL;0~3 h,AD hiMGL和CNC hiMGL内剩余的oAβ含量无明显差异;3~9 h,AD hiMGL细胞内剩余的oAβ含量逐渐高于CNC hiMGL(图6B);9 h时,AD hiMGL对oAβ的清除率显著低于CNC hiMGL(P<0.01)(图6C),提示AD hiMGL清除oAβ的能力明显弱于CNC hiMGL。
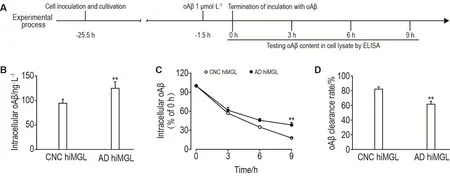
Fig.6 oAβ clearance ability of CNC hiMGLs and AD hiMGLs by ELISA assay.oAβ content in lysate of hiMGL at different time points after termination of incubation with oAβ.A:experiment flow diagram;B:content of oAβ in CNC hiMGL and AD hiMGL at termi⁃nation of incubation(0 h);C:oAβ content in CNC hiMGL and AD hiMGL during 0-9 h;D:oAβ clearance rate of CNC hiMGL and AD hiMGL at 9 h.oAβ clearance rate(%)=[1-(intracellular oAβ content)9 h/(intracellular oAβ content)0 h]×100%.±s,n=3.**P<0.01,compared with CNC hiMGL group.
3 讨论
本研究将CNC和AD患者来源的hiPSC诱导分化为hiMGL,观察oAβ对CNC hiMGL和AD hiMGL表型和功能的影响,及oAβ刺激后2种hiMGL的炎症反应和氧化应激反应。结果表明,hiPSC诱导分化得到的hiMGL表达小胶质细胞特征性标志物IBA1和TMEM119,且阳性细胞率>90%,提示获得的hiMGL具有小胶质细胞的表型。与各自对照组比较,oAβ刺激组AD hiMGL和CNC hiMGL的细胞存活、吞噬能力以及细胞因子分泌能力均明显增加,且AD hiMGL细胞存活、吞噬能力以及细胞因子的分泌能力均显著高于CNC hiMGL,表明oAβ刺激可引起hiMGL的炎症反应[13-14],且AD hiMGL的反应更强。文献报道,与正常老年人相比,AD患者脑内小胶质细胞炎症基因的表达普遍上调[15],这与本研究结果一致。
炎症状态下的小胶质细胞是脑内ROS的主要来源,小胶质细胞内ROS水平是衡量脑内氧化应激程度的重要指标。本研究发现,oAβ刺激组AD hiMGL和CNC hiMGL ROS水平均显著上升,AD hiMGL的ROS水平显著高于CNC hiMGL;但oAβ刺激后CNC hiMGL的ROS水平增加程度高于AD hiMGL。文献报道,Aβ可引起小胶质细胞氧化应激反应[16]。在AD患者的脑组织中,除自由基在细胞内积累外,超氧化物歧化酶和过氧化氢酶等抗氧化酶的活性或表达也发生了变化,且AD患者脑内氧化应激水平高于正常老年人,说明氧化应激是AD的一个重要病理特征[17-18]。此外,Aβ引起的炎症反应会诱发氧化应激反应,导致脂质过氧化以及DNA损伤,进一步诱导神经元凋亡[19-20]。
小胶质细胞作为中枢神经系统的免疫细胞,是AD患者脑内清除Aβ的主要参与者[21]。Aβ在小胶质细胞内可以经再循环途径被转运到细胞外,还可以经过溶酶体途径降解,小胶质细胞降解Aβ的能力对Aβ的积聚和沉积至关重要[22]。本研究发现,AD hiMGL吞噬oAβ的能力高于CNC hiMGL,但随时间推移,AD hiMGL降解oAβ速率明显减慢。临床研究发现,AD患者脑内Aβ降解存在障碍,这与小胶质细胞长期处于较高的炎症环境下,降低了其Aβ降解酶的表达水平有关[23]。
综上所述,本研究成功将hiPSC诱导分化为hiMGL,获得的hiMGL具有小胶质细胞的表型;oAβ刺激后,与CNC hiMGL相比,AD hiMGL表现出更强的炎症反应和氧化应激反应,且降解oAβ的能力减弱。本研究为后续应用hiMGL进行AD病理机制的研究及抗AD药物的筛选提供了实验依据。

