葡萄糖水平与衰老机制相关性研究进展
杨吾燕,高 丽,秦雪梅
(山西大学1.中医药现代研究中心,2.化学化工学院,山西 太原 030006)
衰老是一种无法抗拒的自然规律,是机体在老化过程中结构功能出现衰退的现象。近年来,我国人口老龄化问题日益突出,有专家预测到2050年每4人中就有1位老年人,届时衰老和衰老相关疾病将带来重大的医疗负担[1]。因此,探索衰老的机制以及延缓衰老的途径,已成为医学研究领域的热点和亟待攻克的难题。
葡萄糖是体内最主要的能源物质,在维持基本生理活动方面有重要作用。在正常情况下,葡萄糖不仅能为细胞脂质、蛋白质代谢提供能量,从而保证大脑等重要器官的能量供应,还可有效调节体内电解质平衡和酸碱平衡。然而,当机体血糖水平异常升高或降低时,将导致能量代谢异常,进而诱发衰老。本文将从糖代谢与衰老的关系出发,围绕葡萄糖影响衰老的机制展开综述,为衰老机制研究和抗衰老药物的研发提供新的理论依据。
1 衰老概述
1.1 衰老学说
随着人们对衰老研究的不断深入,衰老相关学说如自由基学说、端粒学说、DNA损伤学说等受到了广泛的认可。自由基学说认为大量自由基会对细胞成分造成损伤,并最终导致衰老相关分泌表型(senescence-associated secretory phenotype,SASP)的出现[2];端粒学说则认为端粒的磨损或缩短通过引发细胞衰老而促进整个机体的衰老[3]。鉴于生物体衰老是一个高度复杂的过程,很难有一种学说能完整地揭示衰老的机制。
1.2 衰老标志
机体受到不同刺激后,体内的细胞会出现一系列特征标志,提示其已进入衰老状态。这些衰老标志包括:基因组不稳定性、端粒磨损、表观遗传改变、蛋白质稳态丧失、线粒体功能障碍、细胞衰老、营养传感失调、干细胞衰竭和细胞间通讯改变[4]。鉴于衰老以及衰老相关神经退行性疾病的复杂性,单一途径的靶向治疗方法具有一定的局限性。因此,综合研究衰老发生的相关标志将会对此类疾病的治疗带来新的希望。
1.3 衰老的诱因
衰老是一种由多种内在或外在损伤引起的细胞应激反应,多种因素均可诱导细胞衰老,主要表现在:第一,紫外线和化疗药物,二者均能引起不可逆转的DNA损伤,进而导致细胞衰老[5]。第二,高水平的活性氧(reactive oxygen species,ROS),已有研究证明,高水平的ROS将促进细胞衰老,并随暴露时间的延长而愈加明显[6]。第三,癌基因的激活或肿瘤抑制因子的失活。癌基因诱导的衰老是通过激活原癌基因来诱导细胞生长停滞等衰老表型的出现,而肿瘤抑制因子如第10号染色体同源性丢失性磷酸酶-张力蛋白基因的失活也会诱导细胞衰老[7-8]。第四,糖代谢紊乱可加速衰老过程。高糖与低糖环境均会加速细胞衰老,其中高糖环境还会通过上调衰老相关蛋白P16的表达,促进SASP的分泌,进而促使衰老及相关疾病的发生[9]。
2 糖代谢与衰老
糖代谢是机体重要的生物代谢途径之一,主要通过葡萄糖氧化分解产生能量以维持机体基本需求。糖尿病会使机体表现出高糖状态,而低血糖症以及阿尔兹海默病等疾病则会使机体表现出低糖的状态[10]。不同病理条件下的糖代谢紊乱,可通过调控糖酵解、糖有氧氧化、磷酸戊糖途径(pentose phosphate pathway,PPP)和糖异生的方式导致机体过早衰老[11]。
2.1 糖酵解与衰老
糖酵解是葡萄糖在无氧或缺氧环境下产生乳酸和能量的一条途径。越来越多的研究表明,在衰老细胞中可观察到较高的糖酵解水平[12]。尽管衰老细胞丧失了增殖活性,但其代谢活性依然存在。胰岛β细胞功能障碍会导致高血糖,进而使糖酵解中间产物增加和糖酵解水平升高,细胞中过度的糖酵解将再次增加葡萄糖摄取,促进甲基乙二醛和α-突触核蛋白的产生,最终加速衰老[13-14]。胰岛素分泌增多或胰高血糖素分泌减少会导致低血糖,在低糖条件下,突变型蛋白酪氨酸激酶(Janus kinase 2,JAK2)表达的增加提高了细胞糖酵解水平并导致机体代谢紊乱,最终加速衰老的进程[15-16]。
2.2 糖的有氧氧化与衰老
糖的有氧氧化是葡萄糖在有氧环境下彻底氧化生成二氧化碳和水并产生大量能量的过程。三羧酸循环和氧化磷酸化是糖有氧氧化过程的关键环节。当机体对胰岛素的敏感性降低时,大脑葡萄糖利用率降低,三羧酸循环受损,并导致其代谢产物柠檬酸盐的生成减少,最终使ATP合成不足,进而加速衰老进程[17]。机体胰岛β细胞代谢受损会导致葡萄糖水平升高,从而使参与氧化磷酸化的多种基因显著下调,氧化磷酸化速率降低,且NADH和ATP的生成受到了抑制,严重影响了线粒体的正常功能,并进一步诱发衰老[18]。
2.3 磷酸戊糖途径与衰老
PPP是6-磷酸葡萄糖在酶催化下生成大量NADPH的过程,可为合成代谢提供原料。机体胰岛功能障碍能导致高血糖的发生,从而使PPP异常,其机制与此途径重要的关键酶之一6-磷酸葡萄糖脱氢酶活性降低有关。在PPP中,高糖环境诱导了6-磷酸葡萄糖脱氢酶的泛素化和降解,使ROS蓄积从而导致细胞衰老,甚至还能调控细胞从衰老走向凋亡[19]。
2.4 糖异生与衰老
糖异生是多种非糖物质重新合成葡萄糖的过程,有效地维持了血糖的动态平衡。机体胰高血糖素分泌增加会使血糖水平升高,促进糖异生作用,进而加速衰老,在高糖环境下限制糖异生,可减轻氧化应激(oxidative stress,OS)和炎症反应,起到延缓衰老的作用[20]。
3 葡萄糖影响衰老的相关机制
3.1 氧化应激
OS是指体内氧化系统平衡遭到破坏,并导致基因表达改变及细胞衰老等表型改变的过程[21]。OS是衰老的主要驱动力之一,ROS及其他OS产物的过量生成能时间依赖性加速细胞衰老,引发衰老和衰老相关性疾病。高糖环境可通过增强脂质过氧化作用,导致过量的ROS生成并引起OS,最终诱导晚期糖基化终末产物的形成,进而引发衰老相关疾病[22]。此外,高糖环境可诱发血管内皮细胞OS,使衰老相关标记物β-半乳糖苷酶的表达上调,并下调沉默信息调节因子长寿蛋白家族表达[23]。低糖环境则促使ROS激活钙蛋白酶,从而导致脑损伤相关的神经变性,并增加细胞周期蛋白A和周期蛋白B的表达[24]。因此,高、低糖环境均可通过增加机体或细胞内ROS的水平,引起OS,进而促使衰老的发生。
3.2 内质网应激
内质网应激(endoplasmic reticulum stress,ERS)是指由某种因素引起内质网的内稳态体系失衡,并导致蛋白质错误折叠、脂质代谢紊乱以及炎症反应的过程[25]。在老化过程中,ERS能引起蛋白质沉积,这种异常积累会导致神经退行性疾病的发生[26]。内质网对体内葡萄糖水平的波动有较高的敏感性。当体内葡萄糖水平过高时,可观察到ERS相关标志蛋白的表达增加,引起Aβ沉积和tau蛋白过度磷酸化,导致认知障碍,增加了阿尔茨海默病等神经退行性疾病的患病风险[27]。此外,持续的高糖环境还会加剧ERS,促使神经元凋亡和神经胶质增生,并产生过量的炎症因子,进一步加速衰老[28]。低糖应激则通过过表达ERS蛋白ATF6α,增加衰老标志物β-半乳糖苷酶的活性,并通过形成负反馈影响SASP的组成,进一步促进衰老[29-31]。因此,高糖环境易使蛋白质沉积,导致认知功能障碍。低糖环境则是通过影响SASP,最终导致衰老及衰老相关疾病的发生。
3.3 线粒体功能障碍
线粒体功能障碍是指由线粒体DNA缺陷、能量代谢异常等引起的一系列细胞结构或功能的改变。线粒体功能障碍能促进SASP的产生,是衰老和衰老相关认知功能障碍的主要发病机制,故改善线粒体功能可治疗衰老相关疾病[32]。高糖环境会导致机体出现线粒体功能障碍,并使线粒体DNA的完整性、拷贝数以及线粒体融合调节因子表达均降低,最终引发机体器官的老化[33-34]。将细胞暴露于低糖环境中会造成线粒体质量降低,最终导致线粒体功能障碍[35]。因此,高糖损伤主要通过损伤线粒体质量和线粒体功能两方面来促进衰老的发生,而低糖损伤则是通过使线粒体质量降低来加快衰老的进程。
3.4 肌动蛋白细胞骨架动力学的改变
肌动蛋白细胞骨架被认为是一个重要的亚细胞微丝系统,负责细胞增殖分裂和信号转导等过程,肌动蛋白细胞骨架的重排或完整性的破坏能导致多种衰老相关神经退行性疾病的发生[36]。高糖环境会导致肌球蛋白轻链激酶表达上调并诱导神经元损伤,且能诱导突触收缩,进而导致微丝损伤和细胞骨架性状不规则,最终引起丝状肌动蛋白的重排和突触功能障碍,使机体出现衰老相关认知缺陷[37-38]。此外,糖尿病患者细胞骨架的肌动蛋白会呈现亚硝基化,从而诱导了白细胞介素1β等炎症因子的分泌,进一步加速衰老[39]。当细胞暴露于低糖环境时,丝状肌动蛋白重新分布,诱导细胞骨架发生重排,使细胞衰老生物标志物过早出现[40]。因此,高、低糖环境均通过重排肌动蛋白细胞骨架,破坏正常的肌动蛋白动力学,导致细胞衰老和认知缺陷,并加快衰老相关疾病的进程。
3.5 自噬功能紊乱
自噬是一种存在于生物体细胞内的稳态调节机制,通过清除受损细胞来维持真核生物的正常功能。自噬缺陷可引起神经退行性疾病等衰老相关疾病,而激活自噬可以显著延长寿命,延缓衰老[41]。高糖环境可引起自噬缺陷,导致生长迟缓和寿命缩短,以及出现骨矿物质密度降低等衰老样表型,还会在细胞水平上诱导OS和线粒体功能障碍,共同促进器官衰老[42]。低糖环境可通过阻断自噬通量并导致溶酶体功能障碍,进而抑制自噬,最终加速衰老的进程[43-44]。因此,高糖或低糖环境均可通过抑制自噬,使自噬相关功能缺陷,进而促使衰老的发生。
4 葡萄糖通过影响相关信号通路从而调控衰老
4.1 Nrf2信号通路
核转录因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)是一种转录调节因子,在调节OS所致的衰老中有重要作用[45]。研究表明,抑制Nrf2介导的细胞抗氧化通路可引发细胞衰老,并加快衰老标志物(P16和P21)和SASP的出现[46-47]。急性高血糖会增加Nrf2的表达,但持续性高血糖会降低Nrf2的表达[48]。持续性高糖环境使Nrf2核定位发生错误,导致Nrf2下游靶基因表达下调,从而抑制Nrf2信号通路,并同时降低沉默调节蛋白1(sirtuin 1,Sirt1)的表达,诱导了OS和神经炎症,最终导致衰老相关疾病的发生[49]。研究表明,一种植物化学成分Antcin M可直接激活Nrf2信号通路并减少ROS的生成和衰老相关标志物的表达,促进细胞增殖,最终延缓衰老[50]。持续的低糖环境可能通过引起血脑屏障功能障碍和诱发神经炎症这2种机制来抑制Nrf2信号通路的激活,进而引发衰老[51-52]。因此,机体或细胞长期处于高糖环境会降低Nrf2和相关靶蛋白的表达,从而抑制Nrf2信号通路,并增强OS以及引发神经炎症,最终使机体步入衰老。低糖环境主要是通过损害血脑屏障,进而抑制Nrf2信号通路,并加速衰老。
4.2 PERK信号通路
蛋白激酶R样内质网激酶(protein kinase R-like endoplasmic reticulum kinase,PERK)是一种定位于内质网的跨膜蛋白激酶,在ERS中扮演着重要的角色。PERK信号通路的持续激活与衰老相关神经退行性疾病和认知功能障碍的发生有关[53]。高糖环境可使细胞内诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)的表达和一氧化氮(nitric oxide,NO)生成增加,过量的NO会持续激活PERK信号通路,最终导致了神经元衰老和认识功能障碍[54-55]。研究表明,成纤维细胞生长因子1可通过抑制PERK通路减轻ERS和突触功能障碍,从而改善了由糖尿病引起的认知缺陷[56]。持续的低糖损伤激活PERK通路,显著上调了ERS标志物ATF4和凋亡相关蛋白CHOP的表达,并造成细胞生长停滞和DNA损伤,进而加速衰老[57]。因此,高、低糖环境都可通过相应的机制激活PERK信号通路,进一步加快衰老的进程。
4.3 AMPK信号通路
腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)是一种关键的细胞能量传感器和代谢调节因子。激活AMPK信号通路能抑制炎症反应,延缓衰老,相反抑制AMPK通路会加速衰老[58]。高糖环境促使细胞释放醛糖还原酶,降低了Sirt1和AMPKα1的表达,从而抑制了AMPK信号通路[59]。研究表明,抗糖尿病药物二甲双胍可通过增加AMPKα1的表达,激活AMPK信号通路,修复受损的线粒体呼吸链和恢复线粒体膜电位,进而延缓衰老[60]。持续性低糖损伤会使AMPK表达下调,导致线粒体功能障碍,并伴随cAMP反应元件结合蛋白磷酸化水平降低,最终加快了衰老相关疾病的进程[61]。因此,长时间的高、低糖环境均可使线粒体功能障碍,从而抑制AMPK信号通路,最终加速衰老。
5 结语
随着人口老龄化进程的加快,衰老及衰老相关疾病的发病率急剧增加,带来了沉重的社会负担。机体衰老往往伴随着细胞衰老,多种因素均可诱发细胞衰老。如图1所示,葡萄糖代谢是维持机体正常生理功能必不可少的环节,高糖、低糖环境均与衰老和衰老相关疾病的发生密切相关,一方面可直接引起应激反应、线粒体功能障碍、细胞骨架重排及自噬功能紊乱,另一方面则是通过影响衰老相关信号通路,最终导致衰老细胞的堆积,加速机体衰老。此外,低糖环境对衰老亦有一定的抑制作用。能量摄入的限制在一定程度上能改善内分泌功能,阻止晚期糖基化终末产物的积累以及长链不饱和脂肪酸的氧化反应,进而延缓衰老相关疾病的发生[62]。
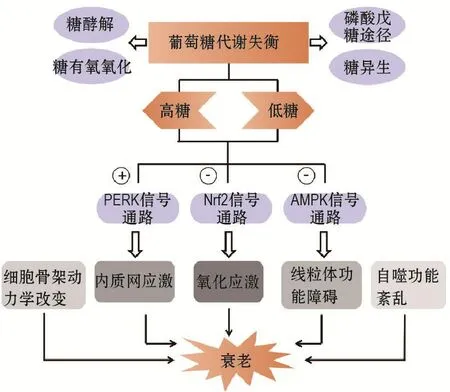
图1 葡萄糖水平影响衰老的相关机制.+:促进;-:抑制;PERK:蛋白激酶P样内质网激酶;Nrf2:核转录因子E2相关因子2;AMPK:腺苷酸活化蛋白激酶.
目前大量研究主要集中于高糖致衰老,但仍面临以下挑战:各机制间如何相互联系共同促进衰老;机体处于高糖状态与糖尿病间的复杂关系仍待阐明,以及如何利用改善葡萄糖代谢的药物延缓细胞衰老或减轻神经炎症和认知障碍等还需进行深入研究。
毫无疑问,改善能量代谢为抗衰老新药研发提供了新的思路和方向,维持体内葡萄糖的平衡对于延缓衰老和治疗老年疾病具有重大意义。相信随着研究的不断深入,糖代谢紊乱疾病与衰老之间的内在联系将逐渐明晰。

