PCB118暴露对青春期雄性ICR小鼠精子发生的影响及机制
沈文敏,陶钰荣,张 琳,孟令娇,刘 丽,刘树真
(山东师范大学生命科学学院,山东省动物抗性生物学重点实验室,山东 济南 250014)
多氯联苯(polychlorinated biphenyls,PCB)又称氯化联苯,是20世纪70年代人工合成的一种环境雌激素类的持久性有机污染物。PCB可在大气、水和土壤中循环,遍布全球,其在空气、水、沉积物、鱼类、野生动物及人体脂肪组织和血清中都有检出[1-4]。国际癌症研究机构(International Agency for Research on Cancer,IARC)将PCB归类为“第一类人类致癌物”[5],其可分为类二噁英和非类二噁英同系物2大类。
2,3’,4,4’,5-五氯联苯(2,3’,4,4’,5-penta⁃chlorobiphenyl,PCB118)属于类二噁英类PCB的一种[6],具有强稳定性和亲脂性,可在动物脂肪中积累,并通过食物链进行生物富集。与其他PCB同系物相比,PCB118的毒性较强[7]。PCB118与芳香烃受体结合后从细胞质转移到细胞核,与芳香烃受体核转位蛋白(aryl hydrocarbon receptor nuclear transportor,ARNT)形成异源二聚体[8],识别并结合靶基因上游区的生物异源物质效应元件,并与相关因子结合,导致下游基因转录和表达异常,引发毒性效应[9-12]。
研究表明,PCB可降低雄性大鼠精子数量和活力,影响精子发生过程[13-14]。流行病学调查也证实这一点[15-16]。睾酮可与雄激素受体(androgen receptor,AR)结合,参与曲细精管生精上皮的维持和精子发生进程,对机体雄性化、个体发育和男性生育力的维持起重要作用[17-18]。研究发现,睾酮合成通路的改变与PCB的毒性作用有关。例如,大鼠哺乳期暴露PCB的商品化混合物——Aroclor 1254,导致出生后60 d的子代雄鼠睾丸间质细胞中睾酮合成相关酶的表达降低,致使血清睾酮水平下降[19]。Aroclor 1254暴露的体外实验也得到类似结果[20]。以往研究大多针对PCB的混合物对精子和(或)睾酮的影响,PCB单体在此方面的研究较少,迄今未见PCB118对精子发生与睾酮合成通路的影响及其关系的研究报道。本研究根据越南人每日从食品中摄入PCB的量换算成小鼠每日暴露剂量(即500 μg·kg-1)[21-23],通过检测PCB118暴露对青春期ICR雄鼠睾酮合成过程和精子生成的影响,探索PCB118影响精子发生过程的机制。
1 材料与方法
1.1 药物、试剂和仪器
PCB118,德国Dr.Ehrenstorfer GmbH公司,纯度≥99.8%;玉米油,美国Sigma公司;碘[125I]睾酮放射免疫分析试剂盒,天津九鼎医学生物工程有限公司;ChamQ Universal SYBR qPCR Master Mix实时荧光定量PCR试剂盒(Q711-02/03)、HiS⁃cript®ⅡQ Select RT SuperMix for qPCR(+gDNA wiper)反转录试剂盒(R233-01)和ECL化学发光检测试剂盒(E412-01),南京诺唯赞生物科技有限公司;DAB显色试剂盒(ZLI-9017),北京中杉金桥生物科技有限公司;兔抗小鼠AR单克隆抗体(ab133273),美国Abcam公司;兔抗小鼠增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)单克隆抗体(13110),美国CST公司;兔抗小鼠α微管蛋白单克隆抗体,武汉三鹰生物技术有限公司;辣根过氧化物酶标记山羊抗兔(H+L)IgG(ZB-5301),北京中杉金桥生物科技有限公司。冷冻高速离心机,美国Thermo Fisher公司;数字切片扫描仪,匈牙利3DHISTECH公司;酶标仪,美国Molecular Devices公司;凝胶成像仪,北京科创锐新生物科技有限公司;荧光实时定量PCR仪,美国Roche公司;精子活力分析仪,德国Minitube公司;GC-911 γ放射免疫计数器,科大创新股份有限公司中佳分公司。
1.2 动物和分组
36只SPF级雄性ICR小鼠,3周龄,体质量14~16 g,由济南朋悦实验动物繁育有限公司提供,许可证号:SCXK(鲁)2019-0003。饲养环境室温20~24℃,相对湿度40%~50%,12 h/12 h昼夜明暗交替,小鼠自由饮水、摄食。
适应性饲养1周后的小鼠随机分为3组:溶媒(玉米油)对照组和PCB118(50和500 μg·kg-1)组,每组12只。分别ig给予不同剂量PCB118或等体积溶媒,每日1次,连续4周。期间每日称量小鼠体质量,染毒结束次日,ip给予3%戊巴比妥钠麻醉小鼠,心脏穿刺取血,全血室温放置2~3 h,先后以1 246×g和312×g室温离心3 min,收集血清,于-80℃保存。处死小鼠后,迅速取睾丸、附睾、肝、肾和脾称重,附睾立即用于精子质量检测,左侧睾丸于-80℃保存,右侧睾丸放入Bouin’s固定液用于组织切片分析。
1.3 体质量和脏器系数的测定
计算实验前后雄鼠体质量之差,记作体质量增长量。脏器系数=脏器质量(g)/体质量(g)×100。
1.4 HE染色观察睾丸组织病理损伤
将右侧睾丸放入Bouin’s固定液固定24~48 h,用石蜡包埋,制备5 μm组织切片。切片经HE染色后,用数字切片扫描仪拍照,观察组织病理学改变,随机选取不同视野,用Case Viewer软件统计50个曲细精管的直径、生精上皮的厚度和15个曲细精管中精原细胞的相对数目(相对数目=精原细胞数/曲精细管直径)。
1.5 精子数、精子活力和精子畸形率检测
将1 mL体外受精培养液置于37℃CO2细胞培养箱中预热0.5 h,使用前1 h加入人血清白蛋白。将小鼠左侧附睾尾用生理盐水清洗后置于体外受精培养液中,将附睾尾剪碎,37℃温育15 min,取适量上层精子悬液稀释,在显微镜下用血球计数板记数精子数。取5 μL上层精子悬液滴于载玻片上,盖上盖玻片,于精子活力分析仪中自动检测精子活力(即精子快速前进、缓慢前进、环状移动和原地移动的活力之和)。取右侧附睾尾置于1 mL 37℃预热的0.9%生理盐水中并剪碎,于CO2培养箱中37℃孵育10 min,取20 μL上层精子悬液,在载玻片上均匀涂片,室温自然干燥,75%乙醇固定10 min,随后加入0.5%伊红染液染色15 min,去离子水缓慢冲洗多余染液,室温中自然晾干,每份精液样品制片3张,于显微镜下随机取不少于1000个精子,记录无钩、香蕉型、胖头、双头、双尾、尾折叠和无定型7种类型畸形精子的数目,计算精子畸形率。
1.6 放射免疫法检测血清睾酮水平
取1.2收集的小鼠血清,根据碘[125I]睾酮放射免疫分析药盒说明书进行操作,用GC-911 γ放射免疫计数器测得睾酮水平,每份样品重复3次。
1.7 RT-qPCR法检测睾酮合成相关酶和Ar mRNA水平
用Trizol法提取小鼠睾丸组织总RNA,参照HiScript®ⅡQ Select RT SuperMix for qPCR(+gDNA wiper)试剂盒步骤合成cDNA,参照 ChamQ Uni⁃versal SYBR qPCR Master Mix试剂盒步骤进行实时荧光定量PCR检测。除内参的引物应用Primer Premier 5.0软件进行设计外,其余基因引物序列来源于文献[24],引物序列见表1。引物由武汉金开瑞生物工程有限公司合成,经PAGE纯化,采用2-ΔΔCt法计算目的基因的相对表达水平。
1.8 Western印迹法检测睾丸组织中AR和PCNA蛋白表达
取30 mg冰冻睾丸组织放入预冷的200 μL RIPA裂解液中,冰上匀浆后,超声处理(每次1 min,重复3次),4℃ 18 845×g离心10 min,取上清,用BCA法蛋白定量后,取80 μg总蛋白在5%浓缩胶和10%的分离胶中电泳后,转膜2 h。用脱脂奶粉封闭1 h,一抗〔AR 和 PCNA(1∶3000)、α 微管蛋白(1∶5000)〕4℃摇床孵育过夜,二抗〔AR(1∶5000)、PCNA(1:10 000)〕室温摇床孵育2 h,用ECL化学发光检测试剂盒显色,并通过凝胶成像仪拍照,用Image-Pro Plus 6.0软件进行积分吸光度分析,以目的蛋白和内参蛋白条带积分吸光度值的比值表示目的蛋白相对表达水平。
1.9 免疫组织化学法检测睾丸组织中AR和PCNA蛋白表达
将睾丸组织切片55℃烘烤后脱蜡、复水,用柠檬酸盐修复液进行抗原修复,3% H2O2去除内源性过氧化物酶,用1% BSA 37℃封闭1 h,一抗〔AR(1∶200)、PCNA(1∶4000)〕4℃孵育过夜,二抗(1∶200)室温孵育40 min,用DAB显色试剂盒显色,在显微镜下观察信号强弱,3~5 min左右停止显色。经苏木素染核、分化、反蓝、脱水后,用树胶封片,用数字切片扫描仪拍照,随机选取8个视野,用Image-Pro Plus 6.0软件进行光密度分析,以平均光密度值表示目的蛋白的相对表达水平。
1.10 统计学分析
2 结果
2.1 PCB118暴露对小鼠体质量和脏器系数的影响
与溶媒对照组相比,PCB118 50和500 μg·kg-1组体质量增长量及睾丸、附睾、肾和脾系数变化无统计学差异(表2),但PCB118 500 μg·kg-1组肝系数明显下降(P<0.01),提示PCB118对雄鼠造成一定程度的肝损伤。

Tab.1 Primer sequences for real-time quantitative PCR
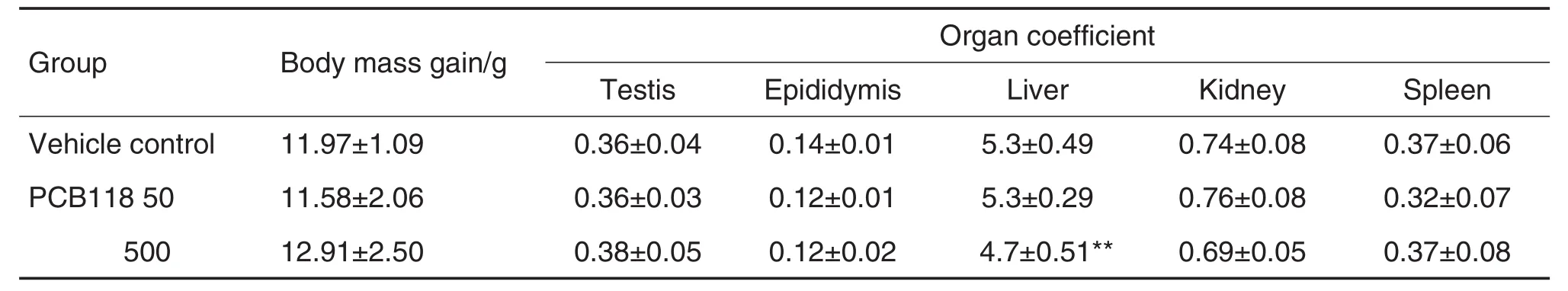
Tab.2 Effect of PCB118 on body mass gain and organ coefficient in male mice
2.2 PCB118暴露对小鼠睾丸病理结构的影响
HE染色结果(图1)显示,与溶媒对照组相比,PCB118 2个剂量组睾丸组织均出现精原细胞缺失和曲细精管空泡化现象。数据统计发现,曲细精管直径、生精上皮细胞厚度和精原细胞相对数目均显著下降(P<0.05,P<0.01)。
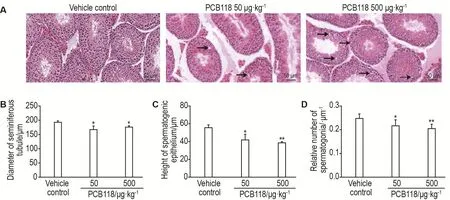
Fig.1 Histological analysis of testis in male mice treated with PCB118 by HE staining(×400).See Tab.2 for the mouse treatment.The arrows in the Fig.A indicate the vacuolation of seminiferous epithelium in seminiferous tubules.Relative number of spermatogonia=number of spermatogonia/the diameter of seminiferous tubules.±s,n=6.*P<0.05,**P<0.01,compared with vehi⁃cle control group.
2.3 PCB118暴露对小鼠精子质量的影响
附睾中精子质量分析结果(表3)发现,与溶媒对照组相比,PCB118 50和500 μg·kg-1组精子数量均显著下降(P<0.05),精子畸形率均显著升高(P<0.05),总精子活力虽然呈现下降趋势,但无统计学差异。
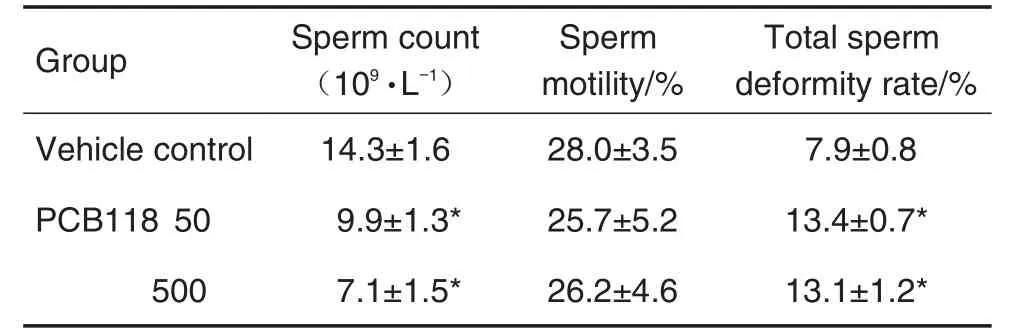
Tab.3 Effect of PCB118 on sperm quality in male mice
2.4 PCB118对血清睾酮水平的影响
血清睾酮水平分析结果发现,与溶媒对照组〔(6.04±2.04)μg·L-1〕相比,PCB118 50和500 μg·kg-1组小鼠血清睾酮水平〔(3.47±0.60)μg·L-1和(2.90±0.55)μg·L-1〕均显著降低(P<0.05)。
2.5 PCB118对睾酮合成相关酶和Ar mRNA水平的影响
与溶媒对照组相比,小鼠睾丸组织中类固醇合成急性调节酶(steroidogenic acute regulatory,Star)、胆固醇侧链裂解酶(cholesterol side-chain cleav⁃age enzyme,Cyp11a1)、3β-羟基类固醇脱氢酶(3beta-hydroxysteroid dehydrogenase,Hsd3b1)、17-20裂解酶(cytochrome P450 17α-hydroxylase/17,20-lyase,Cyp17a1)、17β-羟基类固醇脱氢酶(17beta-hydroxysteroid dehydrogenase,Hsd17b1)5种与睾酮合成相关酶和Ar的mRNA相对表达水平均显著降低(P<0.05)(图2)。
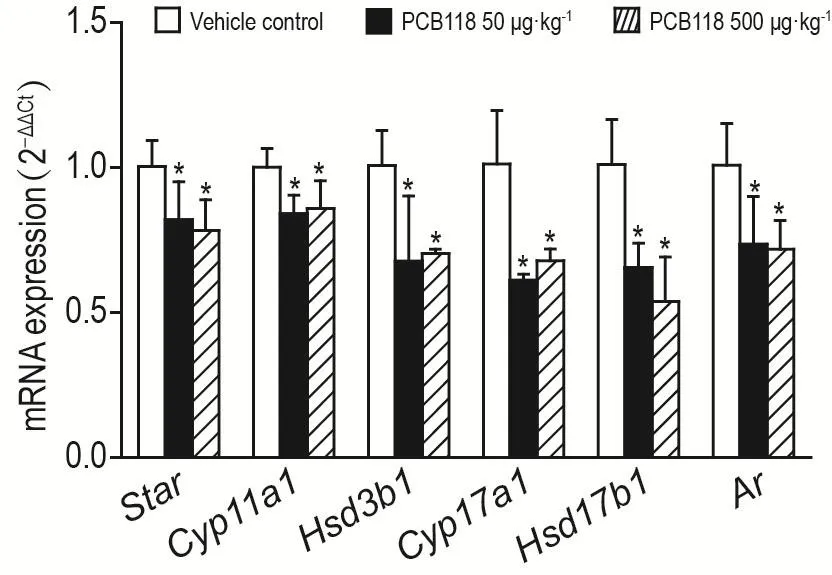
Fig.2 Effect of PCB118 on mRNA levels of testosterone synthesis-related enzymes and Ar in testis.See Tab.2 for the mouse treatment.±s,n=6.*P<0.05,compared with vehicle control group.
2.6 PCB118对睾丸组织AR和PCNA蛋白表达的影响
Western印迹法(图3)和免疫组织化学(图4)检测结果表明,与溶媒对照组相比,PCB118 50和500 μg·kg-1组睾丸组织AR和PCNA蛋白表达水平显著降低(P<0.05,P<0.01)。
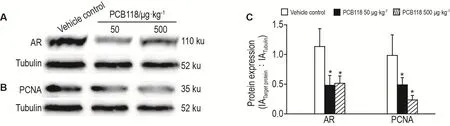
Fig.3 Effect of PCB118 on protein expression of AR and proliferating cell nuclear antigen(PCNA)in testis by Western blotting.See Tab.2 for the mouse treatment.C was the semi-quantitative result of A and B.±s,n=6.*P<0.05,compared with vehicle control group.
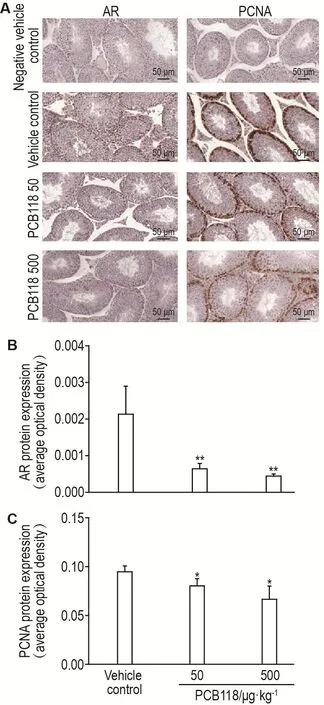
Fig.4 Effect of PCB118 on protein expressions of AR and PCNA in testis by immunohistochemistry.See Tab.2 for the mouse treatment.B and C were the semi-quantita⁃tive results of A.±s,n=6.*P<0.05,**P<0.01,compared with vehi⁃cle control group.
3 讨论
本研究发现,青春期雄鼠暴露于与日常钦食摄入量相当的低剂量PCB118(50~500 μg·kg-1)时,小鼠体质量增长量及睾丸、附睾、肾和脾系数未出现显著变化,表明PCB118对雄鼠的生长发育未造成病理性影响。然而,本研究中PCB118使雄鼠睾丸组织出现精原细胞缺失、曲细精管空泡化、曲细精管直径显著减小、生精上皮厚度明显减小和精原细胞相对数目明显降低的现象,表明青春期低剂量暴露PCB118可对雄鼠睾丸造成损伤。有研究报道,Aroclor 1254混合物500 μg·kg-1造成雄鼠睾丸组织曲细精管中生精细胞间隙增大[25]。在本研究中,同等剂量的PCB118单体也对睾丸组织造成损害,说明PCB118单体对睾丸的毒性作用较强。本研究还发现精子数量显著降低,精子畸形率显著升高,而精子数量的降低可能与精原细胞减少和睾丸空泡化相关。
睾酮作为关键的雄激素对精子发生的起始和维持发挥关键作用[26]。睾酮合成通路中有StAR,CYP11A1,3β-HSD,CYP17A1和17β-HSD等多种酶的参与[27]。其中StAR和CYP11A1是睾酮合成过程中关键的限速酶[28-29]。研究报道,血清或睾丸内睾酮水平的异常降低会引起睾丸萎缩,并伴有生殖细胞数量的减少[30]。成年期雄鼠暴露高剂量PCB会对其睾酮水平及睾酮合成产生影响[31],母鼠哺乳期暴露PCB也会抑制F1代雄鼠睾酮合成[19]。本研究发现,青春期小鼠低剂量暴露PCB118使上述睾酮合成相关酶mRNA表达水平均显著下降,提示血清睾酮水平的下降可能是这些酶的基因表达水平下降所致。
在雄性哺乳动物生殖系统中,睾丸间质细胞合成睾酮。睾酮作用的经典和非经典途径都需要通过AR介导以调控精子发生过程[32]。本研究发现,PCB118 2个剂量组均造成睾丸中AR蛋白表达水平显著降低。睾丸中缺乏AR会对精子发生过程产生损害[33],精母细胞数量明显减少且无法完成减数分裂及形成圆形精子细胞[26,34-35]。本研究发现,PCB118引起血清睾酮水平和AR蛋白表达水平显著降低,从而影响AR介导的睾酮对精子发生过程的调控。
睾丸的生长发育过程实际上也是生精细胞分裂、分化、动态更新的过程,精子发生受细胞增殖与凋亡动态平衡的调节[36]。PCNA蛋白在细胞增殖的启动中起关键作用,参与生精细胞增殖过程中DNA的复制,是评估生殖细胞动力学的重要分子标志物[37]。该蛋白表达水平可评估睾丸生精功能,包括生精细胞的增殖[38]。本研究发现,青春期雄鼠PCB118暴露导致PCNA蛋白表达水平下降,与文献[25]报导的PCB使小鼠睾丸PCNA表达水平下降一致。精子发生过程中,生精细胞的增殖受AR介导的睾酮合成通路的调控[39]。因此,雄鼠PCB118暴露导致睾酮水平降低,影响AR介导的生精细胞的增殖过程,从而引起精子质量下降,并通过影响PCNA进而影响生精细胞DNA的复制。
总之,本研究发现,青春期雄鼠暴露于PCB118后血清睾酮水平下降,精子质量降低,其机制可能与睾酮合成相关酶基因水平下调,AR蛋白和基因表达降低,及PCNA蛋白表达下降有关。PCB118是否影响下丘脑-垂体-性腺轴以及其他与生精细胞增殖相关的信号通路,从而作用于精子发生过程,还需深入研究。

