以腹痛、腹泻起病的成人混合型过敏性紫癜1例并文献复习
刘伟,白云,姜珊珊,黄艳册,王玉珍(通讯作者*)
( 1.华北理工大学研究生院,河北 唐山;2.河北北方学院研究生院,河北 张家口;3.河北省人民医院 消化科,河北 石家庄)
1 临床资料
患者,女,30岁。因“腹痛、腹泻伴呕吐11d”于2019年01月21日入院。患者入院11d前进食火锅后出现全腹持续性绞痛,疼痛剧烈,呈阵发性加重,伴淡红色水样便6-8次/d,伴恶心、呕吐,呕吐物为胃内容物。2019.01.14胃镜(附图1):胃窦弥漫性片状红斑,胃窦溃疡,十二指肠球部溃疡。2019.01.21胃镜(附图2):胃及十二指肠弥漫性点片状红斑,黏膜水肿,伴多发出血性糜烂,胃窦环周溃疡,十二指肠降部浅溃疡。既往体健。入院查体:T37.2 ℃,痛苦面容,心肺查体无异常,腹软,全腹压痛,轻度反跳痛,肠鸣音亢进。辅助检查(2019-01-21):血常规:WBC 13.97 x109/L,N 81.7%,嗜酸性粒细胞百分比 0.1%,HGB:108.00g/L。ESR 27mm/h。CRP 67.11mg/L。PCT 0.08ng/mL。尿潜血1+,尿蛋白:1+。粪便红细胞+/HP, OB 3+。血钾:2.8 mmol/L。白蛋白:26.56g/L。D-二聚体:15.42ng/mL。免疫球蛋白G:4.63g/L。狼疮抗凝物二项、ACCP+抗AKA、抗核抗体谱、抗心磷脂抗体测定、血管炎筛查1号、抗双链DNA测定、抗核抗体测定、抗磷脂酶A2受体抗体、血清免疫固定电泳均为阴性。给予抗感染、抑酸、活血、保护胃肠黏膜等治疗,患者病情无缓解。2019.01.24胃镜(附图3):胃窦环周溃疡、十二指肠降部环周溃疡、胃壁及十二指肠多发红斑,较前减轻。胃窦及十二指肠降部咬检病理(附图4):慢性炎症,活动期,伴炎性坏死。2019.01.24腹部CT(附图5):胃壁及左上腹部分空肠肠壁增厚并相应系膜增厚模糊。腹盆腔积液。2019.01.25碳14呼气试验示阳性。考虑过敏性紫癜可能性大,加用钙剂、西替利嗪片、维生素C及地塞米松(5mg 1/日)治疗,患者症状较前稍好转。2019.01.29患者双下肢、足部出现散在大片对称性分布粟米大小红色瘀斑,轻度高出皮面,压之不褪色,(附图6)。多学科会诊诊断为过敏性紫癜(混合型),加用甲泼尼龙琥珀酸钠80mg 1/日,免疫球蛋白20g 1/日静点,5d,及沙利度胺 25mg 3/日治疗,后患者症状缓解,皮肤紫癜消退。2019-02-12胃镜(附图7):可见红斑消失,十二指肠降部溃疡愈合,胃窦溃疡较前减轻。期间多次查尿潜血逐渐加重(1~3+),尿蛋白升高(1~3+),病理管型阳性,24小时尿蛋白定量最高为5.94 g/24h。2019-02-14肾脏穿刺活检病理(附图8):免疫荧光见11个肾小球,IgA(+++)沿系膜区团块状沉积,IgG(-),IgM(-),C3(-),C1q(-),F(-),HBcAg(-),Kappa(-),Lambda(-),刚果红染色(-),HE、PAS、Msson、PASM/Masson染色见49个肾小球,肾小球基底膜空泡变性,系膜细胞和基质中-重度增生,其中1个小细胞性新月体形成,1个肾小球节段性纤维素样坏死,5个肾小球节段性硬化,系膜区嗜复红蛋白沉积。肾小管上皮空泡颗粒变性。肾间质及小动脉无明显病变。符合过敏性紫癜性肾炎。继续应用甲泼尼龙琥珀酸钠80mg 1/日,7d,联合环磷酰胺500mg冲击治疗,后改为甲泼尼龙片60mg 1/日 口服,逐渐减量。半年后随访患者紫癜未复发,近期一次复查胃镜示溃疡愈合,尿潜血阴性,尿蛋白为0.2g/24h。

图1 第1次胃镜(2019-01-14):胃窦、胃角弥漫性点片状红斑,胃窦环周溃疡,十二指肠球部多发散在溃疡
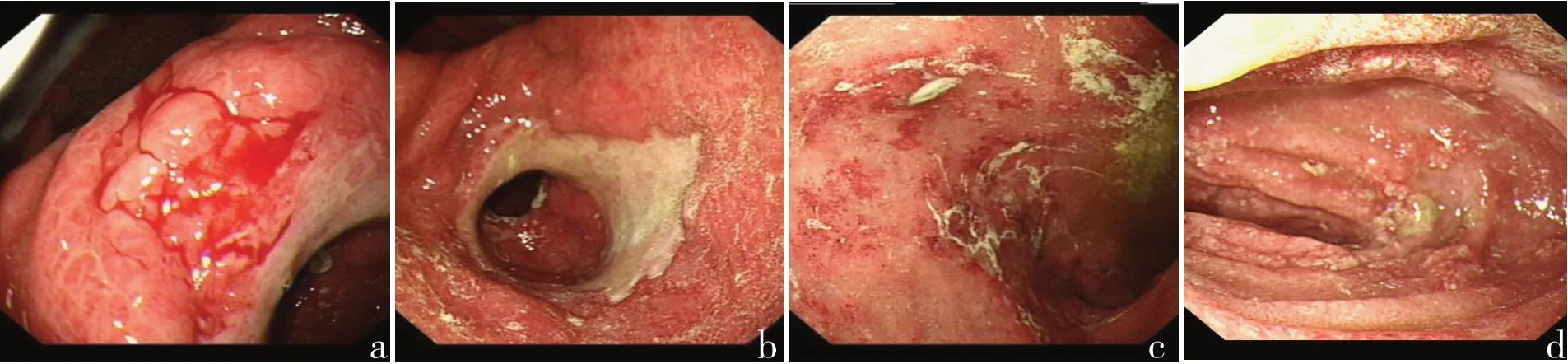
图2 第2次胃镜(2019-01-21):胃及十二指肠弥漫性点片状红斑,黏膜水肿,伴多发出血性糜烂,胃窦环周溃疡,十二指肠降部浅溃疡

图3 第3次胃镜(2019-01-24):可见胃及十二指肠点片状红斑,较前减轻,胃窦、十二指肠降部环周溃疡
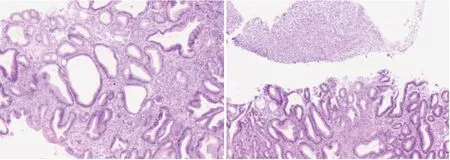
图4 a 可见炎性坏死物,部分腺体增生 b可见炎性坏死物,间质多量中性粒细胞浸润 (a HE×10,b HE×10)
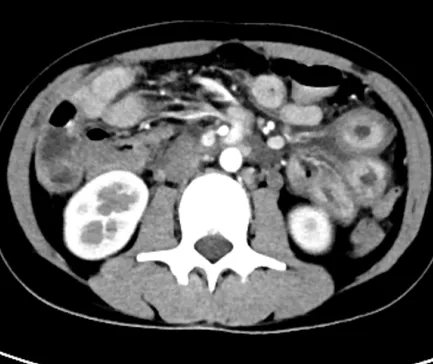
图5 腹部CT 可见小肠肠壁增厚,肠系膜增厚模糊
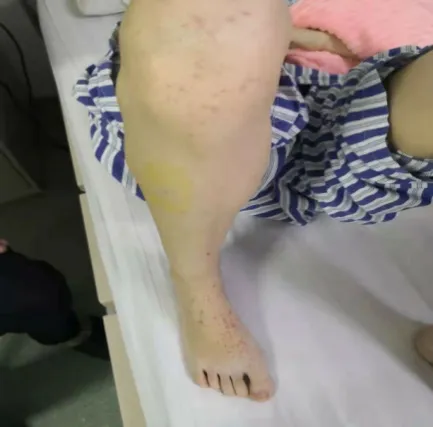
图6 (2019-01-29)患者双下肢、足部出现散在大片对称性分布粟米样红色瘀斑,轻度高出皮面,压之不褪色

图7 第4次胃镜(2019-02-12):可见红斑消失,十二指肠降部溃疡愈合,胃窦溃疡较前减轻
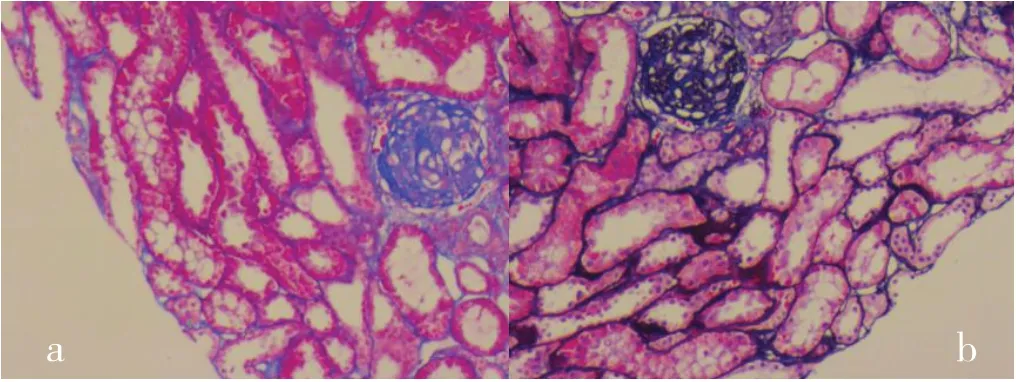
图8 肾脏穿刺病理 可见节段性硬化性肾小球
2 讨论
过敏性紫癜(Henoch-Schonlein purpura,HSP)是以小血管壁IgA为主免疫复合物沉积及白细胞浸润为特征的变态反应性血管炎。感染、药物、遗传、疫苗等为其可能的致病因素[1]。本例患者发病的诱因不除外与进食有关。多种研究显示,幽门螺杆菌(Helicobacter Pylori,HP)感染与HSP的发病相关,且根除HP对HSP治疗有效。Reinauer等曾报道了第一例胃HP感染阳性的HSP患者,经过HP根除治疗后HSP症状消失,10个月后由于再次感染HP而复发,在第二次根除治疗后,临床表现再次消退[2]。Kuang -I Fu等,报道了一例胃粘膜HP阴性腹型HSP患者,试验性行抗HP治疗后,患者HSP症状缓解[3]。可能与根除HP过程中,同时杀灭体内其他致病性微生物有关。HP在消化性溃疡,腺癌和消化道淋巴瘤中起重要作用,这一观点已被广泛接受[4]。另有报道显示HP可引起多种消化外疾病,如血管性疾病,自身免疫性疾病和皮肤病等[5,6]。因此,HP或其他未知微生物的感染可能通过引起机体免疫异常,从而参与HSP的发生发展。本例患者碳14呼气试验阳性,提示HP感染可能为该患者病因之一。
HSP内镜下可表现为胃肠黏膜呈紫癜样改变、糜烂及溃疡,多为孤立性出血性红斑,微隆起,病灶间可见相对正常黏膜。十二指肠降段为最常见受累部位,其次为回肠[7]。溃疡多呈环形,考虑与胃肠道血管呈环形走行有关。本例患者内镜下表现为胃、十二指肠弥漫性点片状红斑,黏膜水肿,出血性糜烂,多发环形溃疡,与上述内镜下特点相符合。上述消化道损伤病理生理是基于胃肠道小血管免疫性病变,引起血管壁纤维素样坏死,管腔缩小,周围大量炎症细胞浸润,导致胃肠道黏膜血流障碍,黏膜糜烂、出血, 甚至溃疡形成,及小血管通透性和脆性增加, 黏膜出现渗出性充血、水肿。组织学上表现为白细胞碎裂性血管炎。出现固有层纤维蛋白沉积与红细胞淤积,可提示该病[8]。
临床HSP消化道受累可出现腹痛,恶心,呕吐,黑便和便血,严重者可出现肠套叠,梗阻或穿孔。少数病例报道,可合并胰腺炎、肠瘘、蛋白丢失性胃肠病、缺血坏死性胆管炎等[7]。本例患者以剧烈腹痛、恶心呕吐为主要症状,伴有发热、炎症指标增高,且典型的紫癜性皮疹晚于消化道症状20天出现,未能早期与感染性坏死性小肠炎、缺血性肠病等疾病相鉴别,增加了临床诊治的难度。
轻症HSP患者以对症支持治疗为主,重症者应早期应用皮质类固醇激素,病情仍未控制者,可加用免疫抑制剂、丙种球蛋白,甚至血浆置换治疗[9]。但考虑到激素应用可能增加消化道出血、穿孔等风险,并对于严重腹痛或发生肠套叠、肠穿孔的患者可以掩盖病情恶化迹象,故疾病确诊之前激素的延迟应用,也可能成为延误诊治的另一原因。研究显示,尿蛋白水平、肾小球硬化和肾小管萎缩/间质纤维化是肾脏预后的独立预测因子[10]。另外,新月体形成比例可影响肾脏表现及治疗反应,而与终末期肾病风险的增加及肾功能恶化无关[11]。治疗的最佳目标可能是控制尿蛋白<0.4g/24h[10]。此患者应用激素治疗15天后内镜下表现明显好转,应用激素半年后,胃镜下表现恢复正常,尿潜血转阴,尿蛋白明显下降至0.2g/24h。目前该患者仍在激素维持治疗中,远期预后仍需随诊观察。
综上,皮肤紫癜性皮疹晚于其他系统症状的过敏性紫癜,是一种临床症状及组织病理学缺乏特异性表现的疾病,易误诊和漏诊。HSP内镜下表现或可作为临床早期诊断依据之一。该疾病预后与病情严重程度及早期治疗密切相关,应提高对该病认识,以期早期诊断、早期治疗。

