NEDD8和PD-L1在人脑胶质瘤组织中的表达及临床意义
张恒威,王新军,付旭东,周少龙,杨卓,张旭阳,曾凡涛,刘婉清
(郑州大学第五附属医院 神经外科,河南 郑州)
0 引言
脑胶质瘤是中枢神经系统中最常见的肿瘤,发病率高、死亡率高[1]。目前胶质瘤的发病机制尚不明确,临床上胶质瘤患者的治疗效果并不理想[2]。神经前体细胞表达下调因子 8(neural precursor cell-expressed developmentally down regulated 8,NEDD8)是机体内一种具有重要功能有类泛素蛋白。NEDD8通过一系列酶促反应后可与底物蛋白共价结合,调节底物蛋白生物性质,这一过程称之为Neddylation[3]。大量研究证实,NEDD8的过表达与人类多种恶性肿瘤的发生、发展有关,如多发性骨髓瘤、结肠癌、肺癌、乳腺癌和黑色素瘤等[4]。程序性死亡配体1(programmed death-ligand 1, PD-L1)是位于人染色体9q24的跨膜蛋白,是B细胞、T细胞及单核细胞表面程序性死亡分子1(programmed death-1 PD1)的配体[5]。已有研究表明,PD-L1在多种恶性肿瘤中高表达,并通过激活PD1/PD-L1信号通路减弱机体免疫细胞的致死率,使恶性肿瘤细胞躲过机体免疫系统的监控和杀伤,从而增进肿瘤的发生和发展,如肺癌、肝癌、乳腺癌等[6]。目前关于NEDD8和PD-L1在脑胶质瘤组织中表达情况的报道不多,对于二者在脑胶质瘤组织中的表达是否存在相关性的探索更少。本研究旨在通过对NEDD8和PD-L1在80例不同级别胶质瘤组织标本及30例减压脑组织标本中的表达情况的分析,进一步的揭示,NEDD8和PD-L1在胶质瘤的发生、发展中所起的作用。
1 资料与方法
1.1 一般资料
回顾性收集2015年01月01日至2018年03月01日在郑州大学第五附属医院神经外科接受手术治疗的80位胶质瘤患者的石蜡标本。纳入标准:①初发病例且首次手术治疗;②手术治疗前未接受放射性疗、化疗及免疫治疗;③所有标本均经病理学确诊为胶质瘤,且患者临床资料完整。排除标准:①患者或患者家属拒绝参与研究;②各种原因导致的患者胶质瘤标本丢失。80位患者中男 46例,女 34 例;中位年龄 40(17~78)岁,其中<40岁29例,≥40岁51例;患者术前头颅MRI显示:21例肿瘤位于枕叶,22例位于颞叶,37例位于额叶;80例胶质瘤组织标本,参照2007版世界卫生组织中枢神经系统肿瘤分类系统,星型胶质细胞瘤33例,少突胶质细胞瘤25例,胶母细胞瘤22例。低级别胶质瘤(1ow grade gliomas,LOG)27例,高 级 别 胶 质 瘤(high grade gliomas,HGG)53例。另选取同期因颅脑损伤于该院行“去骨瓣减压术”的30位患者的减压脑组织作为对照。标本取得后置于-800C冰箱冷冻保存。本研究经郑州大学第五附属医院医学伦理委员会批准,患者或其家属知情同意。
1.2 主要试剂和仪器
NEDD8兔单克隆抗体购于北京索莱宝科技有限公司(货号BS-10222R)、兔多克隆抗体购于北京中杉金桥生物技术有限公司(货号PV-900);PD-L1兔单克隆抗体购于Cell Signaling公司(货号13684T)、兔多克隆抗体CMTM6购于Abcam公司(货号ab198284),二氨基联苯胺(DAB)显色液、NC膜等实验试剂均购于武汉赛维尔生物有限公司。
1.3 免疫组织化学法检测胶质瘤组织及对照脑组织NEDD8和PD-L1表达
取手术切除对照脑组织常规制作石蜡标本。胶质瘤石蜡标本与对照脑组织石蜡标本5μm厚连续切片。切片贴敷于经过防脱剂处理过的载玻片上,滴加NEDD8和PD-L1单克隆抗体,4℃孵育过夜;PBS洗涤,滴加多克隆抗体;室温孵育30min后再次使用PBS冲洗,然后滴加辣根过氧化物酶标记的链霉素卵白素工作液;室温下再次孵育30min后加二氨基联苯胺显色液显色,冲洗后苏木素复染,采用梯度乙醇脱水,二甲苯透明,最后中性树胶封片。用PBS液染色替换一抗,做阴性对照切片。切片制作全部完成后,置于显微镜下观察。在常规显微镜视野(×200)下,选择每张切片免疫应答最典型区域,并在高倍视野(×400)中随机观察5个非重复视野。计数 NEDD8和PD-L1染色细胞及视野中全部细胞数。其中阳性细胞百分比≤25%为1分,>25%~50%为2分,>50%~75%为3分,>75%为4分;根据染色程度评分:阴性者0分,淡黄色者1分,黄色或棕黄色者2分,褐色者3分。最后以两者评分的总和为最终评分,2~6分为阳性,否则为阴性。
1.4 Western Blot检测胶质瘤组织NEDD8和PD-L1表达
取冰冻组织 300 mg切碎,置于匀浆器中以充分裂解组织中的NEDD8和PD-L1,以Western Blot标准操作步骤进行,检测出NEDD8和PD-L1表达量。实验重复3次。
1.5 统计学方法
所有数据分析由SPSS 22.0软件完成。计量资料用平均数±标准偏差)表示。NEDD8和PD-L1在试验组与对照组脑组织中阳性表达率采用χ2检验比较;两独立样本t检验用于比较不同病理级别胶质瘤NEDD8和PD-L1表达;采用χ2检验或Fisher精确概率法分析试验组NEDD8和PD-L1表达与患者年龄、性别、胶质瘤病理类型、胶质瘤位置、胶质瘤直径、胶质瘤病理级别的关系;利用列联系数分析试验组胶质瘤组织中 NEDD8和PD-L1表达的关联性。检验水准均为a=0.05。
2 结果
2.1 免疫组织化学法检测NEDD8和PD-L1的表达
NEDD8在细胞质和细胞核中都有表达,显微镜下观察,阳性细胞染色呈淡黄色至棕褐色不等。PD-L1表达于细胞质和细胞膜,显微镜下观察,阳性细胞染色亦是呈淡黄色至棕褐色不等。试验组NEDD8和PD-L1阳性表达率分别为85.00%,78.75%,对照组NEDD8和PD-L1阳性表达率分别为30.00%,13.33%,由此可见NEDD8和PD-L1在胶质瘤组织中的表达明显高于在对照脑组织中的表达(P均<0.001),如图1、表1。

表1 NEDD8和PD-L1在对照脑组织和胶质瘤组织中的表达情况
2.2 Western Blot检测NEDD8和PD-L1表达
如图2、表2所示,HGG组NEDD8和PD-L1表达水平高于LOG组的表达水平(P均<0.001)。
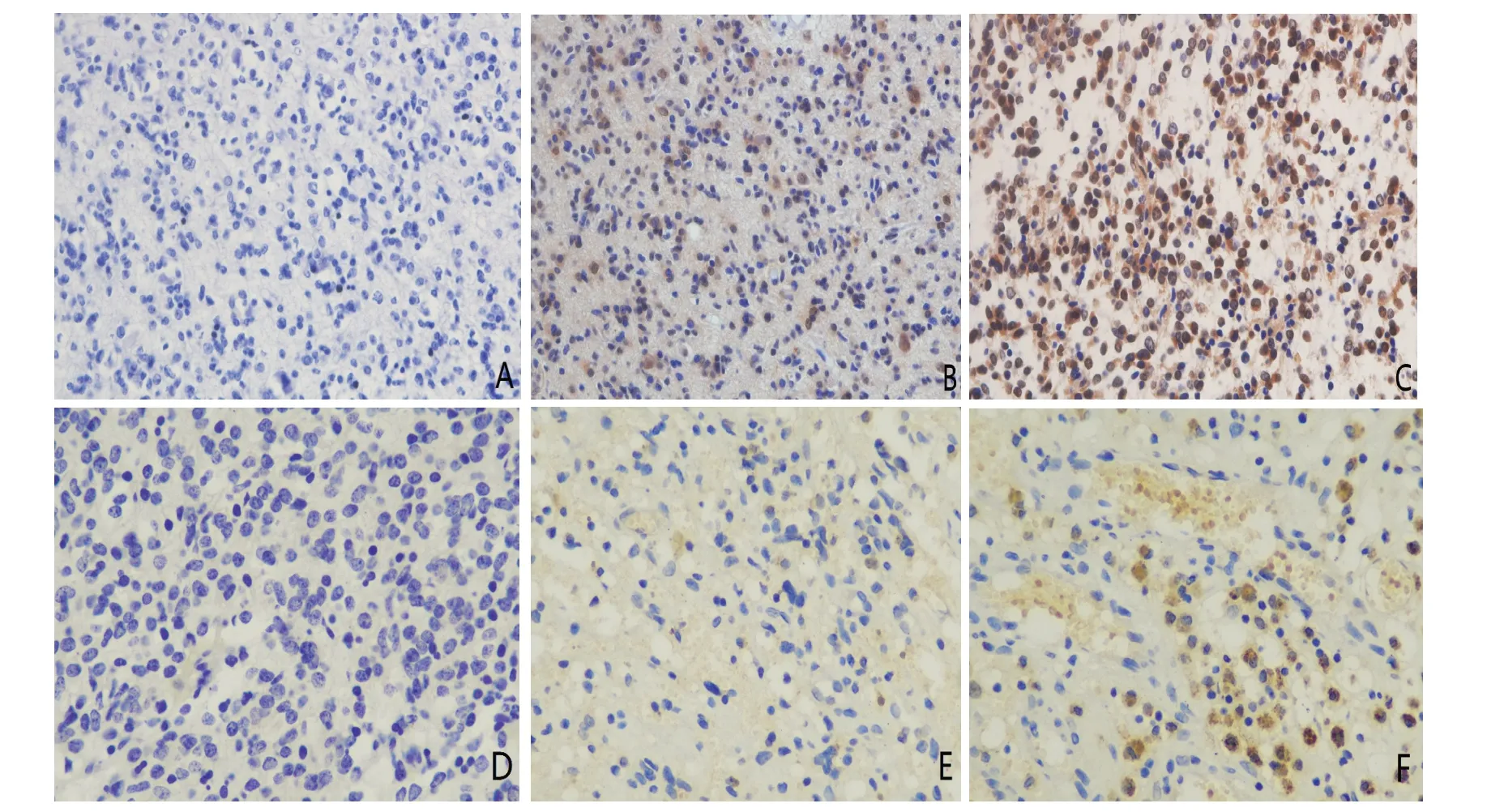
图1 不同病理级别胶质瘤组织和对照脑组织中NEDD8和PD-L1 的表达(SP,×400)A: 对照脑组织NEDD8表达; B:低级别胶质瘤NEDD8表达; C:高级别胶质瘤NEDD8表达; D: 对照脑组织PD-L1表达; E:低级别胶质瘤PD-L1表达; F: 高级别胶质瘤PD-L1表达
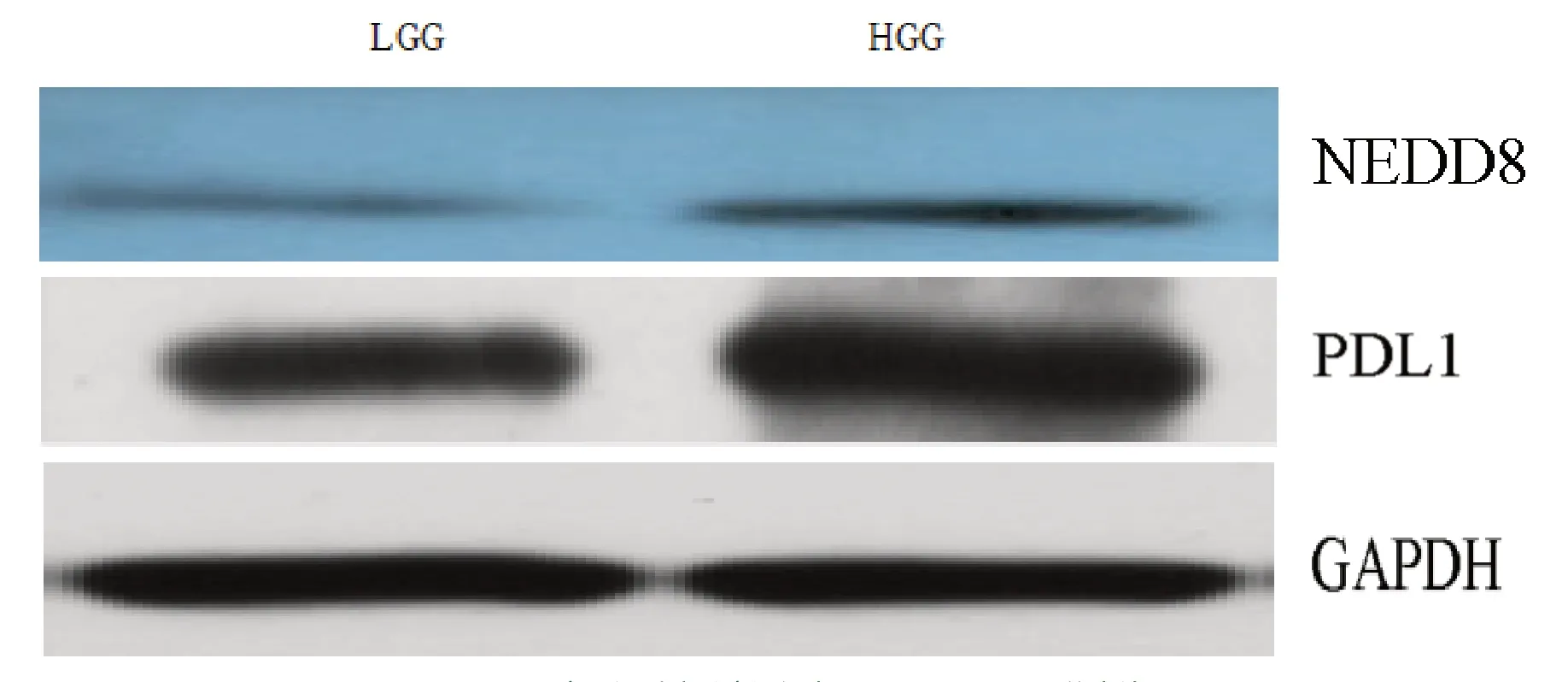
图2 不同病理级别胶质瘤组织中NEDD8和PD-L1的表达

表2不同病理级别胶质瘤组织中 NEDD8和PD-L1 表达水平
2.3 试验组胶质瘤组织中NEDD8和PD-L1的表达与相关临床因素的关系
经过分析,试验组胶质瘤组织中NEDD8和PD-L1的表达与胶质瘤病理级别、肿瘤直径有关系(P均<0.05),而与病人年龄,性别,肿瘤部位,肿瘤细胞类型均无关系(P均>0.05)。随着胶质瘤病理级别升高、肿瘤直径增大,NEDD8和PD-L1的阳性表达率均增高(P均<0.05),如表3所示。
2.4 试验组胶质瘤组织中 NEDD8和PD-L1表达水平的关联性
试验组胶质瘤组织中NEDD8表达水平与 PD-L1 表达水平呈正相关,如表4所示。
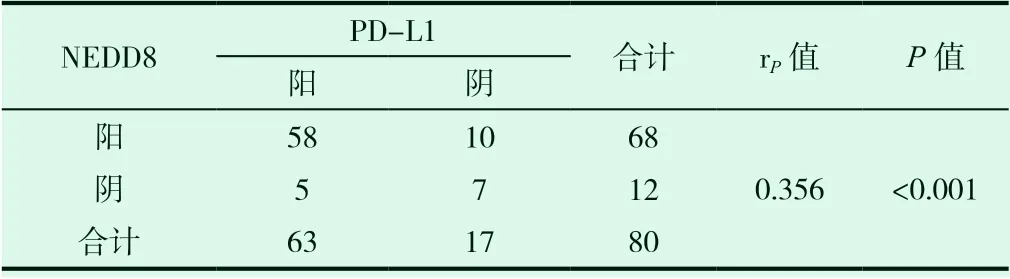
表4 试验组胶质瘤组织中NEDD8和PD-L1 表达水平的关联性分析
3 讨论
胶质瘤是神经胶质细胞恶性肿瘤,具有高组织学异质性和组织侵袭性等特征,胶质瘤多数发展为弥漫性肿瘤,广泛浸润脑实质,严重影响患者脑功能,最终危及患者生命[7]。目前胶质瘤的治疗选择有限,对新诊断的胶质瘤常行最大安全范围的手术切除,辅以放疗、化疗。由于胶质瘤浸润能力强,常无法完全清除,致使肿瘤极易复发,患者最终预后较差,尤以胶质母细胞瘤预后最差,中位生存时间为12-15个月,5年生存率仅为5%[8]。NEDD8和PD-L1可能作为重要因素协同参与胶质瘤的发生、发展。
类泛素蛋白(Ubiquitin-like proteins,UBLs)是机体内一类有重要功能的蛋白质,具有与泛素类似的序列和空间结构。泛素及类泛素蛋白参与的翻译后修饰过程,几乎贯穿于细胞内的所有调控途径[9]。神经前体细胞表达下调因子 8(NEDD8)是由81个氨基酸编码的类泛素蛋白,是目前研究发现的与泛素最近似的蛋白[10]。正常细胞生理过程中,NEDD8的主要功能是保持蛋白质的稳定性、增强或者减弱其特异性底物蛋白的活性和参与转录的调节等[11]。研究表明,NEDD8的底物中包含多种肿瘤相关蛋白、抑癌因子、调控基因表达过程的转录因子,如p53、鼠双微体基因(murine double mimute2,MDM2)、希佩尔林道基因(Von Hippel-l indau,VHL)和 Cullin 家 族(Cul-lin-Ring E3 ligases,CRLs)等,NEDD8过表达会造成肝癌、乳腺癌、肺癌等的发生、发展[12]。
近几年,关于肿瘤细胞如何引起免疫逃逸的相关机制研究,取得了很多突破性的进展,其中PD-1/PD-L1途径是众多成果中研究相对较深的机制之一[13]。PD-L1由机体CD274基因编码,是程序性死亡分子1(programmed death-1 PD1)的配体。生理情况下PD-L1 与 PD-1 结合后,PD-1向机体免疫系统递送抑制性信号,调节淋巴细胞的功能,防治自身淋巴细胞攻击自身抗原,避免自身免疫性疾病的发生[14]。肿瘤细胞高表达PD-L1,通过激活此通路,抑制T淋巴细胞增殖,促进调节性T细胞( regulatory T cell,Treg)的生成,进而达到抑制机体免疫系统的目的[15~16]。目前Treg细胞在肿瘤组织中所起的作用很受关注,有研究报道Treg细胞可以导致免疫抑制、免疫无功能,进而促进多种癌细胞的生长和转移[17]。
本研究表明,NEDD8和PD-L1在试验组胶质瘤组织中高表达,随着胶质瘤病理级别升高、肿瘤直径的增大表达上调更明显,且试验组胶质瘤组织NEDD8表达水平与 PD-L1 表达水平呈正相关。由此我们猜测NEDD8和PD-L1高表达协同促进胶质瘤的恶变以及向周围侵袭性生长,NEDD8和PD-L1可能作为重要的因素参与胶质瘤的发生、发展,二者有可能成为衡量胶质瘤恶性程度的蛋白标志物。大量研究报道揭示,NEDD8活化酶E1 有希望成为抗肿瘤药物的新靶点,其中MLN4924作为 NEDD8 修饰的特异性抑制剂,已在临床上证实可以抑制结肠癌、肺癌、多发性骨髓癌等多种肿瘤细胞的恶性生长[18]。同样以PD-L1为靶点的靶向药物,已在临床上开始应用,且已经证实对肾癌、宫颈癌、非小细胞癌患者有效[19]。目前我们研究团队已经证实[20],动物及体外实验中,通过减少NEDD8和PD-L1的表达,能有效的抑制胶质瘤细胞的生长、增殖,协同使用NEDD8和PD-L1抑制剂,胶质瘤受抑制效果更加显著。临床上能否通过抑制NEDD8和PD-L1高表达,使胶质瘤患者预后得到良好改善,需要进一步的探索。
综上所述,此次研究主要探讨了NEDD8和PD-L1在胶质瘤中的表达情况及与相关临床因素的关系,未涉及NEDD8和PD-L1影响胶质瘤发生、发展的具体机制,后续会做进一步探索加以阐明。下一步将首先从NEDD8和PD-L1对胶质瘤患者预后的影响着手开始新的研究,更深层次的发掘NEDD8和PD-L1的临床应用价值。

