棉铃虫葡萄糖氧化酶HaGOX在毕赤酵母中的重组表达和性质研究
张艳丽, 任柳, 张宇宏, 张伟
(1.中国农业科学院生物技术研究所, 北京100081;2.南昌大学食品学院, 南昌330047;3.哈尔滨师范大学生命科学与技术学院, 哈尔滨 150025)
葡萄糖氧化酶(glucose oxidase,GOX,EC 1.1.3.4)是一种需氧脱氢酶,可在有氧条件下专一性地将β-D-葡萄糖氧化为葡萄糖酸和过氧化氢[1-2]。GOX能够除氧、产酸、杀菌、去除葡萄糖,在食品加工、医疗诊断、饲料添加剂、化工等行业具有广泛应用[3-6]。黑曲霉和青霉等真菌是GOX的主要生产菌株[7-8],动植物体内GOX含量很低且提取受限[9]。昆虫GOX在与植物互作中起着非常重要的作用[10]。Musser等[11-12]发现GOX可以抑制烟草中昆虫取食所诱导的烟碱含量,还能调控番茄中胰蛋白酶抑制素的表达水平[13],对植物叶表面的昆虫病原体起到抗菌抑制作用[14]。
棉铃虫(Helicoverpaarmigera)是我国主要的广食性农业害虫,主要危害棉花、烟草、番茄、小麦和玉米等农作物[15]。Eichenseer等[16]研究表明,美洲棉铃虫(Helicoverpazea)唾液中的主要成分GOX能够抑制烟草叶片烟碱对其的诱导作用,其催化反应的产物H2O2和葡萄糖酸也有相同的作用。Hu等[17]研究表明,葡萄糖可以诱导棉铃虫下唇腺GOX活性的升高。棉铃虫GOX具有较大的应用潜力,为了更深入研究其特性以及实际应用生产,需要获得大量GOX蛋白,但来源于昆虫的GOX含量较低且提取极其困难,因此,通过微生物细胞工厂异源高效表达棉铃虫GOX蛋白具有重要的意义。
毕赤酵母(Pichiapastoris)表达系统是一种常用于异源蛋白生产的微生物细胞工厂,其具有甲醇诱导型强启动子AOX1,遗传背景清楚,适合高密度发酵,能够进行蛋白质翻译后修饰等优点[18-19]。近年来已有研究者使用P.pastoris表达系统对丝状真菌来源的GOX成功进行了异源表达,但棉铃虫来源GOX的异源表达尚未见报道。本研究首次成功在毕赤酵母中异源表达了棉铃虫来源的GOX,并对其基本酶学性质进行了分析,为棉铃虫GOX作用机理解析和实际应用奠定了技术基础,也为开发利用其它昆虫来源的GOX提供了范例。
1 材料与方法
1.1 试验材料
1.1.1棉铃虫、菌株与质粒 2龄期棉铃虫及人工饲料购自中国科学院动物研究所生物农药中试基地科云生物农药技术研发中心;毕赤酵母GS115菌株和pPICZαA质粒为美国Invitrogen公司产品;毕赤酵母GS115H菌株为GS115的衍生菌株,包含his4基因,由本实验室构建和保存;大肠杆菌E.coliTrans1-T1感受态细胞购自北京全式金生物技术有限公司。
1.1.2试剂与仪器 反转录试剂盒5×All-In-One RT MasterMix,加拿大ABM公司;PCR相关试剂,北京全式金生物技术有限公司;限制性内切酶(EcoRⅠ、NotⅠ、PmeⅠ)、TRIzol试剂、Zeocin和T4连接酶,美国Thermo公司;内切β-N-乙酰氨基葡糖苷酶-H(Endo-H),New England Biolabs公司;琼脂糖凝胶回收试剂盒和质粒提取试剂盒,天根生化科技有限公司;辣根过氧化物酶和邻联茴香胺,Ameresco公司;其他常规化学试剂均为国产分析纯。
立式高速离心机,日本HITACHI公司;PCR仪和基因电转仪,Bio-Rad公司;UV-2800型紫外可见分光光度计,尤尼柯(上海)仪器有限公司; AKTA purifier和HiTrap CaptoQ,美国GE Healthcare公司。
1.1.3培养基 大肠杆菌培养和转化用LB培养基。酵母培养用YPD培养基,酵母转化以及酶蛋白的诱导产生用YPDZ、BMGY及BMMY等培养基,重组葡萄糖氧化酶转化子筛选用MM平板显色培养基[20]。
①YPDZ培养基:葡萄糖20 g·L-1、蛋白胨20 g·L-1、酵母提取物10 g·L-1、琼脂糖17 g·L-1,自然pH,115 ℃高压灭菌30 min;待温度下降至60℃以下,加入Zeocin抗生素(Zeocin浓度为300 μg·mL-1)。
②10×酵母无氨基氮源(YNB):134 g·L-1YNB,0.22 μm滤膜过滤灭菌。
③500×生物素:0.2 g·L-1生物素,0.22 μm滤膜过滤灭菌。
④PTM1微量盐:0.6% CuSO4、0.008% NaI2、0.3% MnSO4、0.02% Na2MoO4、0.002% H3BO4、0.05% CoCl2、2% ZnCl2、6.5% FeSO4、0.5% H2SO4(体积分数)。
⑤酵母发酵盐基础培养基:0.5% KH2PO4、5% NH4H2PO4、1.485% MgSO4·7H2O、1.82% K2SO4、0.093% CaSO4、0.15% KOH,1×生物素、0.44% PTM1微量盐、2%甘油(体积分数)。
⑥酵母发酵盐诱导培养基:0.5% KH2PO4、5% NH4H2PO4、1.485% MgSO4·7H2O、1.82% K2SO4、0.093% CaSO4、0.15% KOH,1×生物素、0.44% PTM1微量盐,1%甲醇(体积分数)。
1.2 试验方法
1.2.1棉铃虫葡萄糖氧化酶基因hagox克隆
2龄期棉铃虫使用人工饲料(含或不含1%葡萄糖)喂养,每3 d为一个龄期,分别收集4龄期、5龄期、6龄期和蛾期的各10条棉铃虫,用液氮研磨,加入TRIzol试剂提取RNA。以棉铃虫各龄期的RNA为模板,用5×All-In-One RT MasterMix反转录试剂盒进行反转录,获得棉铃虫各龄期的cDNA第一链。
参考NCBI数据库中棉铃虫葡萄糖氧化酶基因(GenBank登录号EU629216)序列设计扩增引物HaGOX-F(5’-CCGGAATTCATGATTCTGGCG-CAGCAAGATTG-3’)和HaGOX-R(5’-TTGCGG-CCGCCTATTGCCAGGTCTGTTTG-3’)(下划线部分分别为EcoRⅠ、NotⅠ酶切位点)。以棉铃虫各龄期cDNA为模板进行PCR扩增。PCR反应体系:5×TransStart FastPfu Buffer 10 μL、dNTPs 1.6 μL、FastPfu 0.5 μL、上下游引物各2.5 μL、cDNA 0.5 μL、超纯水32.4 μL。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃终延伸10 min。PCR反应产物用1%琼脂糖凝胶电泳分析鉴定,并用琼脂糖凝胶回收试剂盒回收PCR产物。
1.2.2重组表达载体pPICZαA/HaGOX的构建及基因序列分析 使用EcoRⅠ、NotⅠ将PCR回收产物和pPICZαA载体酶切,酶切产物用琼脂糖凝胶回收试剂盒回收纯化,T4 DNA连接酶构建重组质粒pPICZαA/HaGOX,转化E.coliTrans1-T1感受态细胞,用具有Zeocin抗性的LB平板筛选,获得含有棉铃虫葡萄糖氧化酶基因hagox的重组大肠杆菌。对重组大肠杆菌的质粒进行PCR鉴定,并委托生工生物工程(上海)有限公司进行测序。测序结果使用Nucleotide Blast(http://www.ncbi.nlm.nih.gov/BLAST/)比对。收集研究较多的真菌和昆虫来源的葡萄糖氧化酶和本研究克隆得到的棉铃虫葡萄糖氧化酶氨基酸序列,使用MEGA6软件Neighbor-joining方法构建系统进化树。使用VectorNTI软件预测蛋白的等电点和分子量,使用SignalIP 4.1 Server(http://www.cbs.dtu.dk/services/SignalIP/)预测信号肽,NetOGlyc 4.0 Server(http://www.cbs.dtu.dk/services/NetOGlyc/)预测O-糖基化位点。
1.2.3重组表达载体pPICZαA/HaGOX转化酵母及诱导表达 从重组大肠杆菌中提取质粒pPICZαA/HaGOX,经PmeI酶切线性化后用异丙醇沉淀回收。取8 μg线性化的pPICZαA/HaGOX质粒通过电击法转化毕赤酵母GS115H菌株,涂布YPDZ(Zeocin浓度300 μg·mL-1)固体平板,28 ℃恒温倒置培养至转化子长出。挑取转化子于YPD及MM固体平板上,28 ℃恒温倒置培养36 h,MM平板用于显色筛选阳性转化子,YPD平板用于保存菌株。
通过BMGY/BMMY方法高通量筛选得到酶活力较高的转化子:挑取阳性转化子接种于含有500 μL BMGY培养基的48孔平板中,28 ℃、200 r·min-1培养36 h;4 000 r·min-1常温离心10 min后弃除培养基,菌体用500 μL BMMY培养基重悬,28 ℃、200 r·min-1诱导培养72 h,每隔24 h按1%添加量补加甲醇;诱导结束后,4 000 r·min-1常温离心10 min,收集上清酶液测定葡萄糖氧化酶活力。
酶活力较高的多个转化子通过摇瓶培养进一步筛选:挑取转化子接种于含有10 mL BMGY培养基的40 mL离心管中,28 ℃、200 r·min-1培养36 h;6 000 r·min-1常温离心5 min收集菌体,用5 mL BMMY培养基重悬菌体,28 ℃、200 r·min-1诱导培养72 h,每隔24 h按1%添加量补加甲醇;诱导结束后,4 ℃、6 000 r·min-1离心5 min,收集上清酶液测定葡萄糖氧化酶活力。
将酶活力最高的转化子用发酵基础盐培养基诱导获得粗酶液:将活化好的阳性菌株菌液按1%接种量接种于200 mL YPD培养基中,28 ℃、200 r·min-1培养36 h;离心收集菌体,用200 mL酵母发酵盐基础培养基重悬菌体,28 ℃、200 r·min-1培养24 h;4 ℃、6 000 r·min-1离心5 min,离心收集菌体,用50 mL酵母发酵盐诱导培养基重悬菌体,28 ℃、200 r·min-1诱导培养72 h,每隔12 h补加终浓度为0.5%的甲醇;诱导结束后,离心收集上清即为粗酶液,用于后期分析。
1.2.4重组HaGOX蛋白的纯化 HaGOX粗酶液使用10 kD超滤膜包进行脱盐和浓缩,所得超滤浓缩液使用阴离子交换层析法进行纯化。缓冲液分别为:A液20 mmol·L-1的NaH2PO4-Na2HPO4缓冲液(pH 7.5);B液20 mmol·L-1的NaH2PO4-Na2HPO4缓冲液(pH 7.5)中加入终浓度为0.5 mol·L-1的NaCl。用25 mL的A液平衡CaptoQ(5 mL)层析柱,加入粗酶液,然后用B液进行梯度洗脱:先用25 mL的10%B液洗脱杂蛋白,再用20%的B液洗脱目的蛋白,收集20% B液洗脱组分即为纯化后的酶液。纯化的HaGOX蛋白进行聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。
1.2.5酶蛋白浓度测定 采用Bradford法(Bio-Rad)测定蛋白浓度:以牛血清蛋白(BSA)作为标准品绘制标准曲线,配置BSA母液10 mg·mL-1,稀释到0.05~0.5 mg·mL-1。取不同浓度的的BSA溶液40 μL于酶标板中,加入5倍稀释的蛋白染液160 μL混匀,静置30 min后利用酶标仪测定595 nm处吸光值。以吸光值为横坐标,BSA浓度为纵坐标制作标准曲线。取纯化后的HaGOX酶液40 μL,加入5倍稀释的蛋白染液160 μL混匀,静置30 min后测定595 nm处吸光值,根据标准曲线计算得到样品蛋白浓度。
1.2.6葡萄糖氧化酶活力的测定 在反应管中加入2.5 mL邻联茴香胺缓冲液(0.1 mL的1%邻联茴香胺甲醇储存液加入到12 mL的pH 6.0 NaH2PO4-Na2HPO4缓冲液中配制而成),0.3 mL的18%葡萄糖溶液,0.1 mL辣根过氧化物酶溶液(浓度90 U·mL-1),30 ℃保温2 min后,加入葡萄糖氧化酶溶液0.1 mL,反应3 min后,加入2 mL的2 mol·L-1H2SO4溶液终止反应,测量540 nm处的吸光值。葡萄糖氧化酶活力单位(U)定义为30 ℃、pH 6.0条件下,每分钟催化1 μmoL β-D-葡萄糖生成葡萄糖酸和过氧化氢所需的酶量。比活力定义为每毫克蛋白质所具有的酶活力数,U·mg-1。
1.2.7重组HaGOX酶学性质测定 配制不同 pH 的缓冲液:Na2HPO4-柠檬酸缓冲液(pH 3.0、4.0、5.0、5.5、6.0、6.5、7.0、7.5、8.0)、甘氨酸-氢氧化钠缓冲液(pH 8.5、9.0、9.5)。用不同pH的缓冲液配制邻联茴香胺缓冲溶液,按照前述方法测定HaGOX样品酶活力,每个样品测定三个平行,相对酶活力最高点所对应缓冲液的pH即为重组HaGOX的最适反应pH。将HaGOX酶样品置于不同pH的缓冲液中,37 ℃保温1 h,然后在最适pH反应体系中测定残余酶活力,以不经pH缓冲液处理的酶的活力设为100%,绘制酶的pH稳定性曲线。
HaGOX酶分别在30、35、40、45、50、55、60 ℃下反应测定酶活力,相对酶活力最高点所对应的温度即为HaGOX的最适反应温度。将HaGOX酶在45 ℃下分别保温15、30、45、60 min,50 ℃下分别保温5、10、15、30、45、60 min,55 ℃下分别保温5、10、15 min,然后测定热处理后样品的残余酶活力,以不经热处理的酶的活力设为100%,绘制酶的热稳定性曲线。
在酶促反应体系中加入不同的金属离子(Zn2+、Li+、Mn2+、K+、Ca2+、Mg2+、Cd2+、Cu2+、Co2+、Ni2+)、金属离子螯合剂EDTA、CTAB和SDS,终浓度为1 mmol·L-1或5 mmol·L-1。以未加上述化学试剂测得的酶活力计为100%。
配制0.1 mol·L-1的D-葡萄糖、6-脱氧-葡萄糖、2-脱氧-葡萄糖、D-半乳糖、D-果糖、L-鼠李糖、α-乳糖、蔗糖、D-山梨糖、D-纤维二糖,将其分别作为底物测定酶活力,以D-葡萄糖作为底物所测定的酶活力计为100%。
2 结果与分析
2.1 重组HaGOX酵母表达载体的构建及hagox基因分析
以HaGOX-F/HaGOX-R为引物,5龄期和蛾期的cDNA为模板,均扩增到了约2.0 kb的DNA片段。PCR产物连接pPICZαA获得了重组载体pPICZαA/HaGOX。
测序结果显示,hagox基因序列全长1 821 bp,预测可编码606个氨基酸和一个终止密码子。SignalIP 4.1预测HaGOX重组蛋白无信号肽,VectorNTI软件预测该蛋白等电点为pH 4.78,分子量大小66.9 kD。NetOGlyc 4.0 Server预测该蛋白有3个潜在的O-糖基化位点(195 S,205 T和408 S)。Blast比对显示其DNA序列与NCBI数据库中公布的Helicoverpaarmigera来源的葡萄糖氧化酶基因(GenBank登录号EU629216)相似性达97.75%,氨基酸序列(GenBank登录号ACC94296.1)相似性达99.67%(图1)。

图1 真菌和昆虫部分GOX系统进化树Fig.1 Phylogenetic tree of the GOX from fungus and insects
2.2 重组葡萄糖氧化酶HaGOX的表达分析
线性化pPICZαA/HaGOX重组质粒电击转化毕赤酵母GS115H菌株后,转化子在MM培养基上显色(图2),结果表明,HaGOX在毕赤酵母中成功实现了异源表达。经高通量筛选及摇瓶水平筛选得到酶活最高转化子,然后用发酵基础盐培养基诱导培养得到粗酶液,经浓缩后用阴离子交换柱纯化得到HaGOX纯蛋白。SDS-PAGE分析结果表明,目的蛋白条带在70 kD左右,理论大小应为66.9 kD,可能是由于糖基化导致。经Endo H处理,得到的蛋白条带与理论大小相符(图3),比活力为13.63 U·mg-1,可以进行后续酶学性质的分析。
注:“C”为空白对照GS115H菌株。Note:“C”in the plate is GS115H as control.图2 平板显色筛选阳性重组子Fig.2 Screening positive recombinants by coloring plate
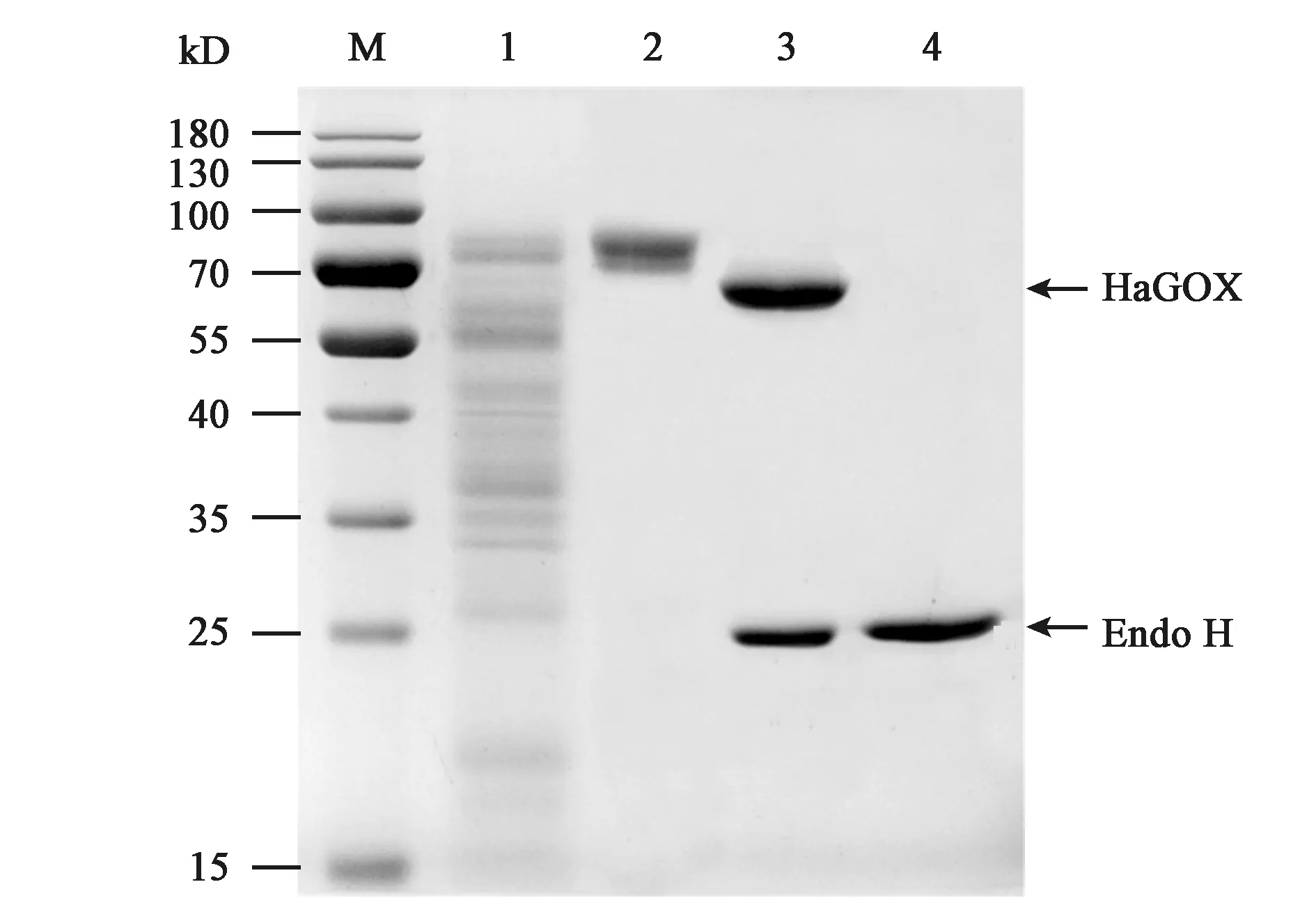
注:M—蛋白分子量Marker;1—HaGOX粗酶液;2—HaGOX纯化蛋白;3—Endo H糖基化处理后的HaGOX纯化蛋白;4—Endo H。Note: M—Protein molecular mass markers; 1—Crude enzyme of HaGOX; 2—Purified HaGOX protein; 3—HaGOX deglycosylated by Endo-H; 4—Endo-H.图3 HaGOX蛋白SDS-PAGE分析Fig.3 SDS-PAGE electrophoresis of the HaGOX
2.3 HaGOX酶学性质分析
2.3.1温度和pH对酶活的影响 酶的反应速率与温度呈指数相关,温度每升高10 ℃,酶反应速度就会加倍。大多数酶在40~70 ℃温度范围内会因高温变性而失活,酶只有在最适温度下才能发挥出最大的活性。重组HaGOX的最适温度为40 ℃,当温度高于45 ℃时,随着温度的升高,酶活力下降迅速,当温度为60 ℃时,该酶完全失活(图4A)。分别在45、50、55 ℃下测定其热稳定性,45 ℃处理1 h后酶活力残留率高于60%,50 ℃下处理10 min后酶活力残留率为40%左右,处理1 h后酶活力残留率低于10%,而55 ℃处理10 min后酶活力完全丧失(图4B)。
酶活性取决于活性位点中氨基酸的电离状态,因此pH在维持酶蛋白的构象稳定中起着至关重要的作用。HaGOX的最适pH为6.0~7.0,在pH 5.0~7.5之间酶活力能够保持在80%以上(图4C)。37 ℃、不同pH条件下处理酶液1 h得到pH稳定性曲线,HaGOX在pH5.0~8.5之间基本稳定,酶活力保持在80%以上,经pH 4.0处理后酶活力完全丧失,经pH 9.0处理后酶活力仍能保持在70%以上(图4D)。
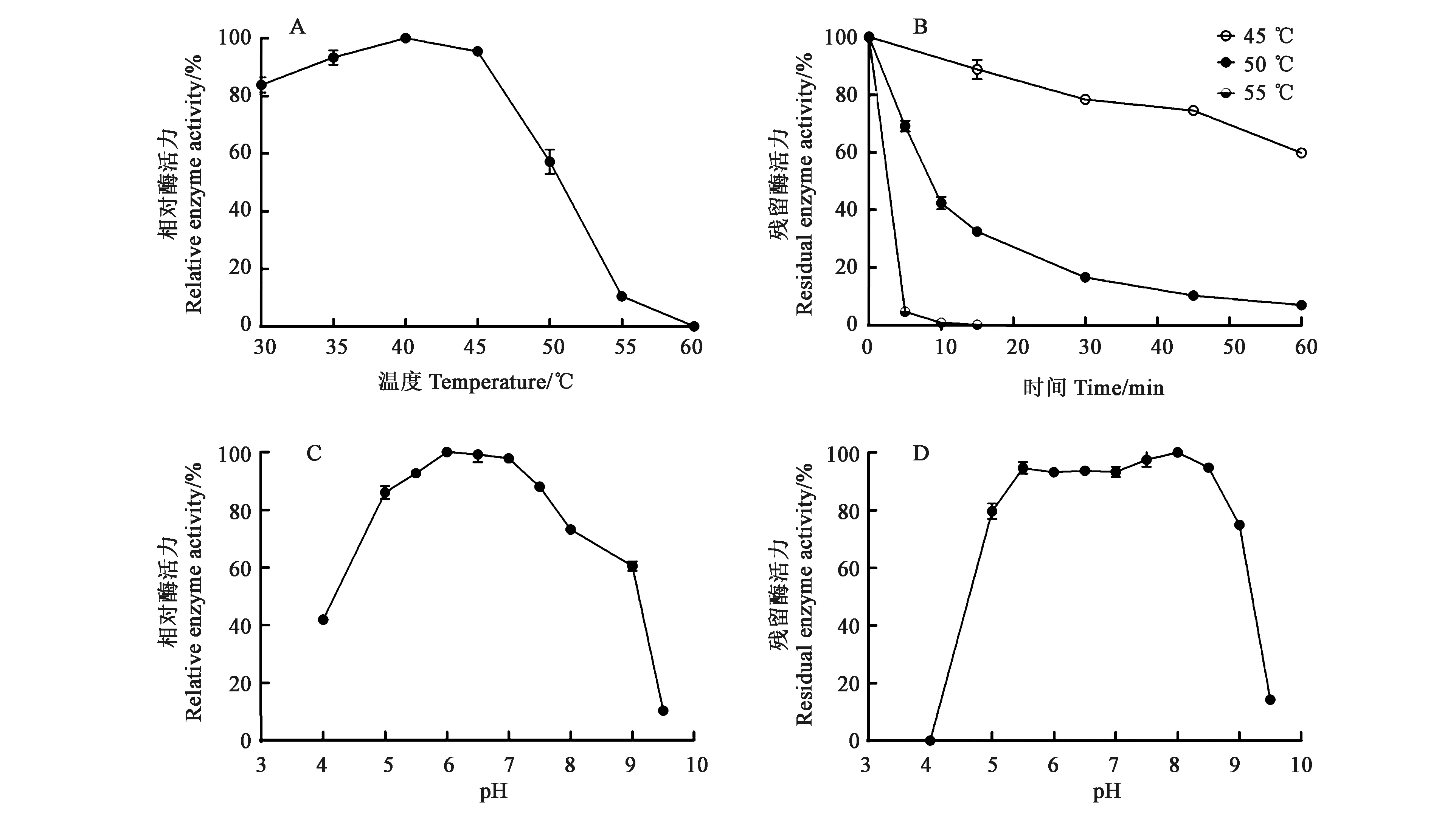
A:HaGOX最适温度;B:HaGOX温度稳定性;C:HaGOX最适pH;D:HaGOX pH稳定性。A: Optimal temperature of HaGOX; B: Thermo stability of HaGOX;C: Optimal pH of HaGOX; D: pH stability of HaGOX.图4 温度和pH对HaGOX活力的影响Fig.4 Effect of temperature and pH on the HaGOX activity
2.3.2金属离子及化学试剂对HaGOX酶活力的影响 研究了不同浓度下各金属离子及化学试剂对HaGOX酶活力的影响,从图5可以看出,1 mmol·L-1CTAB存在下酶活力残留约82%,5 mmol·L-1CTAB存在下酶活力残留率降至60%;1 mmol·L-1SDS存在下酶活力丧失一半,而5 mmol·L-1SDS存在下HaGOX酶活力基本完全丧失。CTAB和SDS对HaGOX重组酶的活力有非常明显的抑制作用(P<0.05)。5 mmol·L-1的Mn2+对HaGOX重组酶活力有明显的促进作用(P<0.05),其余金属离子及化学试剂在1和5 mmol·L-1浓度下对HaGOX均没有明显影响。
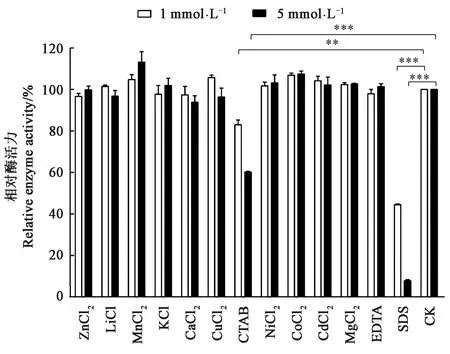
注:*、**和*** 分别表示不同组的差异在P<0.05、P<0.01和P<0.001水平具有统计学意义。Note:*, ** and *** indicate significant differences among different treatments at P<0.05, P<0.01 and P<0.001 levels, respectively.图5 金属离子及化学试剂对HaGOX酶活性的影响Fig.5 Effect of metal ions and chemical reagents on HaGOX
2.3.3HaGOX的底物特异性分析 选取常见的单糖、二糖作为底物,测定HaGOX酶活力。从表1可以看出,6-脱氧-葡萄糖为HaGOX的最适底物,D-葡萄糖次之,HaGOX对L-鼠李糖和D-纤维二糖有微弱的催化作用,但无法计算出具体的酶活力。而HaGOX对2-脱氧-葡萄糖、D-半乳糖、D-果糖、α-乳糖、蔗糖、D-山梨糖无催化活性。
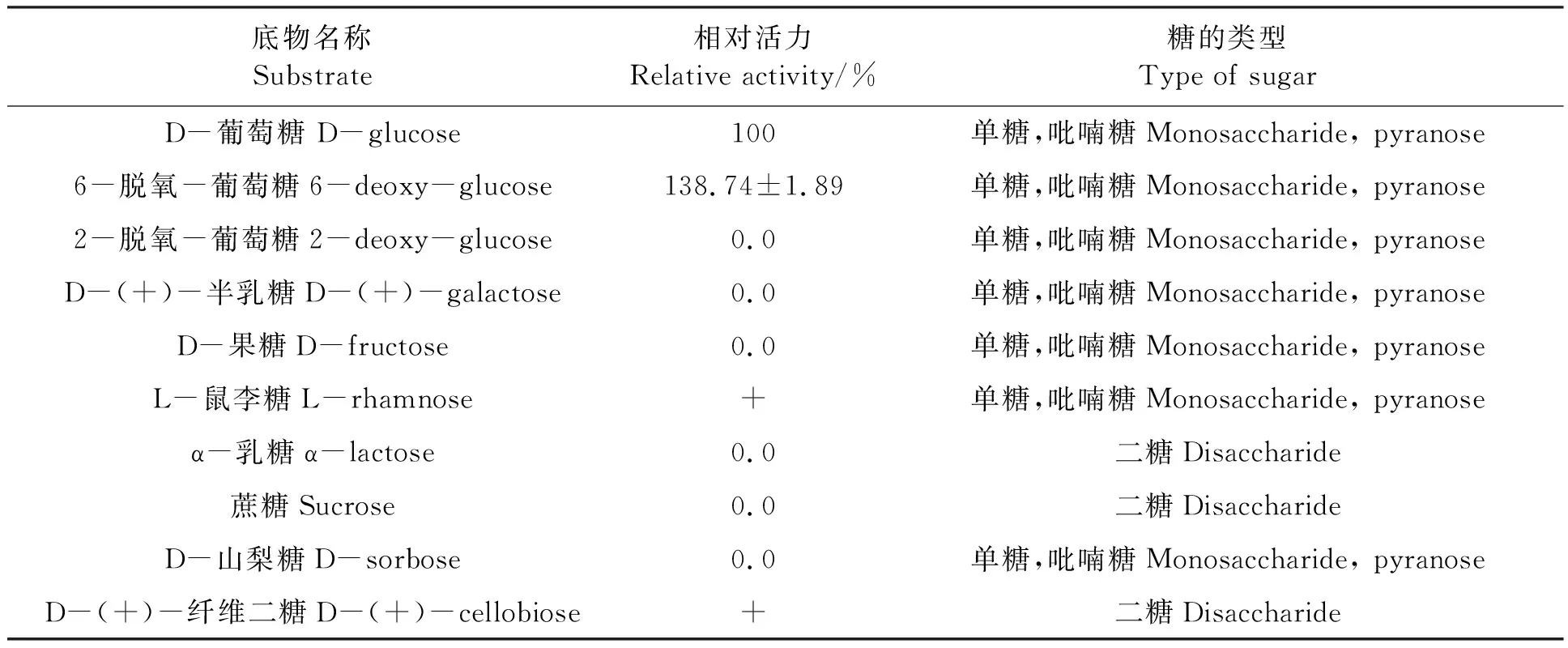
表1 HaGOX底物特异性Table 1 Subsrate specificity of HaGOX
3 讨论
Tang等[21]研究发现,人工饲料喂养的5龄期棉铃虫唇腺GOX活性比取食植物叶片要高,还发现葡萄糖能够诱导GOX活性的显著提高。本研究选取2龄期棉铃虫开始人工喂养,分别收集4龄期、5龄期、6龄期、蛾期的棉铃虫作为后续实验研究的样本。同时,在3龄期向4龄期棉铃虫的成长过程中作了两份对照,一份为人工饲料喂养,另一份为饲料(含1%葡萄糖)喂养,以验证葡萄糖能否诱导GOX的提前表达。结果不同饲喂方式下4龄期棉铃虫均未克隆到hagox基因,而在5龄期和蛾期成功克隆到了目的基因,这一结果表明,葡萄糖未能成功诱导棉铃虫GOX的提前表达。
本研究利用毕赤酵母表达系统获得了重组HaGOX蛋白,并对重组HaGOX进行了酶学性质研究。重组HaGOX蛋白最适作用pH为6.0~7.0,在pH 5.0~8.5之间基本稳定,最适作用温度40℃,最适底物为6-脱氧-葡萄糖。Eichenseer 等[16]提取美洲棉铃虫体内GOX蛋白进行酶学性质研究,本研究结果与其一致,这说明重组HaGOX并未改变棉铃虫天然GOX的酶学性质,后期可以使用本研究建立的表达系统大量生产重组HaGOX,进而进行更深入的分析。与其他真菌来源的GOX相比[22],HaGOX蛋白耐碱性更强,这将进一步拓宽HaGOX在不同领域的应用。
昆虫GOX的研究比较有限,Eichenseer 等[16]在成虫棉铃虫表皮中检测到GOX活性,幼虫中未检测到GOX活性,研究人员推测GOX可能会影响昆虫骨化过程中蛋白质的交联,还有待进一步证实。昆虫GOX多被报道可以抑制植物防御,但Tian等[23]却发现昆虫GOX能够诱发番茄防御反应,初步判断GOX可能不是直接作用于茉莉酸(JA)上游信号因子诱导JA途径,并且与水杨酸(SA)途径无关,具体作用机制还需进一步研究。
本研究成功实现了棉铃虫HaGOX在毕赤酵母中的异源分泌表达,且易于分离纯化,重组HaGOX蛋白酶学性质与天然蛋白一致。本研究结果将有力推进棉铃虫GOX在侵染寄主植物过程中的作用机制研究,并有助于深入了解植物防御棉铃虫的相关信号转导途径,进而为开拓新的棉铃虫防治策略提供新思路。

