miR-71通过IL-23/Th17信号通路对人胃早癌肿瘤浸润免疫细胞的影响
易静 龚锦文 赵静 詹云凯 段志刚 吕婧
江西省九江市第一人民医院消化内科(江西九江332000)
胃癌作为我国发病率第一位的消化系统恶性肿瘤,胃早癌以其除消化不良外无症状和特异性表现、服用抑酸药可以缓解症状和病灶小不易发现为特点,临床上早期不易被发现而延误治疗[1-3]。目前的诊断方法以内镜为主,肿瘤标志物为辅[4]。肿瘤中浸润的免疫细胞水平与肿瘤的发生、发展和预后积极相关[5]。IL-23是具有促炎作用的细胞因子,在分子空间构型上IL-23 与JAK-2激酶比邻,可与Th17 相互作用促进效应细胞分化成熟并使其增生活化,导致器官特异性炎症反应[6-7]。miR-71 以其广泛参与生物学调控、在各种肿瘤中表达均异常等特点已然成为肿瘤分子靶向治疗的研究热点,目前关于胃早癌的报道主要集中在内镜和蓝激光成像等治疗手段方面[8-9],对于miR-71表达对胃早癌患者的影响研究缺乏系统报道。本研究分析血清miR-71表达表达通过IL-23/Th17信号通路对人胃早癌肿瘤浸润免疫细胞的影响,以期为胃癌临床治疗和提前预防提供新的研究靶点。
1 对象与方法
1.1 研究对象抽取2017年3月至2019年3月于我院就诊的60例胃早癌为胃癌组,另于我院随机抽取同期健康体检者60例为对照组。胃癌组和对照组组基本概况见表1。纳入标准:(1)经病理学活检确诊为浅表性胃癌;(2)肿瘤侵及胃壁肌层,但大小不超过1/2者;(3)未进行放疗和化疗;排除标准:(1)心、肝、肾等器官功能严重障碍;(2)淋巴结转移及远处转移[10]。本研究符合伦理学证明,所有参与研究的受试对象均同意并签署知情同意书。

表1 胃癌组和对照组基本概况Tab.1 Basic overview of the gastric cancer group and the control group例
1.2 主要仪器和试剂快速总RNA 提取试剂盒(Sigma,RNB100-50RXN)、NanoDrop 2000仪器(Thermo Scientific)、PrimeScript RT 试剂盒(Takara Bio,RR047A)、SYBR-Green Premix Ex Taq(Takara Bio,DRR081A)、Anti-JAK2 antibody(abcam,ab-108596)、Anti-IL-23R antibody(abcam,ab45420)、Anti-CD8 antibody(abcam,ab4055)、Anti-CD68 antibody(abcam,ab125212)、Image-iTTMFixative Solution(Thermo Fisher,FB002)、PRISM 7900 序列检测系统(Applied Biosystems)、高通量测序仪(Life Technologies)
1.3 研究方法采用荧光定量PCR实验测定血清中miR-71的mRNA表达,以U6 作为内参,miR-71的引物设计见表2。采用HE 染色法检测人胃早癌肿瘤免疫细胞浸润情况及并依据浸润情况分级。采用免疫组化法检测人胃早癌巨噬细胞和CD8+T细胞的浸润情况。采用Western Blot和蛋白免疫组化染色法检测miR-71表达对IL-23/Th17信号通路的影响。
免疫组化:将手术石蜡切片中仍能见到癌组织患者的标本进行免疫组化检测,防脱片处理后行4 μm 厚度切片,65℃烤片过夜,然后将切片组织置于二甲苯及酒精中,常规脱蜡至水,采用梓檬酸缓冲液高温高压抗原修复法进行组织抗原修复,H2O2孵育后每张切片滴加60 μL 一抗,PBS 清洗后每张切片滴加60 μL 二抗,PBS 漂洗后滴加60 μL DBS,复染后封固。
Western Blot:收集组织蛋白提取后进行蛋白浓度的测定,灌胶跑电泳后切胶转模,封闭1~2 h,加入抗体孵育过夜,弃一抗后孵育二抗,最后显影选择蛋白条带。
荧光定量PCR:釆用SYBR-Green Premix Ex Taq 试剂盒检测组织中miR-71的mRNA表达,在Bio-Rad 上实时定量PCR 仪上完成扩增,釆用溶解曲线和琼脂糖电泳分析扩增产物特异性,每份样本重复检测3次。

表2 miR-71 引物设计Tab.2 miR-71 primer design
1.4 统计学方法采用t检验和χ2检验实现两组间比较,P<0.05为差异有统计学意义,数据均用SPSS 22.0进行统计分析。
2 结果
2.1 miR-71 mRNA表达水平由图1可知,胃癌早期患者(胃癌组)的miR-71 mRNA表达水平为(1.82 ± 0.17),对照组的miR-71 mRNA表达水平为(5.35 ± 0.41)故相较对照组,胃癌组miR-71 mRNA表达水平极显著下调(P<0.01)。将胃癌组按照TEM 分期分为Ⅰ期和Ⅱ期,TEMⅠ期的miR-71 mRNA表达水平为(2.52 ± 0.33),TEMⅡ期的miR-71 mRNA表达水平为(1.63±0.21),TEMⅠ期和TEMⅡ期的miR-71 mRNA表达水平较对照组均下调(P<0.01)。
2.2 人胃早癌肿瘤免疫细胞浸润情况及分级由图2可知,通过光镜观察发现,癌巢周边的免疫细胞的数目最多,远超癌巢内部的免疫细胞和远处免疫细胞的数目;形态呈筛状退化的癌巢以及散在凋亡肿瘤细胞附近的浸润免疫细胞数目远超形态上充满肿瘤细胞退化严重的癌巢。由图3可知,以无免疫细胞浸润、少量免疫细胞浸润、较多免疫细胞浸润和大量免疫细胞浸润为依据,将免疫细胞的浸润深度分为T1~T4 级,发现不同浸润深度患者T1为5例,T2为26例,T3为23例,T4为6例。

图1 miR-71的mRNA表达水平Fig.1 mRNA expression level of miR-71

图2 人胃早癌肿瘤免疫细胞浸润情况Fig.2 Infiltration of immune cells in human gastric early cancer
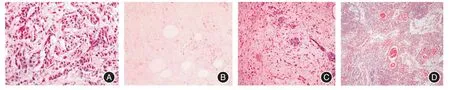
图3 人胃早癌肿瘤免疫细胞浸润深度分级Fig.3 Invasion depth grading of human gastric early cancer tumors
2.3 免疫细胞不同浸润深度患者血清miR-71的相对含量由图4可知,胃早癌患者免疫细胞浸润深度T1 级的miR-71 mRNA表达水平为(2.52 ±0.23),胃早癌患者免疫细胞浸润深度T2 级的miR-71 mRNA表达水平为(2.01±0.35),胃早癌患者免疫细胞浸润深度T3 级的miR-71 mRNA表达水平为(1.81±0.29),胃早癌患者免疫细胞浸润深度T4级的miR-71 mRNA表达水平为(1.56 ± 0.26),相较于T4 级的miR-71 mRNA表达量,T1 级的miR-71 mRNA表达水平极显著上调(P<0.01),T2 级的miR-71 mRNA表达水平显著上调(P<0.05)。
2.4 胃早癌巨噬细胞和CD8+ T细胞浸润情况由图5可知,癌巢内部的CD8+T细胞数目最少,其次为远离癌巢的CD8+T细胞,而CD8+T细胞最富集的部位仍是癌巢周边。癌巢内部的巨噬细胞数目最少,其次为远离癌巢的巨噬细胞,而巨噬细胞最富集的部位仍是癌巢周边。

图4 不同浸润深度患者血清miR-71的相对含量Fig.4 Relative levels of serum miR-71 in patients with different infiltration depth
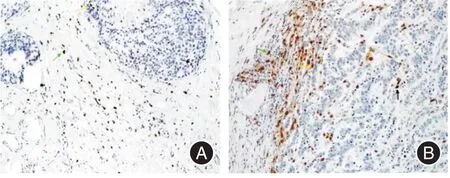
图5 胃癌患者巨噬细胞和CD8+ T细胞浸润情况Fig.5 Infiltration of macrophages and CD8+ T cells in gastric cancer patients
2.5 miR-71表达对IL-23/Th17信号通路的影响由图6可知,采用免疫组织化学染色法检测胃癌患者的JAK-2和IL-23R表达,TEMⅠ期组和TEMⅡ期组JAK-2蛋白表达水平相较对照组上调;TEMⅠ期组和TEMⅡ期组IL-23R蛋白表达水平相较对照组上调。由图7和图8可知,TEMⅠ期组和TEMⅡ期组JAK-2蛋白表达水平相较对照组明显上调(P<0.01),TEMⅠ期组和TEMⅡ期组JAK-2蛋白表达水平差异无统计学意义(P>0.05);TEMⅠ期组和TEMⅡ期组IL-23R蛋白表达水平相较对照组上调(P<0.01),TEMⅠ期组和TEMⅡ期组IL-23R蛋白表达水平差异无统计学意义(P>0.05)。

注:A、D,对照组组;B、E,TEMⅠ期;C、F,TEMⅡ期

图7 miR-71表达对IL-23/Th17信号通路的影响Fig.7 Effect of miR-71 expression on IL-23/Th17 signaling pathway
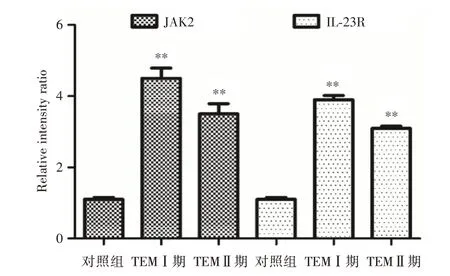
图8 miR-71表达对IL-23/Th17信号通路的影响Fig.8 Effect of miR-71 expression on IL-23/Th17 signaling pathway
3 讨论
本研究以胃早癌患者作为研究对象,研究了患者血清miR-71表达通过IL-23/Th17信号通路对人胃早癌肿瘤浸润免疫细胞的影响。采用荧光定量PCR实验测定血清中miR-71的mRNA表达,发现miR-71的mRNA表达相较对照组组极显著下调(P<0.01),且TEMⅠ期和TEMⅡ期的miR-71 mRNA表达水平较对照组组均极显著下调(P<0.01)。采用HE 染色法检测人胃早癌肿瘤免疫细胞浸润情况及并依据浸润情况分级,结果发现在癌巢中央、癌巢周边和远离癌巢处均可见肿瘤免疫细胞分布,且癌巢周边的免疫细胞的数目最多,远超癌巢内部的免疫细胞和远处免疫细胞的数目,形态呈筛状退化的癌巢以及散在凋亡肿瘤细胞附近的浸润免疫细胞数目远超形态上充满肿瘤细胞退化严重的癌巢。跟据免疫细胞不同浸润深度(无免疫细胞浸润、少量免疫细胞浸润、较多免疫细胞浸润和大量免疫细胞浸润)分为T1~T4 级,发现胃癌患者的miR-71 血清表达水平与免疫细胞浸润分级呈负相关趋势。采用免疫组化法检测人胃早癌巨噬细胞和CD8+T细胞的浸润情况,发现CD8+T细胞和巨噬细胞的分布也为为癌内,癌周、和远处;癌巢内部的巨噬细胞和CD8+T细胞数目最少,其次为远离癌巢的巨噬细胞和CD8+T细胞,而巨噬细胞和CD8+T细胞最富集的部位仍是癌巢周边。最后采用Western Blot和蛋白免疫组化染色法检测miR-71表达对IL-23/Th17信号通路的影响,结果发现Western Blot的结果和蛋白免疫组化染色法的结果一致,均显示TEMⅠ期组和TEMⅡ期组JAK-2和IL-23R蛋白表达水平相较对照组组极显著上调(P<0.01),TEMⅠ期组和TEMⅡ期组JAK-2和IL-23R蛋白表达水平无明显差异(P>0.05),说明miR-71表达对人胃早癌肿瘤浸润免疫细胞的影响与激活IL-23/Th17信号通路有关。
胃早癌的临床上特异性表现为粘膜上皮可见白色不透光物质、微血管扩张,早癌的在临床在采取内镜分型可以分为为隆起型Ⅰ型、浅表型Ⅱ型(a、b、c)和凹陷型Ⅲ型[11-12]。BRASACCHIO 等[13]研究发现胃癌的临床不良表现与p300/CBP 相关蛋白(PCAF)表达下调有相关,并且是侵袭性和侵袭性肿瘤的潜在生物标志物。PCAF 主要以PCF/ADA3 调节的内源途径为中心的促凋亡机制可以影响从恶变前到恶变的进展,从而实现对胃癌的抑瘤机制作用。LIN 等[14]研究发现了适合早期胃癌的N 分类系统,这种新型的TNM 分期系统由T1N0、T1N1′[1-6 转移淋巴结(LN)]和T1N2′(≥7个转移性LN)组成,具有更好的预测能力,可用于准确预测早期胃癌患者的5年总生存期。ESAKI等[15]研究用于早期胃癌的术后胃(ESD-P)的内窥镜黏膜下剥离术(ESD)发现,对于ESD-P 比ESD-N更耗时,较长的手术时间与缝合线或吻合部位的病变呈显著正相关趋势;然而ESD-P和ESD-N 均可实现高治愈率切除率的治疗,并且早期胃癌治疗的预后不良事件发生率低。即使在术后胃中也可以选择ESD 作为早期胃癌的治疗,只要注意缝合线或吻合部位的病变即可。LUO 等[16]研究微探头内镜超声检查预测早期胃癌侵袭深度的临床效用,经双变量混合效应模型来计算灵敏度与特异性考察发现,微探头内镜超声检查对早期胃癌的浸润深度具有中等诊断能力,亚组分许表明诊断实用程序受到种族的影响。TAKEUCHI 等[17]研究前哨淋巴结(SN)与胃癌的关系发现,SN 盆中的巨噬细胞转移,淋巴侵袭和鉴定的淋巴结数量≥5是胃癌患者中非SN 盆地LN 转移的危险因素。通过CART 分析确定了预测模型发现SN 盆中的巨噬细胞转移和淋巴管侵犯的患者被认为是LN 转移的最高风险。GUO 等[18]研究发现emu-miR-71可能参与原噬菌体的发育,其能够在体外实现与emu-nlk的3′-UTR 结合,编码细胞分裂的关键调节因子,导致荧光素酶活性的显著下调。将emu-miR-71 模拟物转染到原始细胞中可以实现对emu-NLK的抑制表达。YANG等[19]研究发现几丁质合成酶(CHS)和几丁质酶(CHT)受miR-71和miR-263的调控,在几丁质生物合成和降解中能发挥新功能和平衡调节模式。ZHENG 等[20]研究发现miR-71可以影响巨噬细胞的功能,主要通过影响编码小RNA 诱导的沉默复合物的关键组分的Ago1和Ago4 上调表达实现。
综上所述,miR-71 血清表达水平与人胃早癌肿瘤免疫细胞浸润深度呈负相关趋势,而其机制与激活IL-23/Th17信号通路有关,而miR-71对肿瘤浸润免疫细胞中的树突状细胞和淋巴细胞的影响还需要进一步研究和大量的实验样本进行验证。

