磁性纳米Fe3O4-SiO2载体的改性及其在脂肪酶固定化中的应用
甘露菁,田韩,荣菡,彭佳敏,肖晓欣,黄海雯
北京理工大学珠海学院,材料与环境学院(珠海 519088)
磁性纳米Fe3O4-SiO2载体材料具有优异的超顺磁性能。所谓超顺磁性,即在磁场中有较强的磁性,撤离磁场时,磁性很快消失,而不会被永久磁化[1],它们在外磁场作用下可方便进行定位反应和高效回收,因此近年来在这一领域的研究日益活跃,成为生物材料研究领域中最具应用前景的发展方向之一[2-3]。但就研究状况而言,磁性纳米Fe3O4-SiO2载体材料的研究主要集中在磁性微球的合成和表征方面,而对偶联剂修饰的磁性微球的研究报道不多[4-5]。
磁性纳米Fe3O4-SiO2载体材料是在磁性纳米Fe3O4粒子表面包覆一层SiO2后形成,而SiO2由于表面具有大量羟基,导致亲水性极强,不容易在油相或有机溶剂中分散,易聚团,难以发挥其优良的性能,因此必须对其进行改性[6-8]。偶联剂(KH-550)是一种典型的硅烷偶联剂,常用于氧化物表面的氨基化改性,经过KH-550修饰后的磁性纳米Fe3O4-SiO2载体材料表面含有大量氨基和有机链臂,大幅拓展和提高磁性纳米Fe3O4-SiO2载体材料的应用领域[9-10]。
大部分的酶的本质是蛋白质,它作为一种生物催化剂,具有较高催化效率。但由于在生产使用中游离酶有易失活和难以与底物分离的缺点。近些年研究表明,酶分子被固定化后,可以反复循环利用,且在产物分离纯化上增加便利[11-12]。因此酶固定化技术得到迅速发展[13]。在酶分子固定化领域,用KH-550改性后的磁性纳米Fe3O4-SiO2载体表面含有大量氨基,由于活性氨基可以与蛋白质、DNA等生物分子偶联,在一定程度上,以化学键形式结合脂肪酶,使酶不易脱落,克服传统的载体吸附酶法易脱落、使用周期短的弱点[14-16]。因此该复合载体材料在生物材料分离、酶和抗体等生物分子的固定等方面有重要应用。
1 材料与方法
1.1 材料、设备与仪器
磁性纳米Fe3O4-SiO2载体(99.5%,北京理工大学珠海学院实验室制得);正己烷、石油醚、无水乙醇、KH-550、甲醇、磷酸二氢钠、磷酸二氢钾(均为分析纯,天津市大茂化学试剂厂);氢氧化钾、酚酞(均为分析纯,广州化学试剂;废油脂(北京理工大学珠海学院,煎炸多次);脂肪酶Novozyme 435(诺维信(中国)生物技术有限公司)。
电热恒温水浴锅(常州奥华);电动搅拌器(上海恒科学仪器有限公司);高功率数控超声波清洗器;电子天平(纪铭);电热恒温鼓风干燥箱(上海齐欢);超纯水与去离子水制水机(Millipore);磁铁(青岛磁钢厂);冰箱(青岛海尔集团公司);恒温震荡器(上海恒科学仪器有限公司);高速离心机(江苏安信)。
1.2 载体的去油、表面活化
将3~5 g磁性纳米Fe3O4-SiO2载体加入至3% NaOH溶液中,室温下超声分散洗涤5~10 min,磁分离,回收物用去离子水洗涤至中性得到去油的磁性纳米Fe3O4-SiO2载体。
将去油的磁性纳米Fe3O4-SiO2载体加入双氧水碱性溶液[V(H2O2)∶V(NH3)∶V(H2O)=1.5∶4.5∶94]中,50~70 ℃加热搅拌30 min,磁分离后回收物用去离子水洗涤至中性,60 ℃真空干燥6 h得到活化的磁性纳米Fe3O4-SiO2载体。
1.3 载体的表面氨基化改性
按质量将47%乙醇、47%去离子水和4.0% Kh-550混合后,在80 ℃条件下搅拌反应1.5 h,使Kh-550充分水解,温度降为65 ℃后加入2%活化磁性纳米Fe3O4-SiO2载体,搅拌反应1.5 h,待其充分反应,磁分离,回收物用乙醇洗涤2次,在60 ℃真空干燥6 h,得到改性成功后的氨基化磁性纳米Fe3O4-SiO2载体,将其命名为G0。
1.4 改性前、后的载体固定化脂肪酶
分别用改性前的磁性纳米Fe3O4-SiO2载体和改性后的磁性纳米Fe3O4-SiO2载体对脂肪酶进行固定化。
先配制0.2 mol/L pH 7.5的PBS缓冲液:储备液A,0.2 mol/L的磷酸二氢钠(35.814 g Na2HPO4用去离子水定容至500 mL),储备液B,0.2 mol/L的磷酸二氢钾(15.6 g的KH2PO4用去离子水定容至500 mL),将储备液A、B液混合即得到pH 7.5的PBS缓冲液。将3 mL的液体脂肪酶置于55 ℃的100 mL PBS缓冲液中搅拌活化10~15 min,在50 ℃条件下加入1 g载体,搅拌反应4 h,磁分离回收固定化脂肪酶,在4 ℃保存备用。将改性前的载体固定化脂肪酶命名为G1,将改性后的载体固定化脂肪酶命名为G2。
1.5 G1、G2固定化脂肪酶在生物柴油制备中的应用
废油脂预处理:在北京理工大学珠海学院街客小店中收取一定量餐饮废油,于高速离心机中离心,除去餐饮废油中的固体杂质,用旋转蒸发除水和一定量的哈喇气味。
生物柴油制备酯化反应:设计A、B 2组对比试验,分别加入93%预处理废油脂和4%甲醇,其中甲醇的量按酯化反应的时间分成5次加入,在反应物中分别加入3%固定化酶G1(酯化反应A组)和G2(酯化反应B组),将反应物置于60 ℃摇床反应6 h进行酯化反应,反应结束后离心处理,取上层液体进行酸价测定;下层固体用磁铁回收,用正己烷洗涤2~3遍,50℃烘干,4 ℃保存备用。
酸价的测定:取预处理过的废油脂或酯化反应产物3~5 g,加入乙醇乙醚混合溶剂50 mL,摇匀后,加入2~3滴酚酞,用0.05 mol/L KOH标准溶液滴定,根据式(1)计算得酸价。

式中:V为消耗KOH使酚酞变色30 s不变色时的体积,mL;C为KOH浓度,mol/L;M为油脂质量,g。
酯化率的测定,分别计算出A、B 2组试验的酯化率。根据式(2)计算。

1.6 G2固定化脂肪酶重复利用
将G2固定化脂肪酶按照1.5的方法反复10次进行生物柴油制备的酯化反应,每次利用后的G2固定化脂肪酶均用正己烷洗涤2~3遍,50 ℃烘干,4 ℃保存备用。同时计算出每次酯化反应后酯化率。
1.7 载体的表征
1.7.1 X-射线衍射仪(XRD)
对去油和活化后的磁性纳米Fe3O4-SiO2载体的晶型进行判断,用X-射线衍射仪(XRD)表征磁性纳米Fe3O4-SiO2载体在去油和活化的过程中磁性纳米Fe3O4的晶型结构是否发生变化,按文献[17]对样品进行处理和测定。
1.7.2 电子透射显微镜(TEM)
采用电子透射显微镜(TEM)对去油和活化后的磁性纳米Fe3O4-SiO2载体的包裹情况进行直观的判断,按文献[17]对样品进行处理和测定。
1.7.3 改性前后的载体分散在正己烷和水中
将改性前、后的磁性纳米Fe3O4-SiO2载体分别分散在正己烷和水中,对比和直观判断氨基化改性是否成功。
1.7.4 傅立叶红外光谱仪(FT-IR)
用傅立叶红外光谱仪(FT-IR)分别对磁性纳米Fe3O4-SiO2载体和改性后的磁性纳米Fe3O4-SiO2载体进行测试,找到最优的改性反应时间,按文献[18]进行处理。
2 结果与分析
2.1 X-射线衍射仪(XRD)
图1为去油和活化后的磁性纳米Fe3O4-SiO2载体的XRD图谱,衍射峰分别出现在30.00,35.50,43.20,53.80,57.1和62.9处,与黄菁菁等[19]制备的磁性纳米Fe3O4晶体反尖晶石结构的衍射面相同,可以确定SiO2壳层中的磁性纳米Fe3O4的晶型为反尖晶石结构,可知SiO2壳层中的Fe3O4的晶型在去油和活化的过程中没有发生变化,依旧是磁铁矿型。同时标志峰明显,没有出现其他杂峰,说明合成材料内核Fe3O4纯度非常高。

图1 去油和活化后的磁性纳米Fe3O4-SiO2载体(XRD)
2.2 电子透射显微镜(TEM)
采用电子透射显微镜(TEM)对去油与活化后的磁性纳米Fe3O4-SiO2载体的包裹情况进行直观的判断,图2和图3分别为30 K下和400 K下去油与活化后的磁性纳米Fe3O4-SiO2载体的TEM图,其粒径约30 nm,包裹厚度3~5 nm,磁性纳米Fe3O4平均粒径20~25 nm,其分散性良好,且去油和活化过程没有让磁性纳米Fe3O4表面包裹的SiO2完全溶解腐蚀。

图2 去油和活化后的磁性纳米Fe3O4-SiO2载体(30 K-TEM)

图3 去油和活化后的磁性纳米Fe3O4-SiO2载体(400 K-TEM)
2.3 改性前后的载体在正己烷和水中的分散性
图4 显示磁性纳米Fe3O4-SiO2载体与改性后的磁性纳米Fe3O4-SiO2载体分别分散在正己烷和去离子水中的情况,磁性纳米Fe3O4-SiO2载体分散在正己烷中时磁性纳米Fe3O4-SiO2载体聚团成较大颗粒状,且易于沉降,在正己烷中不能分散,不具有超顺磁性,推测其原因是磁性纳米Fe3O4-SiO2载体聚团后使得质量变大,重力过大使得超顺磁性难以展示[6-8];磁性纳米Fe3O4-SiO2载体分散在去离子水中时能均匀分散,且一段时间内不沉降,具有超顺磁性。改性后的载体均可均匀分散在正己烷中和水中,且一段时间内不沉降,具有超顺磁性,说明用该种方法改性磁性纳米Fe3O4-SiO2载体具有两亲性,可应用水/油2种分散体系中。

图4 改性前、后的载体分散在正己烷和水中图
2.4 傅立叶红外光谱仪(FT-IR)
由图5所示曲线a表示纳米Fe3O4、曲线b表示磁性纳米Fe3O4-SiO2载体曲线、曲线c表示氨基改性的磁性纳米Fe3O4-SiO2载体的傅里叶变换红外光谱图,与张小强[16]在磁性高分子微球的合成及其用于脂肪酶固定化的研究的傅里叶变换红外光谱仪(FT-IR)对比,可知a、b、c在580 cm-1处都有吸收,说明三者都有相同成分存,其本质为四氧化三铁,即可知a、b、c都是由四氧化三铁合成而来;b、c在1 080 cm-1有相同吸收峰,说明两者有相同成分,其本质为SiO2,即可知b、c都包埋上SiO2;由c可知在1 384,1 490和1 582 cm-1处都有吸收峰,此3处的吸收峰为亚甲基、甲基的伸缩振动峰,因此可知载体表面已连接上氨基,说明对磁性纳米Fe3O4-SiO2载体表面氨基改性成功。

图5 纳米Fe3O4(曲线a)、纳米Fe3O4-SiO2(曲线b)、改性后的纳米Fe3O4-SiO2(曲线c)的FT-IR表征图
2.5 G1、G2固定化酶的生物柴油酯化率对比
将G1、G2固定化酶分别应用于生物柴油的酯化反应中,对每种固定化酶进行3次平行试验,如图6所示,其G1固定化脂肪酶酯化率为26.78%;G2固定化脂肪酶酯化率为56.4%。
是G1固定化脂肪酶酯化率的2.1倍,因此可知改性后的载体固定化酶对酯化反应有很大的促进作用,推测其原因可能是,未改性载体在油/水体系中易发生聚团,聚团后的固定化酶与反应物的接触面积减小,使得酯化率大大减小,而载体氨基化改性后,载体表面连接上较长的碳链臂,能均匀分散在油/水体系,固定化酶与反应物的接触面积增大,使酯化率大大提高。另一个原因可能是由于改性载体表面连接上大量氨基,使得载体以肽键方式连接上大量酶分子,从而使酯化率大幅提升[14]。

图6 改性前、后载体固定化脂肪酶进行生物柴油的酯化率对比
2.6 G2固定化酶重复利用
将G2固定化酶重复进行生物柴油酯化反应,用每次反应的酯化率来评价固定化酶的使用寿命和利用率。其10次重复使用后的酯化率变化趋势图如图7。
由G2固定化酶重复使用10次的酯化率可知,10次平均酯化率达50.65%,重复使用10次后酯化率未有明显下降,较第1次使用的酯化率下降15.8%。因为酯化率的高低与酶活力的大小成正相关,此处用酯化率来评价酶的活性大小,可知重复使用10次后的酶活回收率为71.99%。而冯超[13]提出固定化的脂肪酶重复使用8次后的酶活回收率只有36.4%,重复使用10次后的酶活回收率几乎接近0;王燕佳等[20]的研究结果显示固定化脂肪酶重复使用5次后其相对酶活为初始时的57.8%。改性后的磁性纳米Fe3O4-SiO2载体固定化酶效率高,使用周期长,能在实际应用中节约成本,推测其原因是由于氨基化改性后,载体连接上氨基,在一定程度上,以化学键形式结合脂肪酶,使酶不易脱落,克服传统载体吸附酶法易脱落、使用周期短的缺点,这与试验结论相吻合。
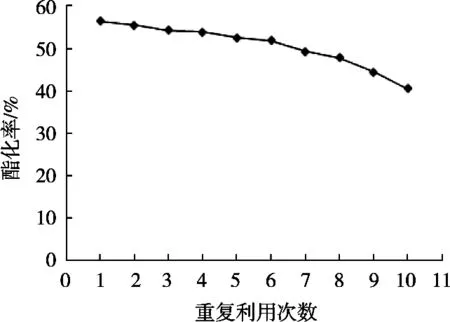
图7 G2固定化酶重复使用的酯化率
3 结论与讨论
磁性纳米Fe3O4-SiO2载体由于表面的包裹材料SiO2含有大量羟基,因此该复合材料是亲水性材料,为了能使磁性纳米Fe3O4-SiO2载体的应用范围更为广泛,需对载体进行改性,试验将载体去油和活化后用KH-550对载体进行氨基化改性,用改性后的载体和改性前的载体分别固定化脂肪酶,用这2种固定化酶催化酯化反应,对比其二者的酯化率,用酯化率来评价改性的效果。结果表明,改性后,磁性纳米Fe3O4-SiO2载体表面连接上大量氨基和有机碳链臂,使得载体在油相中能均匀分散性,其酯化率比未改性的载体固定化的脂肪酶的酯化率高2倍。改性后的载体固定化的脂肪酶重复使用10次后,酯化率只下降15.8%,改性后的载体固定化脂肪酶的固定效果好,不易脱落、回收利用率更高、酯化率高、使用寿命长,在实际应用中能节约成本。

