4种检测系统检测C反应蛋白结果的可比性研究
陈小伟,胡利萍,韩丽萍△
江苏省南京市六合区人民医院:1.检验科;2.药剂科,江苏南京 211500
C反应蛋白(CRP)是一种急性时相反应蛋白,对鉴别病毒与细菌感染,炎症过程的判断,感染、脓毒症的诊断和监测等方面具有重要的临床价值[1]。本院检验科因实际工作需要,先后购置了4种类型的CRP检测仪器,分别为贝克曼AU5821生化仪、迈瑞BC5390血球仪、国赛Aristo特定蛋白仪和Orion Diagnostica Quick Read CRP分析仪,其中前3种检测系统检测的是超敏C反应蛋白(hs-CRP),而Orion Diagnostica Quick Read CRP分析仪检测的是CRP。实际上,hs-CRP与CRP为同一物质,所检测的均是CRP,二者结果具有可比性,但hs-CRP的灵敏度更高,能明显地识别出CRP水平的轻度升高[2]。贝克曼AU5821生化仪检测结果准确度高,连续多年在江苏省临床检验中心特定蛋白室间质评中评为优秀,故本研究根据NCCLS EP9-A2[3]文件,以贝克曼AU5821生化仪为目标检测系统,分别对迈瑞BC5390血球仪、国赛Aristo特定蛋白仪和Orion Diagnostica Quick Read CRP分析仪的检测结果进行比较,以研究不同检测系统所检测的CRP水平是否具有可比性。
1 资料与方法
1.1一般资料 选取2018年6月于本院门诊就诊或住院治疗的患者为研究对象,每天随机收集8例患者的EDTA-K2抗凝全血及血清标本(无脂血、黄疸、溶血),连续收集6 d,共收集48份全血标本和48份血清标本。
1.2仪器与试剂 目标系统:贝克曼AU5821生化仪,其检测CRP的试剂及校准品由南京澳林生物有限公司提供,质控品由伯乐公司提供;待测系统1:迈瑞BC5390血球仪采用配套的CRP试剂、校准品及质控品;待测系统2:国赛Aristo特定蛋白仪采用配套的CRP试剂、校准品及质控品;待测系统3:Orion Diagnostica Quick Read CRP分析仪采用配套的CRP试剂、校准品及质控品。
1.3方法
1.3.1检测方法 在各检测系统在控情况下,每天每种系统连续检测8份标本,其中目标系统检测的是血清标本的CRP水平,待测系统1、2、3检测的是全血标本的CRP水平。标本按1→8和8→1的正反顺序各检测2次,共检测6 d。由于待测系统3的最低检测限为1.0 mg/L,当标本CRP水平小于1.0 mg/L时,舍去该结果。
1.3.2离群值判定 根据NCCLS EP9-A2文件,对4种检测系统的检测结果进行方法内和方法间离群值判定。方法内离群值判定:当各检测系统两次检测的CRP水平的差值绝对值小于4倍差值绝对值均值时,认为方法内无离群值;方法内如果出现1个离群值,分析其原因,删除后可继续比较;若出现超过2个离群值,则应立即停止比较,查找误差原因,解决后重新检测。方法间离群值判定:分别计算待测系统检测的CRP水平与目标系统检测的CRP水平的差值绝对值,当差值绝对值小于4倍差值绝对值均值时,则认为方法间无离群值;方法间如果出现1个离群值,分析其原因,删除后可以继续比较;若出现超过2个离群值,应立即停止比较,查找误差原因,解决后重新检测。
1.3.3可比性分析 (1)分析各待测系统检测结果与目标系统检测结果间的相关性,以目标系统所检测的CRP水平均值为横轴,待测系统所检测的CRP水平均值为纵轴,分别计算出回归方程:Y=aX+b,当R≥0.975或R2≥0.95时,则认为两种检测系统检测结果呈线性相关[4]。(2)以目标系统检测的CRP水平均值与待测系统检测的CRP水平均值的和的1/2为横轴,以待测系统检测的CRP水平均值与目标系统检测的CRP水平均值的差值为纵轴,绘制CRP水平均值偏倚散点图,评估待测系统检测结果的偏倚。(3)根据回归方程,将CRP的医学决定水平(X)代入计算出各检测系统的预测值(Y),并计算相对偏倚SE%=∣Y-X∣/X×100%。临床可接受性判定:各检测系统在不同医学决定水平的相对偏倚SE%<1/2允许总误差(TEa),CRP的TEa以原卫生部临床检验中心推荐的25%为标准,即SE%<12.5%时结果为临床可接受。
1.4统计学处理 采用SPSS18.0统计软件进行数据分析。采用线性回归分析各待测系统与目标系统检测结果的相关性,以P<0.05为差异有统计学意义。
2 结 果
2.1各检测系统离群值判定 各检测系统方法内均有1个离群值,在文件允许范围内直接删除,剔除离群值后,各检测系统分别有47个CRP检测结果。待测系统3检测的CRP结果中有6个小于1.0 mg/L,舍去后剩余41个检测结果。各检测系统方法间无离群值。
2.2各检测系统检测结果的相关性分析 待测系统1、2、3所检测的CRP水平与目标系统所检测的CRP水平的线性回归方程分别为:Y=0.996X-0.508、Y=0.970X-0.515、Y=0.971X-0.945,R2分别为0.999、0.998和0.998,均R2≥0.95,P<0.01,相关性良好。见图1、2、3。
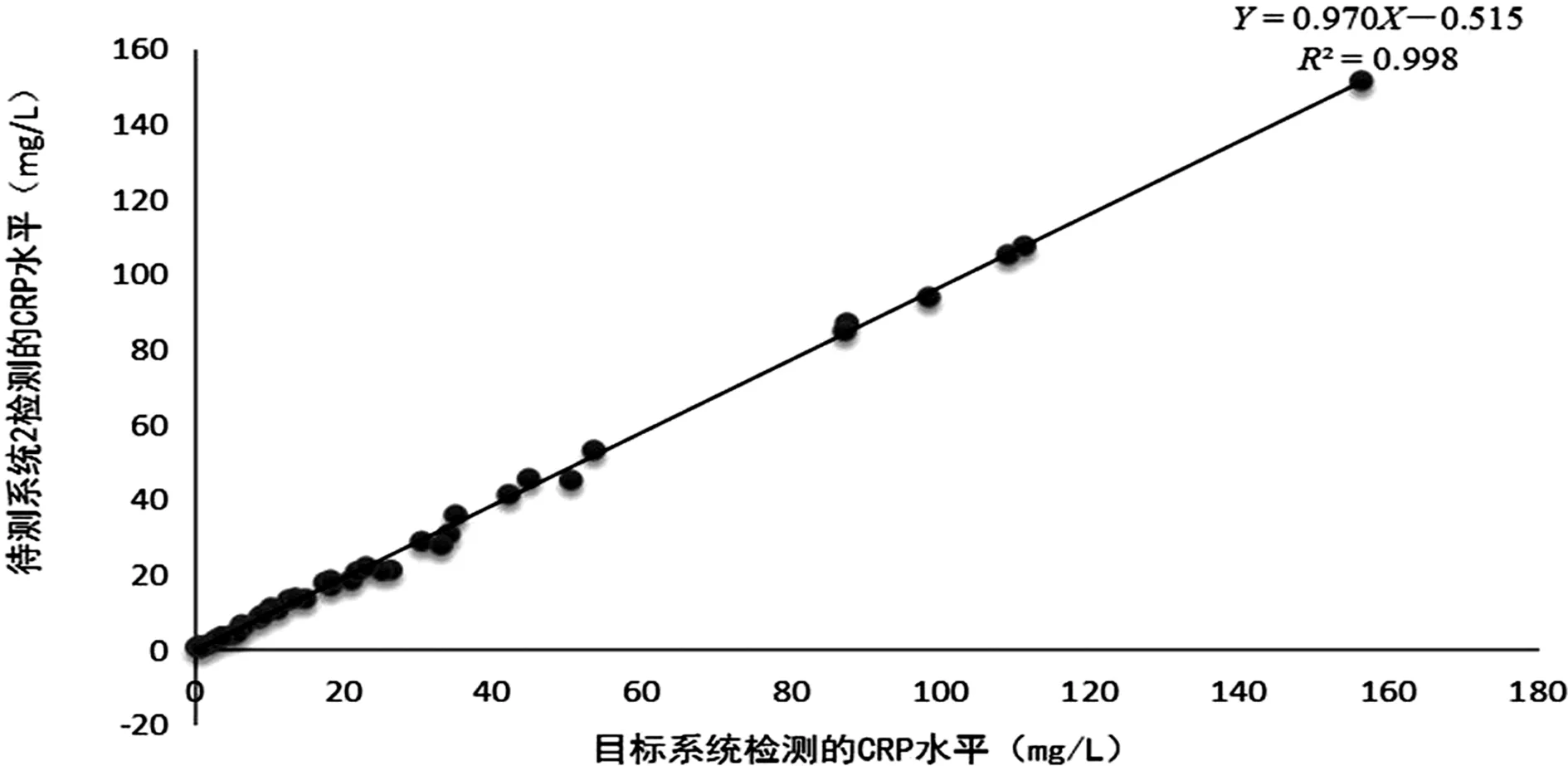
图2 待测系统2与目标系统检测结果的线性回归图

图3 待测系统3与目标系统检测结果的线性回归图
2.3待测系统检测结果的偏倚评估 待测系统1、2、3与目标系统所检测的CRP水平均值部分存在正偏倚,部分存在负偏倚,以负偏倚为主。见图4、5、6。
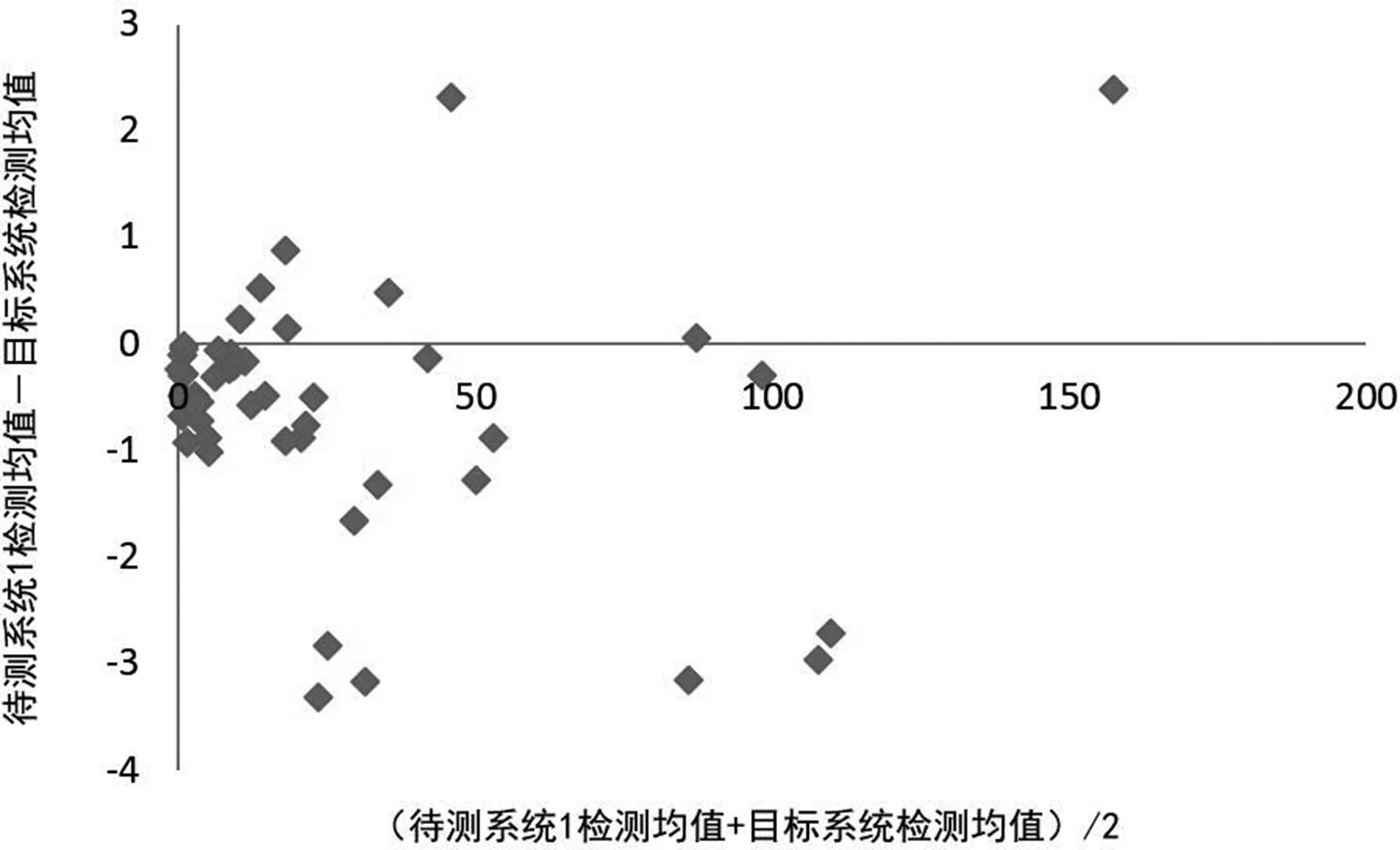
图4 待测系统1检测CRP水平均值的偏倚散点图
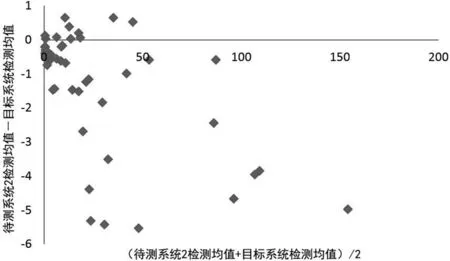
图5 待测系统2检测CRP水平均值的偏倚散点图
2.4待测系统的临床可接受性判定 待测系统3在CRP医学决定水平为6 mg/L时,其SE%超出1/2TEa(12.5%),结果不可接受,经回归方程计算,只有当CRP≥10 mg/L时,待测系统3检测CRP水平的SE%在允许范围内。待测系统1、2在不同医学决定水平时的检测结果临床均可接受。见表1。
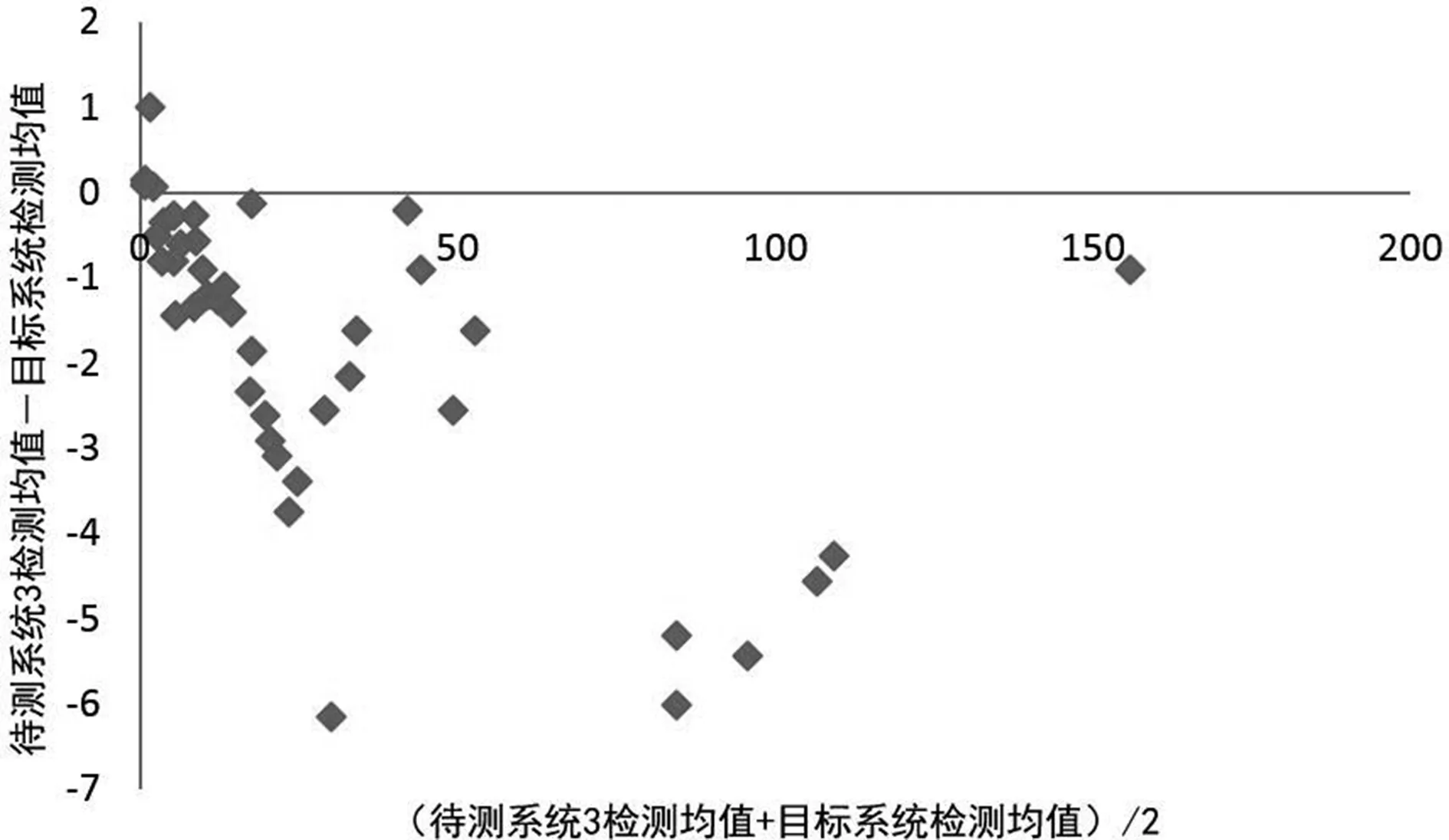
图6 待测系统3检测CRP水平均值的偏倚散点图
表1待测系统的临床可接受性判定
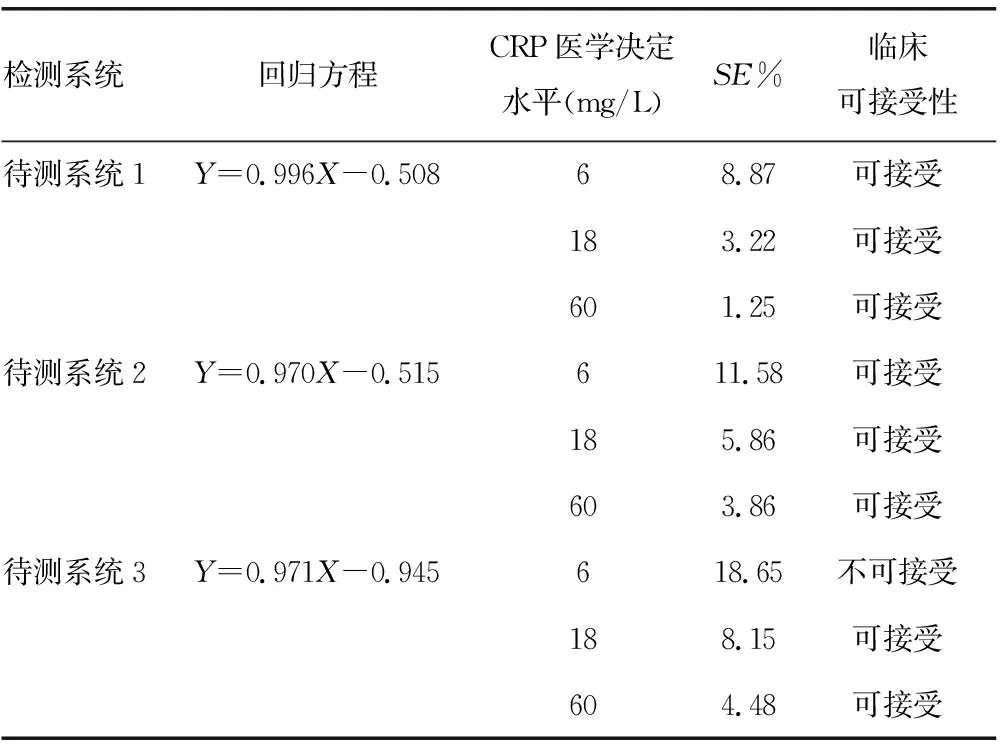
检测系统回归方程CRP医学决定水平(mg/L)SE%临床可接受性待测系统1Y=0.996X-0.50868.87可接受183.22可接受601.25可接受待测系统2Y=0.970X-0.515611.58可接受185.86可接受603.86可接受待测系统3Y=0.971X-0.945618.65不可接受188.15可接受604.48可接受
3 讨 论
目前,在不同医疗机构甚至同一医疗机构中,普遍存在一个检验项目可能用多种检测方法和检测仪器进行检测的现象。随着医疗行业的进一步规范,临床检测结果必须具有溯源性和可比性[5-6],不同检测系统对同一检测项目的检测结果具有一致性也是目前医院检测相关质量管理工作的最终目标[7]。而检测结果的一致性判断,最重要并且切实可行的途径就是与已知准确的检测系统进行方法学比较[8]。
虽然迈瑞BC5390血球仪、国赛Aristo特定蛋白仪和Orion Diagnostica Quick Read CRP分析仪均使用配套试剂及校准品,有对应的溯源体系,但由于其均未参与室间质评,所检测的CRP水平的准确性和可比性不得而知。本研究根据NCCLS EP9-A2文件,将上述3台仪器的检测结果与室间质评结果均为优秀的贝克曼AU5821生化仪的检测结果进行比较,结果显示,迈瑞BC5390血球仪和国赛Aristo特定蛋白仪检测的CRP水平与贝克曼AU5821生化仪的检测结果具有很好的相关性,且这2台仪器的检测结果均满足临床可接受性要求,具有可比性。Orion Diagnostica Quick Read CRP分析仪检测的CRP水平虽然与贝克曼AU5821生化仪的检测结果具有很好的相关性,但当CRP医学决定水平为6 mg/L时,其SE%超出1/2TEa(12.5%),结果不可接受,进一步经回归方程计算,只有当CRP≥10 mg/L时,Orion Diagnostica Quick Read CRP分析仪检测的CRP水平才在SE%允许范围内。考虑出现上述结果的原因可能与人为误差有关,Orion Diagnostica Quick Read CRP分析仪是半自动仪器,需要手工加样,加样量的准确性直接影响结果,且加样误差对低水平标本的检测结果影响更为显著[9]。本院采购Orion Diagnostica Quick Read CRP分析仪主要是考虑儿童采血较为困难,此仪器只需20 μL血液标本便可进行检测,儿童可以通过采集末梢血来进行检测,从而减少患儿痛苦,减轻临床工作量。迈瑞BC5390血球仪具有微量自动检测模式,用血量仅35 μL就可完成血细胞分析和CRP检测,无须手工加样,且与贝克曼AU5821生化仪的检测结果具有可比性,与Orion Diagnostica Quick Read CRP分析仪相比,更适用于门、急诊儿童末梢血标本检测。
本研究对迈瑞BC5390血球仪、国赛Aristo特定蛋白仪和Orion Diagnostica Quick Read CRP分析仪检测的CRP水平均值进行偏倚评估发现,上述3种待测系统检测的CRP水平大都低于贝克曼AU5821生化仪的检测水平,主要表现为负偏倚。这可能是由于该3种检测系统均检测的是全血标本,而贝克曼AU5821生化仪检测的是血清标本,在进行全血CRP检测时,不同的血细胞比容可直接导致血浆比例不同,从而影响全血检测结果的准确性[10]。
综上所述,迈瑞BC5390血球仪和国赛Aristo特定蛋白仪检测的CRP水平能满足临床要求,结果具有可比性。Orion Diagnostica Quick Read CRP分析仪检测结果在低值部分时误差较大,本研究将在后期行验证试验,如结果仍不满足临床可接受性,论证后考虑淘汰该检测系统,以进一步提高检测结果的准确性。

