黏液型铜绿假单胞菌的临床分布及药敏分析*
王巧媚,陆丹倩,赖贵龙,彭 明
广东省中山市中医院:1.检验科;2.综合二区,广东中山 528400
铜绿假单胞菌(PA)是引起院内感染的主要条件致病菌之一。PA 根据菌落形态可分为黏液型和非黏液型,二者在一定条件下可以相互转换,非黏液型PA在渗透压高、氯化钠水平高以及磷酸盐水平较低等条件下容易转化为黏液型PA[1]。黏液型PA极易吸附于导管及黏膜表面形成生物被膜,故很难从患者体内清除,从而引起临床难治性感染[2]。本研究分析了2015年1月至2018年12月本院分离得到的82株黏液型PA的临床分布及药敏试验情况,旨在为临床预防及治疗黏液型PA 感染提供可靠依据。
1 材料与方法
1.1标本来源 选取2015年1月至2018年12月本院临床送检的各类合格标本中分离的82株黏液型PA菌株(剔除同一患者的重复检测菌株)为研究对象。
1.2仪器与试剂 鉴定仪器为珠海迪尔微生物鉴定药敏分析仪;药敏纸片有哌拉西林、哌拉西林/他唑巴坦、头孢他啶、头孢吡肟、氨曲南、亚胺培南、美罗培南、庆大霉素、妥布霉素、阿米卡星、环丙沙星和左氧氟沙星,所有药敏纸片均购自英国OXOID公司;M-H平板购自江门凯林公司。
1.3方法 标本培养及分离均参照《全国临床检验操作规程》第4版进行,黏液型PA经35 ℃培养18~24 h,血平板上生长多为无色、露滴样菌落,48 h后融合成胶糊样片状菌落,部分菌株可产生色素。所有菌株均经珠海迪尔微生物鉴定药敏分析仪鉴定为PA。药敏采用纸片扩散法(K-B法)进行检测,将分离纯化后的黏液型PA配制成0.5麦氏浊度单位的菌悬液,然后均匀涂布在M-H平板上,再分别贴上12种药敏纸片,于35 ℃孵箱中孵育48 h后量取其抑菌圈[3]。药敏试验结果根据美国临床和实验室标准化协会(CLSI)2014版进行判读。质控菌株为原卫生部临床检验中心提供的PA ATCC27853。
1.4统计学处理 采用WHONET5.6软件进行数据分析。
2 结 果
2.1菌株分布情况
2.1.1标本来源分布 82株黏液型PA中,75株分离自痰液标本,占91.5%;5株分离自尿液标本,占6.1%;1株分离自血液标本,1株分离自分泌物标本,分别占1.2%。
2.1.2标本性别及年龄来源分布 82株黏液型PA中34株(41.5%)来自男性,48株(58.5%)来自女性;63株来自50~80岁人群,占76.8%;9株来自<50岁人群,占11.0%;10株来自>80岁人群,占12.2%。
2.1.3标本临床诊断分布 75株痰液标本中,分离自支气管扩张合并肺部感染患者31株(41.3%),其次为慢性阻塞性肺疾病患者18株(24.0%);5株尿液标本中,3株(60.0%)分离自长期留置导尿管患者;1株血液标本分离自胆囊炎患者;1株分泌物标本分离自化脓性中耳炎患者的耳道分泌物。见表1。
2.2药敏试验结果 12种抗菌药物中,黏液型PA对阿米卡星的耐药率最低,为2.4%;对左氧氟沙星和哌拉西林的耐药率最高,均为35.4%。其中耐碳青霉烯类黏液型PA有21株,占25.6%。见表2。

表1 黏液型PA不同类型标本的临床诊断分布
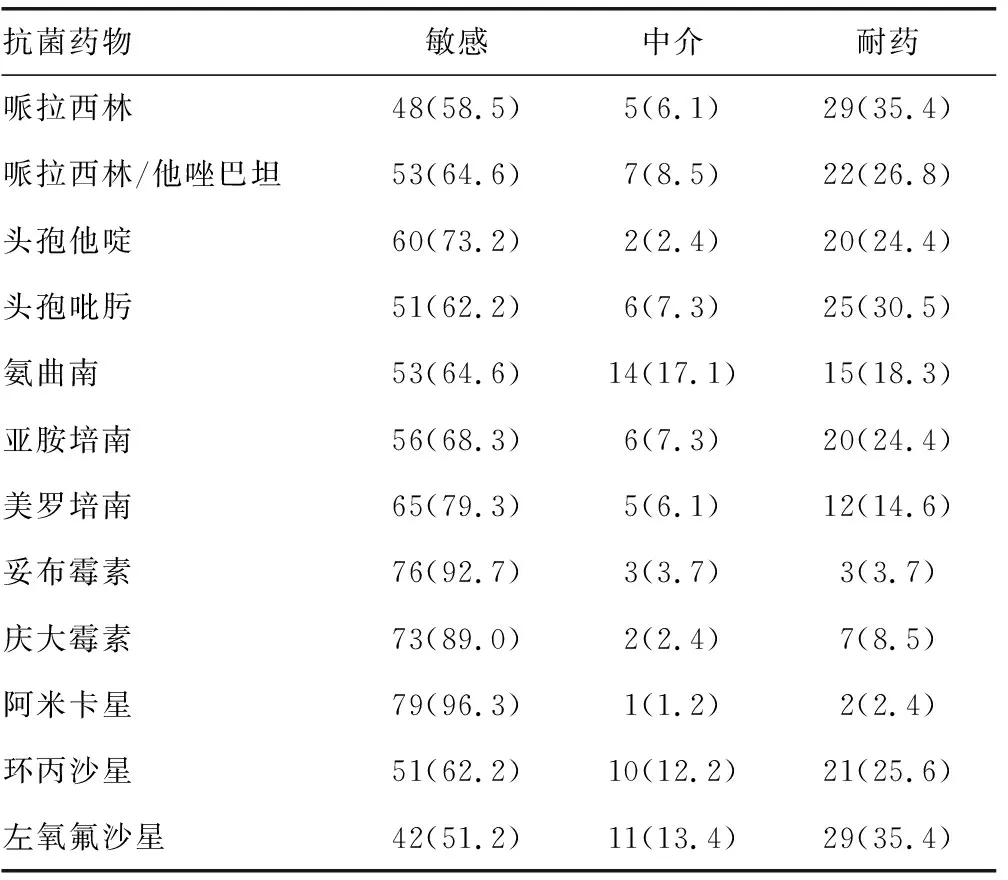
表2 82株黏液型PA 12种抗菌药物的药敏试验结果[n(%)]
3 讨 论
PA在自然界中分布广泛,可存在于医院的各种环境中,为院内感染的常见病原菌之一。临床分离的PA根据菌落形态可分为黏液型和非黏液型,二者在一定条件下可以相互转化,体内的PA在慢性炎症的长期刺激下容易合成多糖藻酸盐而转变成黏液型,通常黏液型菌株更易形成生物被膜[4]。有研究发现,PA易黏附于惰性生物材料或机体表面形成生物被膜,可阻碍抗菌药物对膜内细菌的杀灭作用,从而引起慢性持续性感染[5]。本院的黏液型PA主要分离自支气管扩张合并肺部感染、慢性阻塞性肺疾病等呼吸道存在慢性炎症刺激和上呼吸机、气管切开等行侵入性操作的患者痰液标本中;尿液标本分离到的黏液型PA主要来自长期留置导尿管或有肾结石的患者。由此可见,慢性炎症的持续刺激与医疗惰性材料的侵入性操作是导致黏液型PA感染的主要诱因。本院女性患者黏液型PA的分离率(58.5%)较男性(41.5%)略高,与李玉玲等[6]的研究相符。但国内多项研究显示PA的分离率总体表现为男性高于女性[7-9],这可能与本研究黏液型PA收集的例数少且存在区域局限性有关,但还需进一步研究以证实。从年龄分布来看,50~80岁是黏液型PA分离率最高的年龄段,可见黏液型PA的易感人群主要为患有慢性呼吸道疾病的中老年人群,与杨琴等[10]的研究一致。
黏液型PA 12种抗菌药物的药敏试验结果显示,氨基糖苷类的耐药率均较低,可能与该类药物的不良反应多,临床较少选用有关;阿米卡星的耐药率为2.4%,低于妥布霉素(3.7%)和庆大霉素(8.5%),这与阿米卡星对细菌产生的钝化酶比较稳定有关[11];本研究氨基糖苷类药物的耐药率与张保荣等[12]报道的基本一致。耐药率最高的为左氧氟沙星和哌拉西林,均为35.4%,其次是头孢吡肟,为30.5%,比国内部分报道的耐药率略高[10,13],与诸葛宝忠等[14]报道的药敏试验结果接近。其中耐碳青霉烯类黏液型PA共分离到21株,亚胺培南耐药的有20株(24.4%),美罗培南耐药的有12株(14.6%),亚胺培南的耐药率高于美罗培南,这可能与PA的膜孔蛋白OprD2表达减少或缺失这一耐药机制相关,因为OprD孔道是亚胺培南、部分美罗培南和多利培南等碳青霉烯类药物快速进入菌体的特异性通道,当OprD蛋白减少或缺失时PA仅对亚胺培南耐药,对其他碳青霉烯类药物仍表现为敏感[15]。如果菌株在OprD基因高表达情况下出现对亚胺培南和美罗培南耐药时,则表明耐碳青霉烯类PA可能存在其他耐药机制,如外排泵的高表达、产AmpC酶等[16]。黏液型PA引起临床的难治性感染有特殊性,其黏膜表面存在大量多糖藻酸盐等物质,形成厚而致密的生物被膜,可阻挡抗菌药物向生物被膜内的PA渗透 ,使膜内的药物水平降低[17-18]。有研究表明,即使在抗菌药物水平达到有效药物水平的1 000倍以上也难以杀灭生物被膜包裹中的细菌[19]。多项研究发现,大环内酯类药物具有抑制黏液型PA生物被膜形成和黏附的作用,敏感药物联合大环内酯类药物进行抗感染治疗可有更低的最小抑菌浓度值,达到更强的治疗效果[20-24]。国内有报道显示,某些中药成分如鱼腥草[23-24]、麻杏石甘汤[25]等对黏液型PA的生物被膜也有较明显的抑制作用。
综上所述,黏液型PA的易感人群主要为患有慢性呼吸道疾病的中老年人群;临床在诊疗时要重视生物被膜的形成诱因,注意加以预防,明确黏液型PA感染时应及时调整用药;推荐大环内酯类和某些中药制剂,如鱼腥草、麻杏石甘汤等可抑制生物被膜的药物与其他敏感抗菌药物联合应用;此外,实验室报告黏液型PA的药敏试验结果时应特别注明为黏液型菌株以提醒临床注意用药的选择。

