系统性红斑狼疮脑病的研究进展
张索 刘冬舟
暨南大学第二临床医学院,深圳市人民医院风湿免疫科(广东深圳518000)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种慢性、以免疫性炎症为突出表现的多系统损害的自身免疫性疾病[1],我国大样本的一次性调查(>3万人)显示,SLE的患病率为70/10万人,女性多见;作为最常见的免疫性疾病之一,SLE极大危害了公众健康。尽管关节炎和皮肤病是SLE最常见的表现形式,但内脏受累也并不少见,尤其是肺、肾和中枢神经系统的受累使SLE引起的病死率大大增加。在这些内脏表现中,系统性红斑狼疮脑病或称为神经精神性狼疮(neuropsychiatric systemic lupus erythematosus,NPSLE)在SLE的发生率为21%~95%,表现为多种多样的神经和精神病学临床症状,作为SLE严重的并发症之一,其诊断和治疗带来了极大的临床挑战[2]。本文就NPSLE的发病机制、临床诊断、治疗等研究进展作一综述,希望为临床上的诊治决策提供帮助。
1 NPSLE的发病机制
NPSLE的发病机制特别复杂,具体的发病机制仍不清楚,没有单一的致病途径可以解释NPSLE的各种神经精神症状。目前一般认为复杂的相互关联的机制共同促进了NPSLE的发展[3-4],包括:(1)血脑屏障(Blood-brain barrier,BBB)功能障碍[5]:对NPSLE患者脑脊液的分析反复表明,一般免疫球蛋白(以及特定类型的抗体)、促炎细胞因子和白蛋白水平升高,表明BBB通透性增加;其中,补体系统(特别是c5a/c5ar)通过不同的信号通路破坏BBB的完整性,导致诱导型一氧化氮(NO)合酶(iOS)和活性氧的生成增加,同时增加肌动蛋白重组,另外,BBB功能受损过程可能涉及异常的内皮细胞-免疫细胞相互作用,这种机制可能由促炎细胞因子或自身抗体介导,这些细胞因子或自身抗体可上调黏附蛋白的表达,如细胞间黏附分子1(ICAM-1)和血管细胞黏附分子 1(VCAM-1)。(2)脑血管病变:尸体解剖研究表明,血管病变与NPSLE患者的中枢神经系统损伤有关:多灶性微梗死、小血管非炎症性血管病变和闭塞、皮质萎缩和微出血是最常见的病理表现;抗磷脂抗体主要与NPSLE(癫痫、脑梗死)的局灶性表现有关;微血管病变被认为是免疫复合物的沉积和补体激活等途径引起的。(3)血清和脑脊液(Cerebrospinal fluid,CSF)自身抗体介导的损伤脑组织作用:其中,抗核糖体P抗体、抗磷脂抗体和抗神经元抗体的滴度升高被认为是NPSLE的经典标志物;另外还有抗谷氨酸受体抗体(NMDA抗体)、抗甘油醛3-磷酸脱氢酶(GAPDH)抗体、抗内皮细胞抗体(AECAS)等生物标志物被发现与NPSLE相关。(4)细胞因子和趋化因子效应:在SLE中,与无中枢神经系统受累的SLE患者相比,NPSLE患者的脑脊液IL-6和IL-8水平升高;另外还有多种细胞因子有待研究,以上因子可改变体内稳态免疫调节机制,并参与最终导致组织破坏的局部炎症过程;在脑内,常驻小胶质细胞是中枢神经系统的主要免疫细胞,并且是有效的细胞因子产生者,研究发现在患有SLE的患者的血清和海马中I型干扰素的水平升高并且在NPSLE的小鼠模型中诱导小胶质细胞激活[6]。(5)直接的神经细胞损伤和死亡应激因素:各种炎症反应使外周血TNF的产生导致中枢神经系统的NO产生以及临床NPSLE的发展,当大量产生NO时,NO通过各种机制,特别是NMDA受体的直接亚硝基化,诱导中枢神经系统中毒性代谢产物的生成,诱导神经元细胞死亡。
2 NPSLE的临床表现
NPSLE的临床表现多种多样,早在1999年,美国风湿病学会(ACR)[7]描述了19种不同的NPSLE症状,包括12种中枢神经系统和7种周围神经系统症状。有文献[8-9]总结更新了其临床特点:较常见的包括头痛、情绪障碍(抑郁和焦虑)、认知障碍、癫痫发作、脑血管病、精神失常、脊髓疾病还有一些少见的临床表现包括无菌性脑膜炎、急性精神错乱状态、脱髓鞘综合征、运动障碍、周围神经系统症状等;另外还有ACR标准中未包括的狼疮脑病表现,如可逆后部脑病综合征、小纤维神经病变。值得说明的是,许多精神-神经症状可能是糖皮质激素和免疫抑制治疗的副作用,并不是NPSLE的特定表现,诊断NPSLE较有意义的临床特点是认知障碍、癫痫、脊髓病、舞蹈病、低补体水平、狼疮抗凝物、抗Ro/SSA抗体、抗dsDNA和抗 Sm 抗体、血管炎、肾炎[3]。我国有学者[9]通过对80例系统性红斑狼疮患者为研究对象通过Logistic回归分析发现,系统性红斑狼疮患者并发狼疮脑病的高风险因素是肌酐升高、尿红细胞升高、AST升高A/G降低。
3 NPSLE的实验室检查及影像学研究进展
3.1 血清学检查 出现NPSLE是系统性红斑狼疮病情活动的症状之一,故在NPSLE患者中可见典型的红细胞沉降率(ESR)升高,抗双链DNA抗体(抗ds-DNA抗体)滴度升高、补体水平降低等。然而,正常的血清学不排除中枢神经系统狼疮,炎症标志物升高也可能发生在其他导致SLE患者NP症状的情况下,如中枢神经系统感染。抗体在系统性红斑狼疮的发病机制中起着重要作用,目前临床上,常规用于评估NPSLE的自身抗体测试是抗ds-DNA抗体和抗磷脂抗体[10];70%有活动性NPSLE症状的患者可出现血清抗ds-DNA抗体高滴度阳性,但它们对NPSLE的诊断不具有特异性;临床实践中测定的抗磷脂抗体(APL)包括抗心磷脂抗体(ACL)、狼疮抗凝物(LA)和抗β2糖蛋白-1抗体(anti-β2GP-1),另外还有抗核糖体P抗体。他们与局部和弥漫性神经性红斑狼疮表现的关系已经得到了很好的证实,包括中风、癫痫、偏头痛以及认知障碍。其中抗β2糖蛋白-1抗体与顽固性头痛、缺血性中风和癫痫发作有关;而LA似乎主要与癫痫有关。另外,APL抗体与认知障碍之间存在关系,在一项研究中[11],抗磷脂综合征和APL抗体阳性的SLE患者发生认知障碍的风险是健康对照组的3倍。然而,要注意的是,APL阳性测试通常对免疫抑制的决定没有帮助,但这是抗凝治疗的指征。抗核糖体P抗体可能与导致语言记忆、精神运动速度和嗅觉下降相关;它们对NPSLE诊断的敏感性和特异性分别为26%和80%,对精神病和情绪障碍的敏感性和特异性分别为27%和80%[3]。
3.2 脑脊液分析 在30%~90%的活动性NPSLE患者的脑脊液(CSF)中发现有轻微的非特异性异常,典型的是白细胞计数(通常是淋巴细胞)轻微增加,蛋白水平升高,血糖正常。无菌性脑膜炎是罕见的[10],占NPSLE发病率的4.3%,脑脊液常显示正常或仅有轻微的低血糖,淋巴细胞计数低于病毒性脑膜炎。脑脊液异常表明预后更差。总的来说,腰椎穿刺在可能的NPSLE治疗中不是绝对必要的,特别是有明显的SLE活动迹象(如抗ds-DNA抗体升高,补体降低)。然而,如果NPSLE和感染之间的鉴别诊断不清楚,脑脊液分析可能是非常有价值的。
3.3 NPSLE血清学和脑脊液生物标志物研究进展 (1)抗谷氨酸受体抗体是一种与N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDA受体)交叉反应的抗双链DNA抗体,体外研究表明,NMDA抗体通过诱导细胞凋亡来结合和杀死神经元细胞;抗NMDA受体抗体主要分为抗NR1型和抗NR2型,已有大量研究显示抗NR2抗体可在SLE患者的血清和脑脊液中被检测到[10,12],高抗NR2抗体滴度被认为与抑郁症、短期记忆和学习障碍、疲劳严重程度[13]密切相关。(2)NPSLE患者血清和脑脊液中存在抗甘油醛3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体,它们被认为是一种新的标记物,通过干扰GAPDH与神经细胞胞外基质的层粘连蛋白的结合,可能导致情绪变化并损害认知过程,这些自身抗体在精神分裂症患者、严重抑郁症患者和有精神症状的SLE患者中有很高的阳性率,有学者[14]通过酶联免疫吸附测定(ELISA)测定130例SLE患者和55名健康个体的血清中甘油醛3-磷酸脱氢酶自身抗体(抗GAPDH自身抗体)的浓度,在130例SLE患者中包括95例无神经精神症状的SLE患者和35例NPSLE患者;结果发现SLE患者,尤其是NPSLE患者血清抗GAPDH自身抗体水平显着升高;升高的血清抗GAPDH与SLEDAI疾病活动度评分、ESR、IgG和IgM升高相关,并且与颅内压增高和脑血管病变发生率相关,但它对癫痫发作的发生似乎具有保护作用。(3)另外还有一些待研究的抗体如抗内皮细胞抗体(AECAS)、PARP1自身抗体[3]、抗-GABARB1B 和抗-GABARB2抗体[10]、抗 c1q抗体[15]等被发现与 SLE 患者的精神症状相关;对于脊髓疾病的SLE患者,发现抗水通道蛋白-4抗体(NMO-IgG/anti-AQP4抗体)阳性对于诊断视神经脊髓炎有意义[16];有研究[17]发现NPSLE患者中脑脊液中骨桥蛋白(protein of osteopontin)浓度显着高于非NPSLE患者,当脑脊液中骨桥蛋白的截止值设定为963.4 ng/mL时,NPSLE诊断的敏感性和特异性分别为70%和100%。(4)还有研究发现NPSLE患者中出现细胞因子/趋化因子水平的增高,如YOSHIO等[18]发现脑脊液(CSF)中 IL-6,IL-8,IP-10,MCP-1,G-CSF 和 GMCSF的平均浓度分别高于血清,其中脑脊液IL-6浓度的升高或许可作为早期诊断NPSLE的证据。还有研究[19]发现CNS-NPSLE组血清和脑脊液中IL-1β,IL-6,IL-8和IFN-γ水平明显高于正常对照组,其中CNS-NPSLE脑脊液中IL-6和IFN-γ的阳性率出现多发性缺血灶的患者显着高于MRI检查结果正常者,说明一些细胞因子参与NPSLE的发病并与脑MRI病变相关。
3.3 影像学检查 (1)计算机辅助断层扫描(CT):CT在NPSLE中不是一个可靠的工具;它的主要用途是在中风的急性表现期间使其与梗死和出血相鉴别。(2)磁共振成像(MRI):磁共振成像仍然是首选的成像方式[10];当怀疑中枢神经系统性红斑狼疮时,它仍然是首选的方法和最常用的技术,因为它具有极好的诊断脑梗死、脑出血和横断性脊髓炎的能力,并可以排除感染性疾病,如脑脓肿、脑膜炎和支原体动脉瘤[4]。但没有有力的证据支持NPSLE的MRI特异性异常表现;在SLE患者中最常见的脑MRI异常是是额顶叶分布的高白质信号(8% ~75%的患者)和脑萎缩(9% ~67%)[20];用于检测结构异常的更先进的MRI方法包括磁化转移成像(MTI)、弥散加权成像(DWI)和弥散张量成像(DTI);磁共振血管成像(magnetic resonance angiograph,MRA)可以清晰地显示颅内血管病变,发现血管狭窄或闭塞等。在一项回顾性研究中[21],40%的NPSLE患者脑MRI检查完全正常,其余60%中最常见的异常是微血管病,主要发生在额叶和枕叶区,这与认知功能障碍、低CH50和LA抗体相关;共有13.7%的NPSLE有微出血和11.1%的患者出现腔隙性梗死的证据,与LAC相关。(3)质子磁共振波谱(proton magnetic resonance spectroscopy,MRS):这项技术是一项非侵入性测试,允许对神经元代谢物浓度进行化学特异性、非侵入性测量;与健康对照组相比,SLE和NPSLE患者的NAA(N-乙酰天冬氨酸)水平较低,MI(星形胶质细胞中的肌醇)水平较高,这表明神经功能和胶质细胞活化降低;与SLE不伴神经-精神症状患者相比,NPSLE患者的NAA变化较低,而且疾病活动度较高;还有一项研究报告,与健康对照相比,NP-SLE中胶质代谢物的扩散性增加,而神经元代谢物没有伴随的变化,表明神经胶质受累[22]。MRS、MTI、DTI是评估脑组织损伤的有用且创新的技术,但由于其成本高、识别NPSLE表现和其他脑损伤原因的能力低,目前仍不适用于日常临床实践[4]。(4)功能性磁共振成像(functional magnetic resonance imaging,FMRI)是一种利用磁振造影来测量神经元活动所引发之血液动力的改变的新兴的神经影像学方式,研究发现大部分SLE患者大脑激活状态增加,其与认知和情感活动异常相关,小脑低激活状态是非NPSLE患者在使用静息状态FMRI时的常见和主要表现,特别是在双侧后叶(小脑的第一和第二小腿),以及左额叶回、左前叶、右边缘叶和后扣带回;但FMRI对于NPSLE患者的应用前景还有待考证[23]。(5)正电子发射断层扫描(PETCT)和单光子发射计算机断层扫描(SPECT):PETCT被广泛认为是临床上一种非常有用的神经成像工具,特别是在肿瘤学中,已开发出对肿瘤具有高度特异性的放射配体,并可提供疾病早期存在肿瘤的早期重要信息;对SLE和NPSLE的正电子发射断层扫描研究显示了其潜在的有用性,特别是对18F-FDG(氟脱氧葡萄糖)的研究显示,在神经炎症反应中,局部代谢增加,并且与炎症状态相关;结合转运蛋白的正电子发射断层扫描放射配体目前正被认为可能是炎症反应中小胶质细胞激活的潜在标记物,并可能为NPSLE的神经炎症提供额外的探针;单光子发射计算机断层扫描(SPECT)也已用于SLE患者;一些SPECT研究报告了NPSLE患者的大脑局部血流减少;用18-FDG检测到的葡萄糖摄取与血流密切相关,因为它们都受细胞代谢的调节;一些18-FDG PET研究报告了NPSLE的脑部局部代谢减弱,但其他研究也提供了白质区葡萄糖代谢增加的证据,与炎症反应一致[22]。
3.4 电生理学研究(Electrophysiological studies)包括脑电图、肌电图、神经电图等。脑电图主要用于研究癫痫发作,并检测异常的神经电生理活动。在一项对1 533例SLE患者和207例(60%归因于SLE)各种周围神经病变的研究中,发现70%的患者出现轴突神经病变,20%的患者出现脱髓鞘病变[24]。
3.5 神经心理学评估 当临床出现疑似精神症状时,应进行正式的神经心理学测试,如蒙特利尔认知评估(MOCA)、认知症状清单(CSI)和自主神经心理评估指标(ANAM)等。没有一种简单的认知功能障碍筛查方法可用于SLE患者,因为大多数此类检测缺乏对轻度但与临床相关的功能障碍的敏感性,但正式测试仍然是诊断认知障碍的唯一确定方法;因此,怀疑认知障碍的患者应参考能力进行完整的神经心理学评估[2]。
3.6 超声检查 当神经症状存在时,使用非侵入性诊断相对便宜、可重复和便携式技术,如超声心动图、颈部彩色多普勒(CDS)和经颅多普勒(TCDs)排除可能源于心脏改变、大血管和微血管改变导致中枢神经系统性红斑狼疮的原因[4]。
4 NPSLE的诊断
NPSLE是SLE的严重并发症。NPSLE的特征在于涉及中枢和/或外周神经系统的各种神经系统表现,并且诊断对于整个医学界来说一直是一项艰巨的挑战。为了简化这种狼疮伴随综合征的诊断和治疗,美国风湿病学会(ACR)于1999年提出了一种分类和命名系统,其中包括19种神经系统表现,包括12种中枢神经系统表现和7种周围神经系统表现[7]。一般认为,当SLE患者出现神经、精神症状后,除外其他原因如心血管疾病、继发颅内病变、药物副作用、感染、肿瘤及代谢紊乱等所导致的神经症状和精神异常,借助如脑电图异常、血清学和脑脊液改变、MRI或CT检查异常、心理评估等辅助检查,进而诊断NPSLE。然而由于NPSLE的所有表现都不是疾病特异性的,因此对NPSLE患者的诊断评估应与其他疾病的诊断评估同时进行,为此,ZARDI等[25]提出了一种新的诊断流程帮助临床 NPSLE的诊断(图1)[4,25],不过重要的是,尽管NPSLE的神经影像学支持诊断并有助于排除其他原因,但另一方面,医师的知识和经验仍然是目前参考的“黄金标准”。
5 NPSLE的治疗
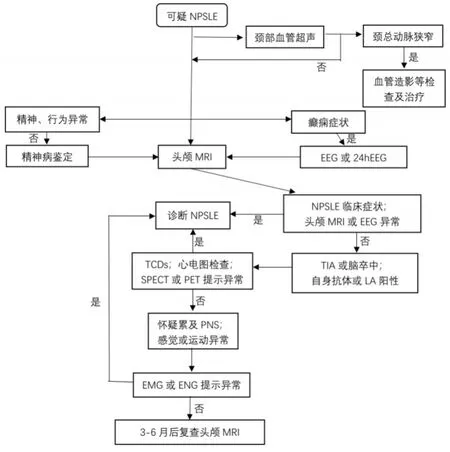
图1 NPSLE的诊断流程Fig.1 Diagnostic process for NPSLE
SLE患者的器官受累通常用大剂量激素、环磷酰胺、霉酚酸酯和硫唑嘌呤治疗,病情危重、免疫抑制剂治疗效果欠佳时,可以考虑血浆置换、免疫球蛋白冲击治疗等;类似的治疗策略也适用于NPSLE患者,其中激素剂量的具体选择是基于临床医生对疾病严重程度的评估及其临床经验,对于NPSLE,除了以上针对SLE疾病的免疫抑制治疗外,还需对症支持治疗治疗:如纠正高血压和代谢紊乱;治疗癫痫发作的抗癫痫药;以及针对精神症状的抗焦虑药、抗抑郁药、情绪稳定剂或抗精神病药(视情况而定),伴随血栓形成的神经精神疾病的治疗还需要抗凝治疗,如合并抗磷脂综合征则建议终身的抗凝治疗[2]。利妥昔单抗是一种作用于表达CD20的B细胞的一种人鼠嵌合单克隆抗体,近年来在多种免疫性疾病的临床研究中均取得良好疗效,利妥昔单抗似乎对难治性NPSLE的效果显著:对10例难治性NPSLE患者进行了利妥昔单抗的疗效评估,这些患者在临床体征和症状以及放射学检查方面都有了显著和快速的改善;利妥昔单抗对NPSLE患者的回顾性研究也是有效且相当安全的[26];另外利妥昔单抗可能有益于其他炎症性神经系统疾病,如视神经脊髓炎、脑炎和眼阵挛-肌阵挛综合征等[27]。鞘内注射(一般使用地塞米松和甲氨喋呤)似乎也是一种可以改善NPSLE的治疗方法,赵文敏等[28]在一项纳入50例NPSLE患者的短期疗效研究中发现甲强龙冲击疗法联合鞘内注射治疗狼疮脑病较单纯使用激素冲击治疗组不良反应更少,病死率更低。目前对NPSLE药物治疗的研究,由于其在症状、病因方面的挑战,而且往往具有严重的表现,很难执行,因此很少有研究。目前仍正在研究一些可能被证明是有前景的药剂。许多系统性红斑狼疮患者表现出I型干扰素(IFN)特征,IFNα水平与疾病严重程度呈正相关,我国的凌磊等[29]再次证实了这个结论。Ⅰ型干扰素受体拮抗剂阿尼弗洛单抗(Anifrolumab)在一项针对SLE患者的Ⅱb期试验中显示了一些成功[30]:在中重度系统性红斑狼疮患者的多个临床终点中,阿尼弗洛单抗与安慰剂相比显著降低了疾病活动性,但该研究并未纳入NPSLE的患者。另外,近期在一项纳入了具有NPSLE特征的MRL/lpr小鼠的试验中发现[31],给予抗原性I型干扰素受体抗体处理的小鼠与未予特殊处理的对照组小鼠相比,其抑郁表现和认知功能障碍的症状没有明显改善。目前来说,Ⅰ型干扰素受体拮抗剂需要更多的临床研究考证其对NPSLE的疗效。
6 总结及展望
NPSLE在SLE患者中发病率高,是导致系统性红斑狼疮患者死亡和预后不良的重要原因,但在对NPSLE发病机制及其临床治疗的基本认识上还存在许多空白。由于NPSLE的体征和症状差异很大,而且往往是非特异性的,因此很难明确地将其归因于SLE;实际上,还没有“金标准”诊断方法。此外,SLE患者神经精神疾病的发病机制可能是多方面的、复杂的,NPSLE的免疫病理机制仍有待积极探索。目前的治疗策略主要是基于经验性的,基于已知的免疫致病机制和从治疗其他严重的系统性红斑狼疮器官疾病中观察到的。对新的靶向治疗和改进的诊断工具的一些有前景的研究工作仍在继续,仍有许多工作要做,以优化临床医生诊断、预测和治疗NPSLE的能力。

