电针联合运动对慢性阻塞性肺疾病肌营养不良大鼠骨骼肌萎缩的调节作用
何颖 李桂元 刘昌盛 孔祥翱 童娟
1广州医科大学附属第一医院中医科(广州510120);2广东省中医院神经六科(广州510120)
慢性阻塞性肺病(chronic obstructive pulmonary disease COPD)有气流受限特征,其中肺外损害严重影响患者生存质量[1]:在疾病中后期,炎症、年龄等导致的骨骼肌萎缩[1]会限制呼吸功能而出现生存率下降[2]。此病发病机制强调“全身炎症”或“恶病质状态”,炎症因子通过细胞内蛋白质降解途径—泛素蛋白酶体途径(Ubiquitin proteasome pathway,UPP)影响肌肉蛋白分解[3]造成骨骼肌萎缩。研究显示针刺调节运动后骨骼肌微结构[4]、抑炎[5]及调控UPP信号蛋白而促进肌萎缩修复[6],电针配合运动使COPD患者达至有效运动强度而改善呼吸能力[7],由此推测电针配合运动通过调节炎症因子及UPP信号蛋白维持肌肉量及收缩能力而提升呼吸及运动能力,研究此法增效作用有利于建立更有效的呼吸康复方案。本研究观察COPD肌营养不良大鼠体质量、炎症因子及UPP信号蛋白变化,确定电针联合运动对模型大鼠的疗效,为COPD骨骼肌萎缩康复提供证据。
1 材料与方法
1.1 动物及分组 研究通过广州医科大学动物伦理委员会审批,编号2017-314。40只6周龄SPF级雄性SD大鼠,体质量(190±10)g,由广州中医药大学实验动物中心提供,生产许可证号SCXK(粤)2013-0034。饲养于广州中医药大学实验动物中心SPF级动物房,使用许可证号SYXK粤2013-0085,温度(23±1)℃,12 h明暗交替环境中适应性喂养1周。大鼠按随机数字表平均分为:空白组、模型组、电针组、运动组、电针+运动组。
1.2 试剂及仪器 3%戊巴比妥钠(广州呼吸疾病研究所),总RNA提取试剂盒(上海Promega公司),反转录试剂盒(Thermo公司),0.25 mm×40 mm毫针(苏州华伦医疗用品有限公司),G6805-I型电针治疗仪(青岛鑫升实业有限公司),烟熏箱自制,DF-110型电子天平(德国Sartorius公司),FINE POINTETMPFT型小动物肺功能仪(美国Buxco公司),LX-100离心机(江苏海门其林贝尔仪器有限公司),JS-680A自动凝胶图像分析仪(上海培清科技有限公司),Step One QPCR仪(Applied Biosystems)。
1.3 造模 烟熏法[8]造模:空白组以外大鼠置烟熏箱内,红梅香烟点燃后开放气孔。烟雾暴露1 h后泵入新鲜空气15 min后取出大鼠。首天每次3根香烟,隔日增加1根,10根为止,每周6 d,每天2次,每次间隔4 h以上,持续80 d。期间自由摄食饮水活动。造模成功判定:模型大鼠体质量低于空白组90%视为营养不良[9],肺功能变化作为COPD大鼠造模成功依据。
1.4 干预方法 空白组与模型组:不干预。电针:烟熏后对电针组、电针+运动组予电针,隔日1次,共20次,按《实验针灸学》[10]选“膻中、气海、中脘、梁门、曲池(双)”针刺,留针10 min,接电针仪,连续波,频率4 Hz。运动:烟熏后对运动组、电针+运动组予游泳训练,每次10 min,隔日1次,共20次。置大鼠于水箱内自主游泳,期间注意观察后肢是否触及池底,必要时以圆棒驱赶使保持活动。
1.5 观察指标与检测方法
1.5.1 一般情况 呼吸、饮食、精神等,每周测量体质量及体长。
1.5.2 肺功能 末次治疗后禁食1 d,1.25 mL/400 g 3%戊巴比妥钠腹腔注射深麻,气管切开插管连接肺功能仪,检测吸气阻力(inspiratory resistance RI)、功能残气量(functional residual capacity FRC)、肺动态顺应性(dynamic lung compliance Cydn)。
1.5.3 酶联免疫吸附测定 ELISA法检测血清肿瘤坏死因子(TNF-α)、白介素(IL)-6、IL-1β含量。
1.5.4 实时定量聚合酶链反应 qPCR法检测股外侧肌MuRF1、Atrogin-1、MyoD及IL-1β含量。
1.6 统计学方法 SPSS23进行统计分析。数据以均数±标准差表示。满足正态分布计量资料组间比较用单因素方差分析LSD法,非正态分布计量资料用非参数检验Kruskal-WallisH法。以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 见表1。
2.2 体质量比较 表2提示:烟熏后,其余4组体质量低于空白组90%,差异有统计学意义(P=0.023、0.002、0.034、0.033),说明大鼠出现肌营养不良,造模成功。干预后,治疗组较模型组无明显变化(P=0.112、0.9、0.486)。治疗组组间比较,其余两组高于电针组(P=0.046、0.043)。

表1 一般情况Tab.1 General conditions
表2 体质量Tab.2 Weight ±s,g

表2 体质量Tab.2 Weight ±s,g
注:*与空白组比较,P<0.05;#与电针组比较,P<0.05
组别 例数 造模前 造模后 治疗后空白组模型组电针组运动组电针+运动组8 8 8 8 8 209.38±16.89 204.34±11.76 192.14±5.99 206.98±13.43 205.29±12.91 485.80±48.30 399.70±35.90*395.70±26.20*402.30±27.70*400.10±21.50*506.40±32.60 456.4±49.60 428.5±40.70 476.50±53.30#465.80±26.80#
2.3 肺功能指标比较 表3提示:模型组RI、FRC高于空白组,Cydn低于空白组(均P<0.001),说明模型组气道阻力上升,符合COPD病理特点。治疗组RI及FRC低于模型组(P=0.002、0.017、0.006、0.003、0.027、0.004),组间比较差异无统计学意义(P=0.406、0.791、0.589、0.357、0.956、0.401)。所有组Cydn高于模型组,但差异无统计学意义(P=0.171、0.235、0.253)。
表3 肺功能指标Tab.3 Pulmonary function indicators ±s
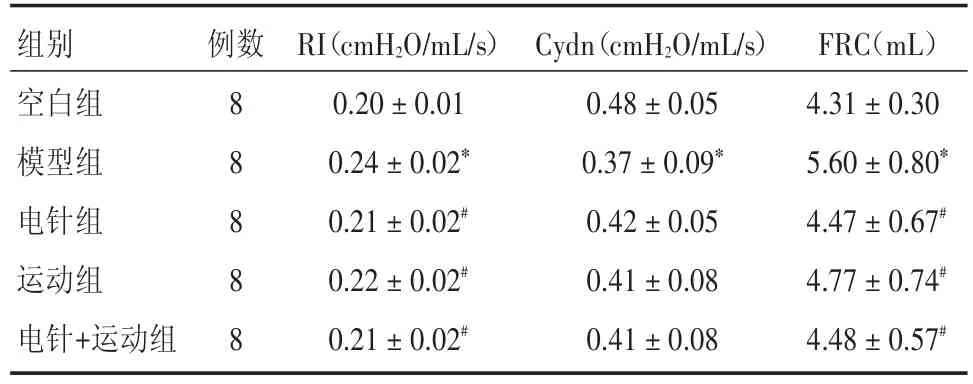
表3 肺功能指标Tab.3 Pulmonary function indicators ±s
注:*与空白组比较,P<0.05;#与模型组比较,P<0.05
组别空白组模型组电针组运动组电针+运动组例数8 8 8 8 8 RI(cmH2O/mL/s)0.20±0.01 0.24±0.02*0.21±0.02#0.22±0.02#0.21±0.02#Cydn(cmH2O/mL/s)0.48±0.05 0.37±0.09*0.42±0.05 0.41±0.08 0.41±0.08 FRC(mL)4.31±0.30 5.60±0.80*4.47±0.67#4.77±0.74#4.48±0.57#
2.4 血清TNF-α、IL-6、IL-1β含量比较 表4提示:模型组血清炎症因子高于空白组(均P<0.001)及各治疗组(P< 0.001、0.007、0.001、0.01、0.031、0.015、0.007、0.046、0.021);电针组TNF-α低于运动组(P=0.026),其余治疗组间比较差异无统计学意义(P=0.549、0.11、0.63、0.934、0.702、0.44、0.733、0.683),说明干预均降低血清炎症因子,电针下调TNF-α能力较强。
表4 TNF-α、IL-6和IL-1β含量Tab.4 TNF-α,IL-6 and IL-1β levels ±s
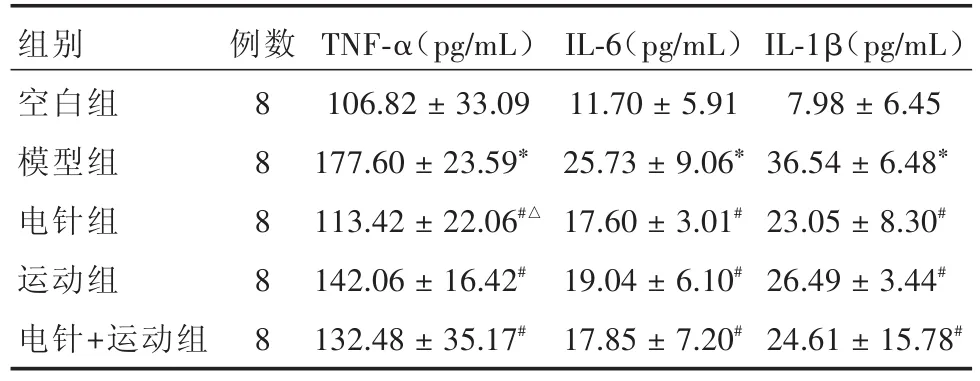
表4 TNF-α、IL-6和IL-1β含量Tab.4 TNF-α,IL-6 and IL-1β levels ±s
注:*与空白组比较,P < 0.05;#与模型组比较,P < 0.05;△与运动组比较,P<0.05
组别空白组模型组电针组运动组电针+运动组例数8 8 8 8 8 TNF-α(pg/mL)106.82±33.09 177.60±23.59*113.42±22.06#△142.06±16.42#132.48±35.17#IL-6(pg/mL)11.70±5.91 25.73±9.06*17.60±3.01#19.04±6.10#17.85±7.20#IL-1β(pg/mL)7.98±6.45 36.54±6.48*23.05±8.30#26.49±3.44#24.61±15.78#
2.5 股外侧肌Atrogin-1、MuRF-1、MyoD及IL1β含量比较 Atrogin-1、MuRF-1、MyoD及IL1β电泳见图1,PCR见图2-5。表5提示:电针、运动组Atrogin-1高于模型组(P=0.024、0.025),电针+运动上调最少,明显低于电针组(P=0.049);治疗组MuRF-1较模型、空白组无明显变化(P=0.234、0.371、0.933、0.795、0.790、0.535);治疗组MyoD低于模型组(P=0.003、0.03、0.003),组间比较差异无统计学意义(P=0.383、0.969、0.362);治疗组IL1β低于模型组(P=0.007、0.01、0.007),电针、电针+运动下调更显著(P=0.007、0.007)。
表5 Atrogin-1、MuRF-1、MyoD及IL1β含量Tab.5 Atrogin-1,MuRF-1,MyoD and IL1β levels ±s

表5 Atrogin-1、MuRF-1、MyoD及IL1β含量Tab.5 Atrogin-1,MuRF-1,MyoD and IL1β levels ±s
注:*与空白组比较,P < 0.05;△与电针组比较,P < 0.05;#与模型组比较,P<0.05
组别空白组模型组电针组运动组电针+运动组例数8 8 8 8 8 Atrogin-1 1.92±1.49 0.47±0.48#3.74±5.12△3.73±2.91△0.92±0.54#MuRF-1 1.35±0.89 1.85±1.68 3.15±5.93 1.48±0.74 0.95±0.86 MyoD 1.21±0.83 2.16±2.08 0.52±0.16△0.98±0.42△0.50±0.36△IL1β(pg/mL)1.64±1.72△8.24±11.03*0.87±1.07△1.27±1.27△0.89±1.24△
3 讨论
COPD患者体内TNF-α、IL-1等炎症因子可致全身炎症[11],激活NF-κB使其进入UPP上调atrogin-1和MuRF1致骨骼肌蛋白降解增加[12]。
本研究除电针外的方法均增加体质量,提示电针与运动防治肌萎缩机制不同。干预均下调血清炎症因子及肌肉IL-1β,电针下调TNF-α最显著,电针+运动、电针下调IL-1β较突出,提示电针+运动及电针均有抑炎效果。3种方法对肺功能有逆转,提示电针和运动改善炎症而提升肺功能。
图1 琼脂电泳Fig.1 Agarose gel
Atrogin-1在肌萎缩中上调[11]。COPD患者骨骼肌Ⅰ型肌纤维(耐疲劳)比例降低,Ⅱ型肌纤维(极易疲劳)比例增加致肌肉疲劳且运动耐力下降[13]。研究[14-15]发现COPD患者和模型大鼠骨骼肌Ⅱ型纤维Atrogin-1低于正常组,Ⅰ型纤维高于或无异于正常组。本研究未分析肌纤维亚型蛋白表达。综上可知模型组Atrogin-1低于空白组不排除Ⅱ型纤维比例增加。COPD恶液质患者运动后Atrogin-1、MuRF-1上调由于蛋白质合成与分解均被激活,肌肉减少更取决于蛋白质合成障碍[16-19]。本研究大鼠为恶液质,推断干预作用靶点更多在蛋白质合成通路上,Atrogin-1因激活骨骼肌蛋白分解反而出现上调。电针+运动上调最少,激活蛋白分解作用最小,提示抑制骨骼肌降解。MuRF-1亦为UPP连接酶,干预后未有明显变化,原因同上。提示研究骨骼肌不良状态的调节作用应同时关注蛋白分解与合成。
图2 Atrogin-1扩增及溶解曲线图Fig.2 Atrogin-1 amplification+melt curves

图3 MuRF-1扩增及溶解曲线图Fig.3 MuRF-1 amplification+melt curves
图4 MyoD扩增及溶解曲线图Fig.4 MyoD amplification+melt curves

图5 IL-1β扩增及溶解曲线图Fig.5 IL-1β amplification+melt curves
MyoD主导成肌细胞分化,肌肉损伤后18 h可被检测,48 h后达高峰,14 d减少[20]。干预均下调MyoD,可认为造模后短期内MyoD升高,干预缓解肌球蛋白丢失,增加肌细胞修复而出现后续MyoD下降,表明干预能减轻肌萎缩。
膻中、气海引肺气下行。中脘、曲池、梁门健运脾胃,充养四肢。体质量、Atrogin-1、MyoD及IL-1β的变化提示电针加运动能促进大鼠体质量增加、抗炎及抑制骨骼肌降解,但由于肺功能改善比较无差异,未能得出通过抑制骨骼肌降解促进肺康复的结论。
本研究无法根据目标心率及运动心率变化调整运动阻力[7]制定个性化方案,日后可分析骨骼肌纤维亚型蛋白、优化骨骼肌合成障碍研究探讨电针对肌蛋白合成的靶点调节机制、对运动进行阻力分级,细化输出参数、延长干预周期,增加肺功能指标,更深入研究电针联合运动的作用机制及协同效果从而优化肺康复方案,为临床服务。

