针刺对实验性自身免疫性脑脊髓炎小鼠磷酸化P38丝裂原活化蛋白酶的影响
宋方亚,辛祺亮,赵东杰,李 琪,王玉华,董 莎,辛随成*
(1. 北京中医药大学针灸推拿学院 北京 100029;2. 北京中医药大学东方学院 廊坊 065001)
多发性硬化(Multiple sclerosis,MS)是一种自身免疫性疾病,其主要病理特征为中枢神经系统炎性脱髓鞘,主要累及白质区域,其发病可能与免疫反应、病毒感染、环境及遗传等多种因素有关,世界范围内大约有250 万MS 患者[1],患者可见感觉异常、肢体瘫痪、视力减退及共济失调等症状,具有较高的发病率和致残率。急性发作期MS 常用大量甲泼尼龙进行冲击治疗,复发型MS 常用干扰素或其他免疫抑制剂控制疾病发展。针刺可改善MS 神经功能损伤,降低MS 复发率,提高MS 患者生活质量,可作为MS 的补充治疗手段[2]。
p38MAPK 信号通路参与调节细胞生长、分化和凋亡,也参与炎症反应的过程。研究发现,p38MAPK 对CD4+T 细胞、小胶质细胞、少突胶质细胞均有调节作用,影响炎性因子的产生以及神经细胞修复过程,进而参与MS 的发病过程[3-4]。实验性自身免疫性脑脊髓炎(Experimental autoimmune encephalomyelitis,EAE)与MS 具有相似的临床症状与生理病理变化,目前通常通过干预EAE 模型对MS 进行研究。本实验通过观察针刺针刺对EAE 小鼠体重及神经功能损伤的影响,对EAE 小鼠脑干内p-p38MAPK 含量的影响,验证针刺对EAE 小鼠的治疗作用,探究针刺治疗MS 的作用途径。
1 材料与方法
1.1 实验动物
8 周龄雌性C57BL/6 小鼠40 只,体重18~20 g,购于北京维通利华实验动物有限公司,动物批号SCXK(京)20160006。饲养于北京中医药大学SPF 级动物房,室温20℃~24℃,相对湿度30%~50%,12 小时周期明暗交替。适应性喂养1周。
1.2 主要试剂
MOG35-55 多肽(北京百诺威生物有限公司,批号NJP30376),完全弗氏佐剂(结核杆菌H37Ra 终浓度为4 mg/mL 北京华菁科技有限公司,批号170597),百日咳毒素(北京百诺威生物有限公司,批号181236A1),5 mg/片醋酸泼尼松(上海上药信谊药厂有限公司,批号017171002),0.25 mm × 25 mm 针灸针(北京中研太和医疗器械有限公司),磷酸化p38MAPK抗体(英国abcam公司,批号ab47363)。
1.3 动物分组
将40 只C57BL/6 小鼠称重编号,用随机数字表分成空白组、模型组、针刺组、激素组,每组10 只。空白组小鼠不做处理,其余组小鼠均制备成EAE小鼠。
1.4 动物模型制备
将抗原MOG35-55 用生理盐水稀释至浓度为10 mg/mL,并与完全弗氏佐剂按等体积混合,用注射器反复推拉,混合均匀,制备成油包水的乳剂,制成完全抗原。取模型组、针刺组、激素组小鼠,先将小鼠进行乙醚麻醉及充分固定,每只小鼠脊柱两侧分4 点皮下注射0.1 mL 抗原。在注射抗原后即刻以及注射抗原后第48小时,每只小鼠分别予500 ng百日咳毒素进行皮下注射,制备EAE 小鼠。空白组注射等体积生理盐水。
1.5 模型评价
造模及干预过程中各组小鼠无死亡。免疫后各组小鼠均出现体重减轻、食欲减退、精神萎靡、动作笨拙,发病率为100%(30/30)。
每日记录神经功能评分,参考国际通用的5 分评分制[5]:0分:无症状;1分:尾张力消失,轻度步态笨拙;2 分:一侧后肢无力,被动翻身后恢复;3 分:双后肢瘫痪,刺激后可挪动;4 分:双后肢瘫痪伴有前肢瘫痪;5分:濒死状态或死亡。其中,症状在两者之间者,以±0.5分计算。隔日测量记录小鼠体重。
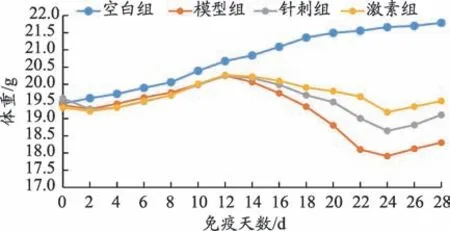
图1 各组小鼠免疫第0天至第28天体重变化
1.6 干预方法
造模后第14 天起,各组连续干预15 天。空白组和模型组每天进行抓取、固定,给予0.1 mL/10 g 生理盐水灌胃。针刺组使用0.25× 25 mm 毫针,针刺小鼠“大椎”(背部正中第7 颈椎与第1 胸椎之间),直刺2~3 mm;双侧“肾俞”(第2 腰椎下两旁),向脊柱斜刺2~3 mm;双侧“足三里”(膝关节下外侧腓骨小头下3.5 mm),直刺2~3 mm,每次留针15min。激素组进行醋酸泼尼松药液(0.6 mg/mL,)灌胃,0.1 mL/10 g/天。
1.7 检测指标
免疫后第28 天,每组随机选取3只小鼠,多聚甲醛缓冲液进行心脏灌注,沿大脑冠状面在视交叉水平向后取3~4 mm 组织块,制备石蜡切片,进行LFB 髓鞘染色,每只小鼠取3张切片进行p-p38MAPK 免疫组化检测。剩余7 只小鼠处死后取脑干组织,进行pp38MAPK的WB检测。
1.8 统计方法
采用sas 8.2 统计软件进行分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间多重比较方差齐采用LSD 检验,方差不齐时用Welch检验。以P<0.05为差异有统计学意义。
2 实验结果
2.1 各组小鼠体重比较
本次实验共40 只小鼠,实验过程中无小鼠死亡,且30 只小鼠全部造模成功。由图1 可以看出,空白组小鼠免疫第0 天(即模型制备当天)至免疫第28 天体重持续增加。模型组、针刺组、激素组小鼠免疫第0天至第12天左右体重持续增加,且与空白组变化趋势相似;免疫第12 天至第24 天,三组小鼠体重均下降,模型组小鼠体重下降最明显,针刺组次之,激素组体重下降最少;免疫第24 天至第28 天,三组小鼠体重逐渐增加,但在实验结束时并未超过各组第12天时的体重最高值。
表1 各组小鼠平均体重比较(±s,g)
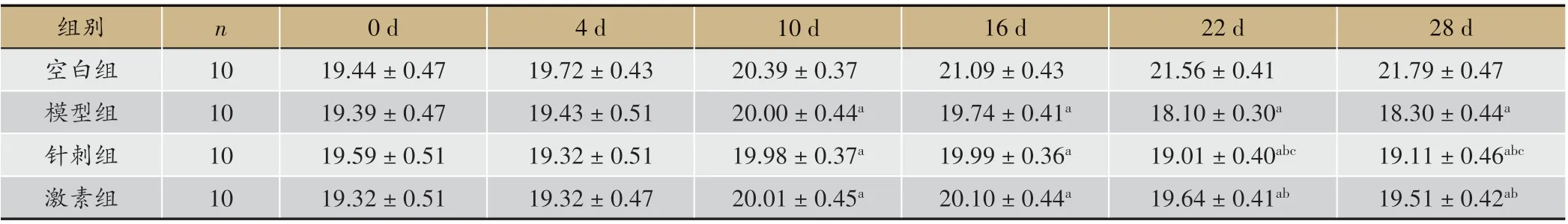
表1 各组小鼠平均体重比较(±s,g)
注:与空白组相比,aP<0.05;与模型组相比,bP<0.05;与激素组相比,cP<0.05
28 d 21.79±0.47 18.30±0.44a 19.11±0.46abc 19.51±0.42ab组别空白组模型组针刺组激素组n 10 10 10 10 0 d 19.44±0.47 19.39±0.47 19.59±0.51 19.32±0.51 4 d 19.72±0.43 19.43±0.51 19.32±0.51 19.32±0.47 10 d 20.39±0.37 20.00±0.44a 19.98±0.37a 20.01±0.45a 16 d 21.09±0.43 19.74±0.41a 19.99±0.36a 20.10±0.44a 22 d 21.56±0.41 18.10±0.30a 19.01±0.40abc 19.64±0.41ab
表2 各组小鼠神经功能评分比较(±s)
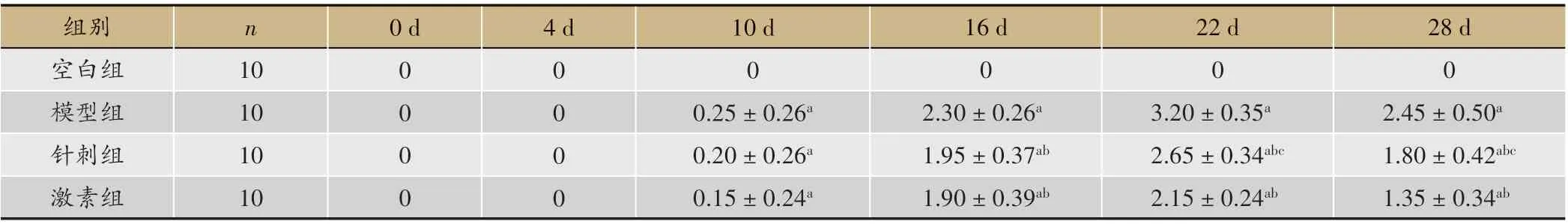
表2 各组小鼠神经功能评分比较(±s)
注:与空白组相比,aP<0.05;与模型组相比,bP<0.05;与激素组相比,cP<0.05
28 d 0 2.45±0.50a 1.80±0.42abc 1.35±0.34ab空白组模型组针刺组激素组10 10 10 10 0 d 4 d 10 0 0 0 0 0 0 0 0 0 0.25±0.26a 0.20±0.26a 0.15±0.24a 0 2.30±0.26a 1.95±0.37ab 1.90±0.39ab 0 3.20±0.35a 2.65±0.34abc 2.15±0.24ab组别n d 16 d 22 d
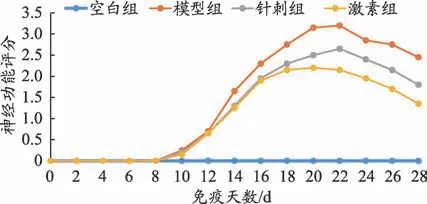
图2 各组小鼠免疫第0天至第28天神经功能评分变化
由表1 可以看出,实验开始时四组小鼠体重无差异(P>0.05);免疫第10天,空白组小鼠体重大于模型组、针刺组、激素组(P < 0.05),模型组、针刺组、激素组三组小鼠体重无差别(P>0.05);免疫第22天以后,模型组小鼠体重小于针刺组、激素组(P<0.05),且激素组小鼠体重大于针刺组(P<0.05)。
2.2 各组小鼠神经功能评分比较
模型组、针刺组、激素组小鼠逐渐出现精神萎靡、尾张力减弱、肢体活动不利甚至瘫痪等症状。由图2可以看出,空白组小鼠由于未造模,神经功能无损伤,整个实验过程中神经功能评分为0;免疫第0 天至第10 天模型组、针刺组、激素组小鼠未出现神经功能损伤症状,评分为0;免疫第10天后模型组、针刺组、激素组小鼠开始出现神经功能损伤症状,神经功能评分开始持续升高;免疫第20 天,激素组小鼠的评分开始持续下降;免疫第22 天,模型组和针刺组小鼠评分开始持续下降;免疫第28天实验结束时模型组、针刺组、激素组小鼠评分较各组最高峰时评分均下降,但并未降至0。
由表2 可以看出,免疫第10 天,模型组、针刺组、激素组的神经功能评分无差异(P > 0.05);免疫第16天,针刺组和激素组神经功能评分低于模型组(P <0.05),针刺组和激素组神经功能评分未出现差异(P>0.05);免疫第22 天以后,针刺组神经功能评分高于激素组(P<0.05)。
2.3 各组小鼠LFB髓鞘染色结果
空白组脑组织形态正常,髓鞘致密,排列整齐,无空泡样改变,未见脱髓鞘。模型组髓鞘排列不整齐,有大片脱髓鞘区域,空泡样改变明显,针刺组和激素组可见髓鞘排列不整齐,部分区域可见脱髓鞘及空泡样改变,脱髓鞘情况较模型组轻,空泡样改变较模型组少,见图3。
2.4 各组小鼠脑组织p-p38MAPK免疫组化表达
空白组小鼠脑组织p-p38MAPK 水平较其他三组低(P < 0.05)。针刺组、激素组小鼠脑组织pp38MAPK 水平较模型组低(P<0.05)。针刺组小鼠脑组织p-p38MAPK 水平与激素组差异不明显(P >0.05)。见表3。
p-p38MAPK 主要存在于EAE 小鼠脑组织胞浆内,免疫组化阳性表达为黄色或棕黄色颗粒。空白组小鼠脑细胞形态规则,染色为多为蓝色,胞浆内可见少量黄色颗粒。模型组小鼠脑细胞体积增大,形态不规则,胞浆呈深黄褐色。针刺组及激素组小鼠脑细胞形态较规则,胞浆染色程度较空白组深,较模型组浅。见图4。

图3 各组小鼠脑组织LFB染色病理片(LFB×400)
表3 各组小鼠脑组织免疫组化p-p38MAPK平均积分光密度IOD值(±s)
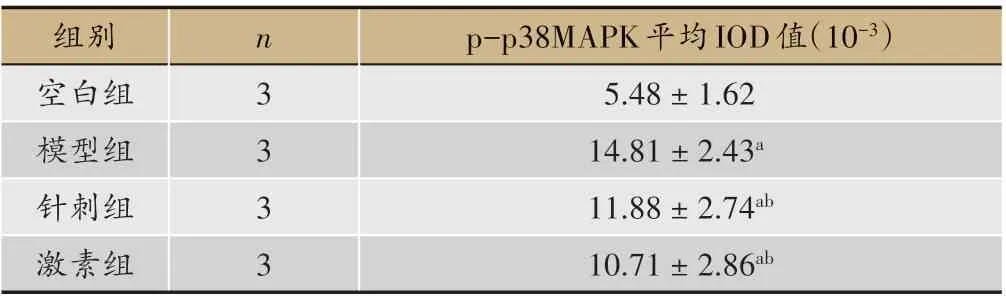
表3 各组小鼠脑组织免疫组化p-p38MAPK平均积分光密度IOD值(±s)
注:与空白组相比,aP<0.05;与模型组相比,bP<0.05
p-p38MAPK平均IOD值(10-3)5.48±1.62 14.81±2.43a 11.88±2.74ab 10.71±2.86ab组别空白组模型组针刺组激素组n 3 3 3 3
2.5 各组小鼠脑组织p-p38MAPK蛋白WB检测
空白组小鼠脑组织p-p38MAPK 水平较其他三组低(P < 0.05)。针刺组、激素组小鼠脑组织pp38MAPK 蛋白水平较模型组低(P<0.05)。针刺组小鼠脑组织p-p38MAPK 蛋白水平与激素组差异不明显(P>0.05)。见表4、图5。
3 讨论
MS 是发生在中枢神经系统(central nervous system,CNS)由自身免疫反应介导的神经脱髄鞘疾病。病理表现为CNS 内散在的多区域白质髓鞘脱失,最常累及脑室周围白质、视神经、脊髓、脑干等部位的神经元细胞及其轴索。由于损伤部位不同,MS 患者临床症状表现多样,可见多种运动障碍、感觉异常、共济失调等[6-8]。临床可分为原发进展型(PPMS)、继发进展型(SPMS)、进展复发型(PRMS)和复发缓解型(RRMS)四种类型。其病因病机不明确,目前临床以激素治疗为主,激素疗效不理想时可考虑使用血浆置换、静脉注射免疫球蛋白等方法[9-10]。
表4 各组小鼠脑组织p-p38MAPK蛋白表达水平比较(±s)
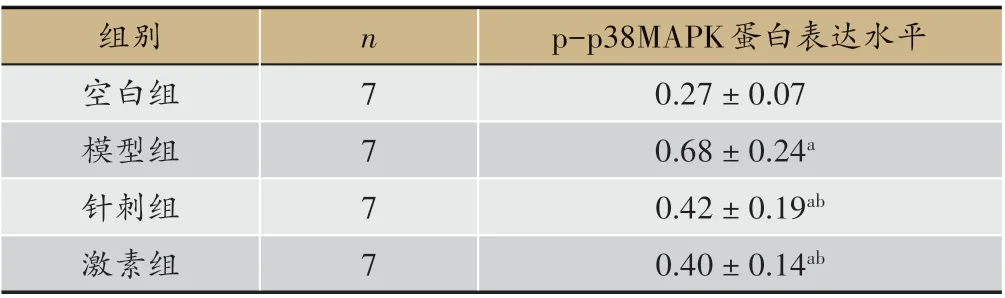
表4 各组小鼠脑组织p-p38MAPK蛋白表达水平比较(±s)
注:与空白组相比,aP<0.05;与模型组相比,bP<0.05
p-p38MAPK蛋白表达水平0.27±0.07 0.68±0.24a 0.42±0.19ab 0.40±0.14ab组别空白组模型组针刺组激素组n 7 7 7 7
p38MAPK 是大多数细胞内的一类重要信号转导酶,活化后的p38主要以p-p38MAPK 的形式存在。细胞内存在MKK3、MKK6等活化p38MAPK的上游激酶,以及T 细胞受体,可激活p38MAPK,使其自身磷酸化。研究发现,使用p38MAPK 抑制剂SB203580 可抑制EAE 小鼠p38MAPK 磷酸化,降低EAE 小鼠的发病率、体重损失及神经功能损伤程度[11-13]。用蜂毒针干预EAE 大鼠“足三里”穴,发现炎细胞数量及炎性因子表达均减少,p-p38MAPK 的表达也减少[14]。抑制小胶质细胞内p38MAPK 通路,可减少炎性因子的产生,抑制EAE 的炎症反应[15]。由此可见,p38MAPK 信号通路在MS的发病中起着重要的作用。
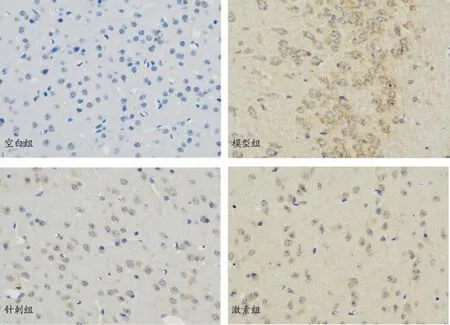
图4 各组小鼠脑组织p-p38MAPK免疫组化病理片(×400)
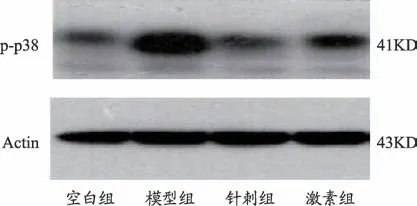
图5 各组小鼠脑组织p-p38MAPK蛋白表达电泳条带图
中医无“多发性硬化”病名,根据症状可诊断为“青盲”“风痱”“痿证”“痹症”,现多以“痿证”命名[16]。其病因包括外感和内伤两大类。外感温热邪毒、饮食劳倦、先天不足、内伤情志、跌扑损伤等均可消耗人体气血,疾病长期迁延致使脏腑受损,肌肉筋脉失去滋养,最终导致“痿证”。其病变部位在肌肉筋脉,但根本原因在于脏腑受损,气血精津亏损。《临证医案指南》认为“痿证”为“肝肾肺胃四经之病”。“肝肾”为先天之本,“肺胃”为后天之养,治疗MS 多以此入手。实验选取“大椎”穴为“阳脉之海”督脉上的要穴,是手足阳经的交会穴,统领一身阳气,既可以在MS 发病之初发散郁热,又可以在恢复期促进气血运行。“肾俞”为肾的背俞穴,肾藏精,主骨生髓,肾精不足则筋骨失养,可见运动障碍,肾司二便,肾气失司则见二便失调,“肾俞”穴可培补先天肾气,濡养筋骨。“足三里”为阳明经之合穴,胃之下合穴,胃是气血之海,气血生化之源,为生命活动提供能量,同时脾胃主四肢肌肉,《素问·痿论》提出“治痿独取阳明”的原则,“足三里”既能促进气血的生成,又能条畅人体气机。
目前,MS 以激素治疗为主,但激素治疗也带来失眠、焦虑、高血压、高血糖、胃肠功能紊乱、骨质疏松等副作用[17]。针刺作为一种替代疗法,能够改善神经功能残疾、疼痛,改善疲劳状态,提高患者生活质量[18]。Fatemeh Shadman针刺太溪、水道、复溜、血海、关元、气海、曲骨、中极、肓俞、命门、水分、肾俞等穴位,结果显示针刺组前列腺症状评分(I-PSS)和尿路症状导致的生活质量评分(QOLU)均低于非针刺组[19]。王春琛等[20]通过金针王乐亭经验方“老十针”“督脉十三针”“手足十二针”及随症加减穴位针刺治疗,可使缓解期的复发缓解型MS 患者神经功能缺损症状减轻,降低年复发率。目前,关于研究p38MAPK 在MS 发病过程中的作用,以药物治疗为主,针刺干预较为少见。实验研究发现针刺可以干预多种疾病的p38MAPK 转导通路,如针刺“百会”透“曲鬓”可以降低脑内p38MAPK的表达,对大鼠脑出血后继发性脑损伤的神经细胞凋亡有抑制作用,起到了脑保护作用[21-22]。心肌缺血再灌注模型大鼠p38MAPK 表达上调,电针“内关”可以明显抑制p38MAPK 的蛋白表达,发挥其抗心肌缺血的作用[23]。因此,推测针刺可能通过对p38MAPK 转导通路的调节,作用于EAE。
本实验研究结果显示,EAE 小鼠在模型制备后体重先持续增长,在制备模型后第12 天开始,随着小鼠中枢神经脱髓鞘程度的增加,小鼠各项生理功能出现障碍,体重开始下降,针刺组体重较模型组重,表明针刺可减少EAE 小鼠的体重损失。神经功能评分是小鼠神经功能损伤的量化,针刺组小鼠神经功能评分较模型组低,表明针刺可减轻EAE 小鼠的神经损伤程度。LFB 髓鞘染色可观察髓鞘脱失的程度,电镜下可观察到针刺组小鼠的神经细胞排列较模型组致密,髓鞘脱失程度低,表明针刺可改善EAE 小鼠中枢神经系统的髓鞘脱失。免疫组化结果显示在EAE 小鼠中枢神经细胞胞浆内有大量p-p38MAPK 表达,WB 检测显示各组小鼠的体重损失、神经功能评分以及髓鞘脱失情况与中枢神经细胞内p-p38MAPK 含量有关,针刺组p-p38MAPK 表达较模型组低,表明针刺可影响EAE小鼠的中枢神经细胞中p-p38MAPK的表达。
综上所述,本研究通过针刺干预EAE 小鼠,验证针刺可以改善EAE小鼠体重损失,降低EAE小鼠神经功能损伤程度,改善EAE 小鼠中枢神经系统的髓鞘脱失,其作用机制可能是抑制脑内p38MAPK 的蛋白表达,但具体作用通路还有待于进一步研究。

