牛miR-29b影响牛病毒性腹泻病毒感染BALB/c小鼠的作用
田瑞鑫,李胜男,胡新艳,陈俊贞,郭妍婷,赵新艳,李 祯,董文丽,如先古丽,李淑娴,冉多良,姚 刚,史慧君,付 强 (新疆农业大学 动物医学学院,新疆 乌鲁木齐830052)
牛病毒性腹泻/黏膜病(bovine viral diarrhea/mucosal disease,BVD/MD)是由牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)引起的牛、羊和猪的接触性传染病[1]。BVD 临床表现有体温升高、口腔胃肠溃疡、黏性腹泻及蹄叶炎等[2]。BVDV 感染导致怀孕母牛流产、死胎和犊牛急性死亡、育成牛发病死亡及牛群持续性感染,给养殖业健康发展带来严重威胁[3]。BVD 被OIE 定为B类及进出口检疫疾病[4-5]。
微小RNA(microRNA,miRNA)是一类广泛存在于真核细胞中的非编码RNA,其长度约22 nt[6]。由于miRNA 结合位点和调控方式的多样性,能够在细胞内形成复杂的网络调控体系,对细胞生理学和病理学过程起到关键调节作用[7]。miRNA 能调节基因转录后的表达,在动植物的生长发育、细胞增殖、凋亡与分化、激素分泌、肿瘤形成等过程中都发挥着重要的作用[8-11]。也能靶向外源核酸分子,例如病毒。病毒是一种专性的细胞内寄生物,其生存和复制都依赖于宿主细胞的相关机制,这种依赖性使病毒对于宿主的基因调控机制非常敏感[12-13]。曾有多项研究表明miRNA 参与病毒的复制[8,13-14],提示研究病毒与感染宿主miRNA 之间的相互作用可为病毒防制提供有效途径,为寻找抗病毒感染的生物制剂和治疗方法提供新思路。
前期研究工作中,通过Solexa高通量测序建立BVDV 感染MDBK 细胞miRNA 差异表达谱(miRNAs差异表达谱已提交到Gene Expression Omnibus公共数据库,GSE61251),并使用Taq Man RTPCR 鉴定发现BVDV 感染MDBK 细胞后造成miR-29b表达水平显著性上调。经TargetScan 等预测发现miR-29b能靶向于自噬相关基因ATG14和ATG9A 的3′非编码区(untranslated region,UTR),并显著抑制ATG14和ATG9A 的表达,进而抑制细胞自噬;高表达miR-29b 能显著抑制BVDV m RNA 的转录水平和病毒滴度,提示miR-29b在抑制BVDV 胞内复制中具有重要作用[15]。而高表达miR-29b是否会抑制BVDV 体内复制尚未见有研究报道,有待进一步研究探索。所以,本研究构建牛pre-miR-29b过表达慢病毒载体,并包装成慢病毒,尾静脉注射BALB/c小鼠后滴鼻感染BVDV NADL 毒株,通过临床症状观察、实时荧光定量PCR 检测各组织中病毒载量、病理组织切片和H&E染色检测各组织病变情况,研究miR-29b高表达对BVDV 在BALB/c小鼠体内复制的影响,其结果将为防控BVDV 提供新的策略和重要的理论依据。
1 材料与方法
1.1 细胞和实验动物HEK-293T 和MDBK 细胞为新疆农业大学动物病毒学实验室保存;BALB/c小鼠购自新疆医科大学医学动物中心。
1.2 主要试剂及仪器T4DNA 连接酶、One Step RT-PCR 试剂盒、快速质粒小提试剂盒、RNA 酶抑制剂等购自Ta KaRa公司;TRIzol购自Invitrogen公司;无内毒素质粒大提试剂盒、细胞基因组DNA提取试剂盒、DNA 凝胶回收试剂盒购自天根生化科技有限公司;High Efficiency Transfection Kit试剂盒购自Biowit公司;胎牛血清FBS购自BI公司;高糖DMEM、Trypsin、NEAA 购自Gibco公司;水合氯酸购自天津市大茂化学试剂场。凝胶成像仪购自美国伯乐公司;PCR 仪、高速离心机和移液器等购自德国Eppendorf公司;细胞培养箱购自Glaxy公司;Amicon离心超滤管购自默克密理博公司。
1.3 p LL3.7-pre-miR-29b载体构建
1.3.1 引物合成 根据miRBase数据库,查找牛miR-29b前体pre-miR-29b基因序列(MI0010464),使用Primer Premier 5.0设计扩增miR-29b前体的引物,引物序列如下表1。

表1 扩增miR-29b前体的引物序列
1.3.2 pre-miR-29b扩增 培养MDBK 细胞,采用天根细胞基因组提取试剂盒提取MDBK 基因组DNA,以 引 物pre-miR-29b-F 和pre-miR-29b-R 扩增基因pre-miR-29b。PCR 反应条件:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸30 s,40个循环;72℃延伸10 min。2.5%琼脂糖凝胶电泳检测PCR 扩增结果,DNA 凝胶回收试剂盒回收目的片段。
1.3.3 p LL3.7 慢病毒载体构建 使用HpaⅠ和XhoⅠ酶切pre-miR-29b基因及p LL3.7载体,37℃酶切反应4 h。分别使用2.5%和1.0%的琼脂糖凝胶检测pre-miR-29b 和p LL3.7 酶切结果,再使用DNA 凝胶回收试剂盒纯化酶切产物。使用T4DNA 连接酶将目的基因片段pre-miR-29b 与p LL3.7载体进行连接,转化至大肠杆菌DH5α感受态细胞中,氨苄青霉素培养基筛选阳性克隆后,测序鉴定。
1.4 慢病毒包装
1.4.1 慢病毒包装及浓缩 使用无内毒素质粒大提试剂盒分别制备p LL3.7、p LL3.7-pre-miR-29b质粒及包装质粒p RSV-Rev、p MDLg-p RRE 和pCMV-VSV-G。分别将p LL3.7 和p LL3.7-pre-miR-29b质粒与3种包装质粒按质量比2∶1∶1∶1转染至HEK-293T 细胞,详细步骤参考High Efficiency Transfection Kit试剂盒说明书。转染48 h后观察绿色荧光蛋白表达情况并收集上清,2 000 r/min 4℃离心5 min 去除细胞碎片沉淀,使用0.45μm 滤器过滤,将病毒悬液转移至Amicon 离心超滤管,6 000 r/min 4℃离心30 min,收集浓缩管中病毒液,分装后保存至-80℃。
1.4.2 慢病毒滴度测定 按照1.5×105个细胞/孔的比例将HEK-293T 细胞接种至24孔细胞培养板中,分别加入0.5,1.0,2.0,5.0μL 病毒浓缩液,并加入聚凝胺(终质量浓度8 mg/L),小心混匀后放入培养箱中,感染24 h后更换新鲜培养液;感染后48 h使用4%多聚甲醛固定10 min,DAPI染色20 min,每个孔随机选4个视野,计数绿色荧光细胞和蓝色荧光细胞。病毒滴度(IU/m L)=(绿色荧光细胞总数/蓝色荧光细胞总数)÷病毒液体积(μL)×1.5×105×103。
1.5 慢病毒感染BALB/c小鼠和BVDV 攻毒将30只BALB/c小鼠随机分为A、B、C、D、E 共5组,每组6只。每组中3只为试验组,感染p LL3.7-premiR-29b慢病毒,3只为对照组,感染p LL3.7 慢病毒。分别通过尾静脉注射2.5×107IU p LL3.7-premiR-29b和p LL3.7 慢病毒感染试验组和对照组BALB/c小鼠;次日重复注射1次;慢病毒感染96 h后麻醉小鼠,滴鼻接种BVDV,剂量为1.68×105TICD50/只,分别于接种后0,2,4,10,15 d后处死A~E组小鼠,步骤为:摘除小鼠眼球采血,收集血液,再处死小鼠,解剖后分别采集心脏、肝脏、脾脏、肺脏、小肠、气管等组织,取小部分组织冻存于-80℃,用于RT-PCR 检测各组织病毒载量;将剩余各组织使用福尔马林溶液浸泡固定后制备病理组织石蜡切片及H&E染色,观察组织病变情况。
1.6 荧光定量RT-PCR检测病毒载量
1.6.1 标准阳性质粒的构建 参考BVDV 基因组序列,针对5′UTR 基因设计用于建立实时荧光定量PCR 标准曲线的引物,BVDV 5′UTR-F:5′-AGCCATGCCCTTAGTAGGACT-3′和BVDV 5′UTRR:5′-ACTCCATGTGCCATGTACA-3′。PCR 扩增条件:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸30 s,35个循环;72℃终延伸10 min,4℃终止反应。使用DNA 凝胶回收试剂盒回收PCR 产物,并与p BM23 载体连接,步骤见p BM23 Toposmart克隆试剂盒说明书;转化至大肠杆菌DH5α感受态细胞,进行氨苄青霉素抗性筛选,测序鉴定。
1.6.2 实时荧光定量PCR 标准曲线建立 使用质粒小提试剂盒提取质粒,并计算拷贝数:拷贝数(Copies)=[阿伏伽德罗常数×质粒质量浓度(g/m L)]/质粒相对分子质量(g/mol),其中阿伏伽德罗常数为6.02×1023,建立标准曲线。
1.6.3 实时荧光定量PCR 检测病毒载量 使用剪刀将各组织剪碎,并使用研磨棒将各组织充分研磨,利用TRIzol提取组织及全血RNA,并按照反转录试剂盒说明书将1μg RNA 反转录成cDNA,荧光定量PCR 检测各组织中BVDV 载量。
1.7 组织病理切片检测使用10%甲酸固定小鼠各组织,并经过脱水、透明、包埋、切片、H&E 染色等步骤制备病理切片,观察小鼠各组织病理变化情况。
2 结果
2.1 pre-miR-29b基因克隆及鉴定琼脂糖凝胶电泳检测PCR 扩增基因结果,如图1所示,约100 bp处条带与pre-miR-29b基因大小相符。测序鉴定显示,其与miRBase数据库中pre-miR-29b基因序列同源性100%(图2)。
2.2 慢病毒包装将p LL3.7-pre-miR-29b、p RSVRev、p MDLg-p RRE 和pCMV-VSV-G 共4 种 质 粒共同转染HEK-293T 细胞,转染48 h后观察绿色荧光蛋白情况。结果如图3所示,绿色荧光蛋白大量表达,对慢病毒进行滴度测定,最后计算出过表达p LL3.7-pre-miR-29b慢病毒滴度为1.34×108IU/m L,表明成功包装慢病毒。
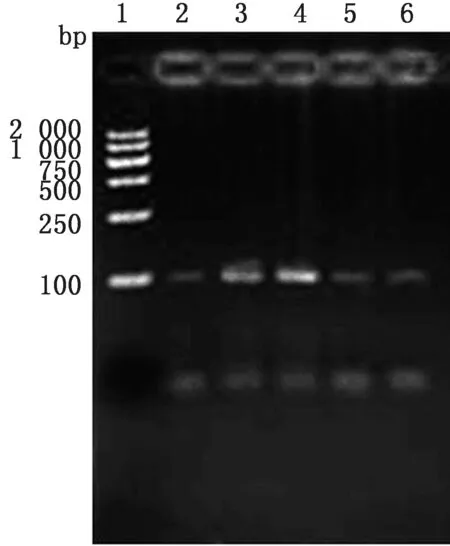
图1 PCR 扩增pre-miR-29b结果 1.DL2000 DNA Marker;2~6.pre-miR-29b PCR 扩增结果

图2 pre-miR-29b序列比对分析

图3 慢病毒包装结果
2.3 荧光定量RT-PCR 标准曲线绘制如图4所示,荧光定量PCR 的溶解曲线只出现单一特异性峰值,没有其他非特异性扩增峰值出现,表明该实时荧光定量RT-PCR 引物特异性较好。如图5所示,各浓度DNA 稀释液均出现稳定扩增曲线。以Ct值为纵坐标,拷贝数为横坐标,制作标准曲线,如图6所示,该标准曲线R2为0.999,扩增效率为10(-1/-3.55)-1=91.3%,表明该标准曲线可以用于后续试验。
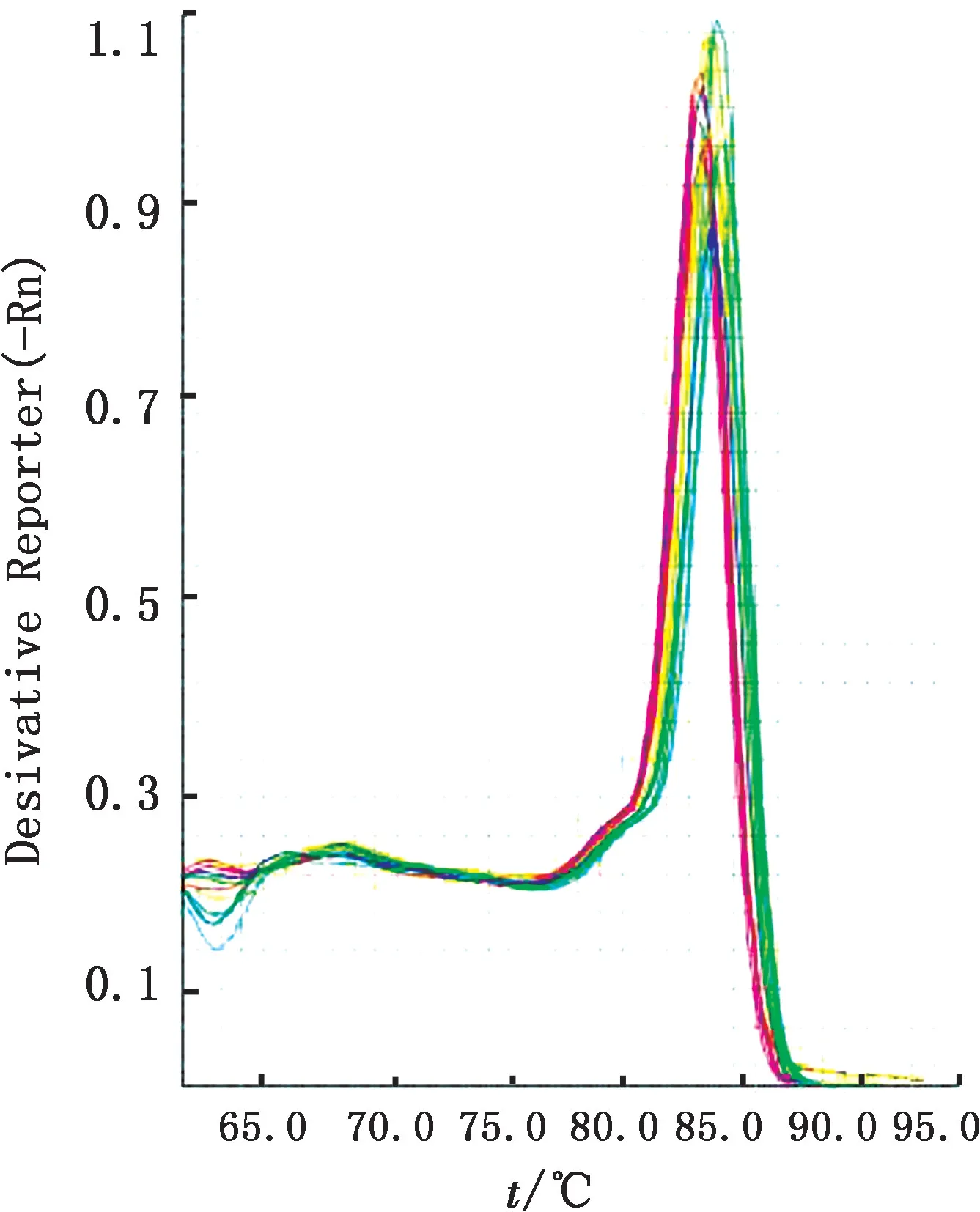
图4 荧光定量RT-PCR 扩增产物溶解曲线
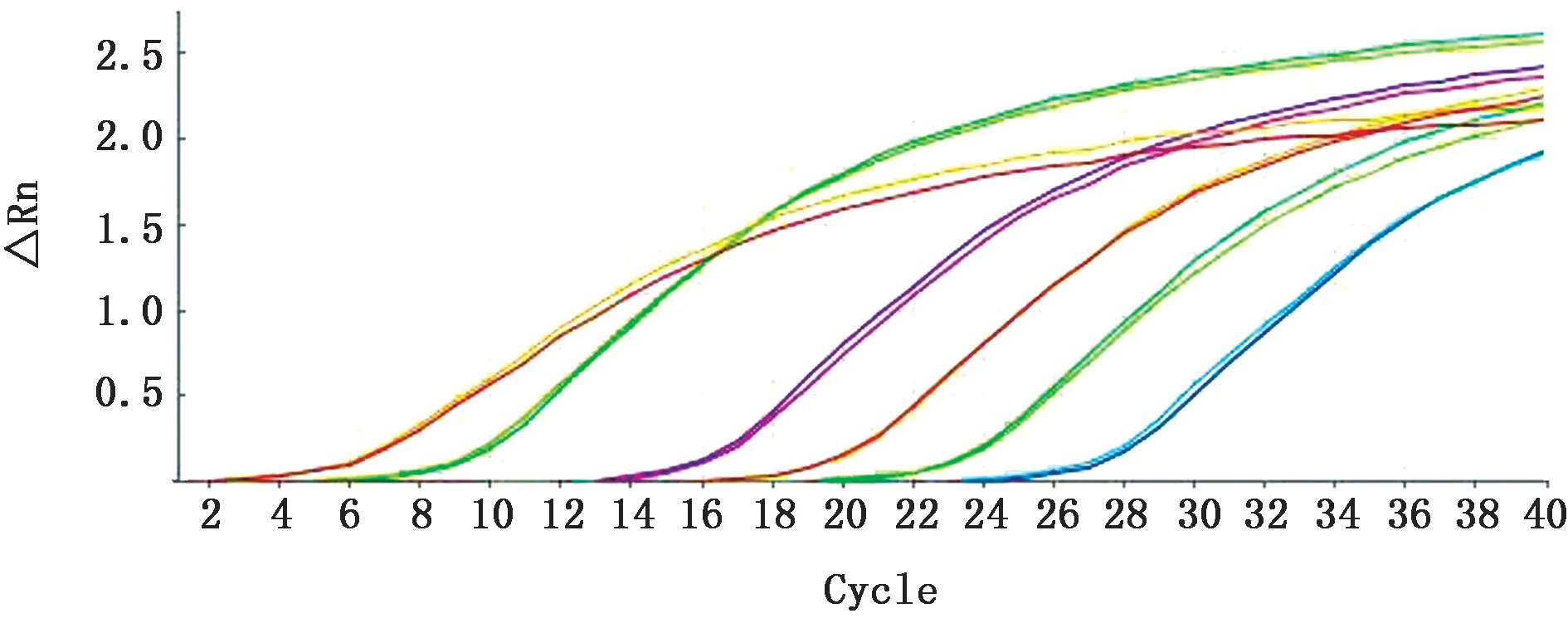
图5 荧光定量RT-PCR 扩增曲线
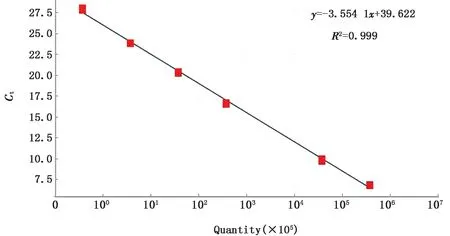
图6 荧光定量RT-PCR 标准曲线
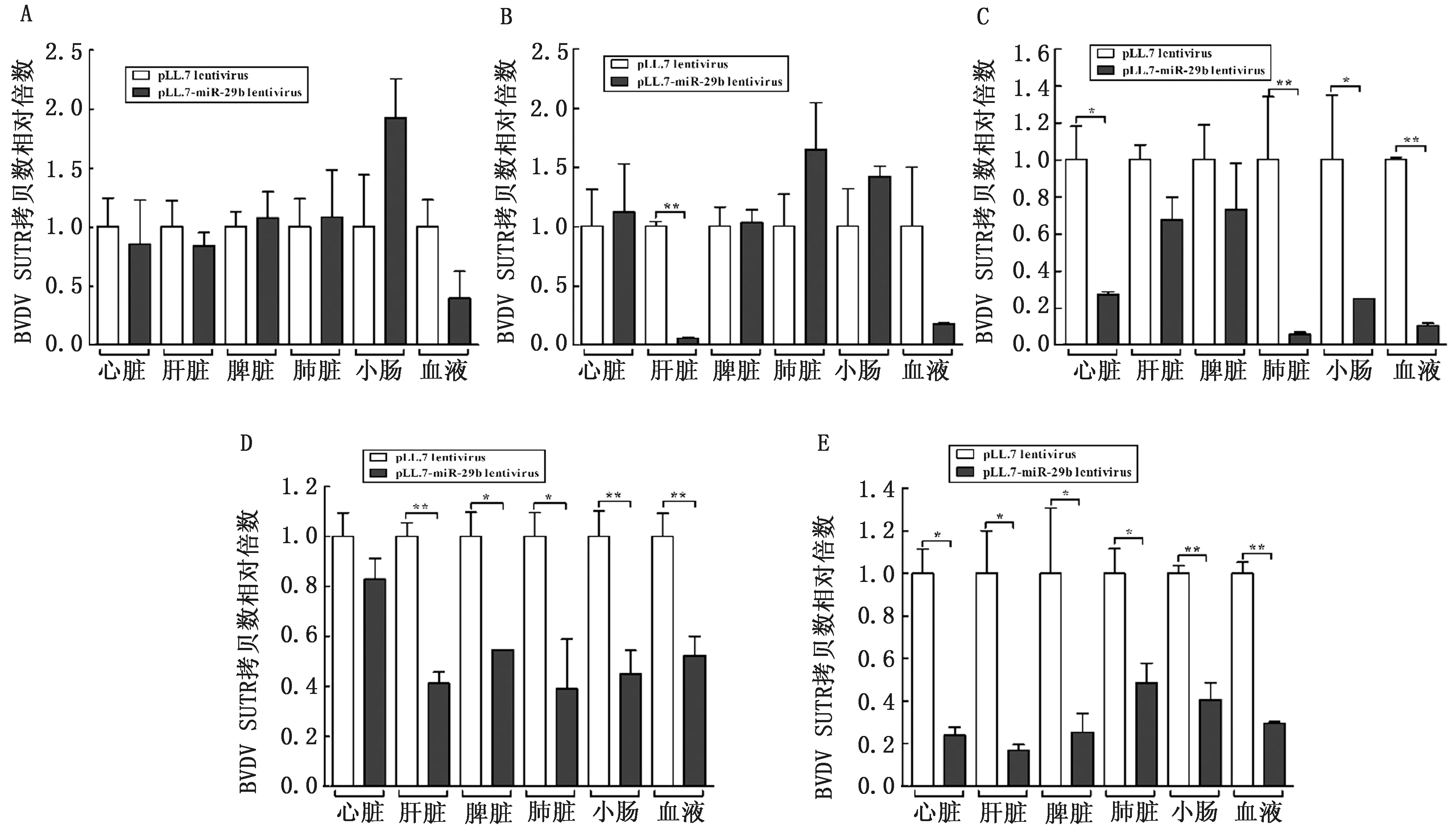
图7 荧光定量RT-PCR 检测BALB/c小鼠不同组织中病毒载量 A.0 d;B.2 d;C.4 d;D.10 d;E.15 d。∗P<0.05;∗∗P<0.01
2.4 荧光定量RT-PCR 检测各组织BVDV 载量
使用荧光定量RT-PCR 检测BVDV 攻毒后不同时间BALB/c小鼠各组织的BVDV 5′UTR 拷贝数,并以对照组拷贝数为1,计算处理组的BVDV 5′UTR 相对拷贝数。结果如图7所示,BVDV 攻毒后0,2 d,与p LL3.7慢病毒感染的对照组相比,处理组中各组织的BVDV 5′UTR 相对拷贝数未出现明显的差异(除肝脏以外)。BVDV 攻毒后4,10,15 d,与对照组相比,处理组中各组织的BVDV 5′UTR相对拷贝数差异逐渐形成,其中第10天时,除心脏外,处理组中其他组织的BVDV 拷贝数均出现显著性降低,肝脏中BVDV 拷贝数降低最为明显,约2.5倍;其中第15天时,处理组中所有组织的BVDV 拷贝数出现显著性降低,肝脏中BVDV 拷贝数降低最为明显,约5.0倍。结果表明,在BVDV 攻毒后4,10,15 d时,p LL3.7-pre-miR-29b 感染能显著性降低BVDV 拷贝数,抑制BVDV 体内复制,也表明miR-29b过表达能显著性抑制BVDV 体内复制。
2.5 组织病理切片检测H&E 染色感染BVDV的小鼠组织表明,感染BVDV 的大部分脏器都表现出不同程度的组织病变。心脏组织病理变化主要是组织局部少量出血,有少量淋巴细胞浸润,4 d左右细胞出现颗粒变性,心肌细胞出现坏死现象;肝脏组织病变为小静脉出现淤血,组织局部出血,肝细胞后期出现颗粒变性、坏死现象;脾脏组织病变主要表现为淤血、组织局部出血,有少量淋巴细胞浸润;肺脏组织病变主要出现出血、淤血,肺泡间隔显著增宽,肺泡坏死,在0~4 d病变最为明显;小肠组织肠绒毛固有层淋巴细胞浸润,小肠毛细血管出血,肠黏膜固有层水肿,第10 天左右部分肠绒毛上皮细胞坏死,有轻微出血现象。
与p LL3.7-pre-miR-29b感染的处理组相比较,p LL3.7感染的对照组病变较为严重,主要表现为心脏组织中心肌细胞变性、坏死较为严重;肝脏炎性细胞浸润、肝细胞坏死严重、小静脉淤血严重;肺脏肺间隔显著增宽,0~2 d肺泡坏死严重,炎性细胞浸润较为严重;小肠固有层明显水肿,小肠毛细血管出血,肠绒毛固有层淋巴细胞浸润、肠绒毛坏死严重(图8)。
3 讨论
miRNA 是具有基因表达调控功能的微小RNA,能够介导靶基因转录后基因沉默,随着对miRNA 研究的不断深入,人们发现这种miRNA 基因沉默技术在疾病的诊断和治疗等方面有着重大的作用[16]。慢病毒属于RNA 病毒属逆转录病毒科,慢病毒载体则是以人类免疫缺陷Ⅰ型(HIV-I)为基础进行特异性基因骨架的改造,从而形成一类可用于基因治疗的重组反转录病毒载体。它能够高效地感染分裂细胞和非分裂细胞,将容纳的外源性目的基因利用自身的逆转录酶和整合酶整合到宿主细胞染色体上,从而持久有效地表达外源基因[17-18]。因此,使用慢病毒介导miR-29b在细胞和个体内持续稳定表达,是研究miR-29b 功能必不可少的工具。本研究成功构建出miR-29b前体过表达慢病毒质粒p LL3.7-pre-miR-29b,并且成功包装出慢病毒。
前期研究已经发现牛miR-29b在BVDV 感染胎牛肾细胞MDBK 特异性高表达[15]。经生物信息学软件预测发现miR-29b特异性靶向于自噬相关基因ATG14和ATG9A 的3′UTR 区域,并显著性抑制ATG14 和ATG9A 的表达,进而抑制细胞自噬的发生,进一步研究发现高表达miR-29b能显著性抑制BVDV 体外复制[6]。本研究在BALB/c小鼠体内验证了miR-29b对BVDV 复制的影响。荧光定量RT-PCR 检测结果表明,BVDV 感染0~2 d,处理组与对照组没有明显差异,除肺部外组织器官病理变化没有明显差异,可能的原因是BVDV在感染48 h内仅处于早期的复制阶段,尚未大量累积,所以各组织间病毒载量和组织病变差异不明显。此外,第2天处理组中肝脏病毒量较少,可能是小鼠个体差异或肝脏受病毒早期刺激引起肝脏内大量免疫细胞产生,在病毒尚未大量复制时,自身免疫机制起到保护作用,抑制了BVDV 的早期复制。
随着BVDV 感染时间的延长,BVDV 在机体内大量复制,处理组与对照组逐渐出现明显的差异。其中BVDV 感染后4 d时,肝脏中BVDV 载量降低最为明显;10,15 d时处理组肝脏中BVDV 拷贝数显著性降低,分别为对照组的2.5 和5.0 倍,表明p LL3.7-pre-miR-29b感染能显著性降低BVDV 拷贝数,抑制BVDV 体内复制。
组织病理切片的结果表明,各组织在BVDV 感染后0~2 d,处理组与对照组病理变化差异不明显,可能与BVDV 在48 h内尚未大量复制有关。随着BVDV 感染时间的增加,处理组与对照组中BVDV病毒载量差异不断增大,各组织的病理变化差异逐渐明显。在p LL3.7 感染的对照组中,心脏细胞坏死明显高于处理组;肝脏中肝细胞出现颗粒变性、出血症状明显比处理组严重;肺脏中肺泡间隔明显增宽,局部出血,病变程度明显高于处理组;小肠中肠黏膜固有层水肿,肠绒毛坏死明显高于处理组。综上结果表明,感染p LL3.7-pre-miR-29b后能有效抑制BVDV 复制,进而保护机体组织免受BVDV 的损伤。
综上所述,荧光定量RT-PCR 和小鼠内脏组织病理切片结果表明,p LL3.7-pre-miR-29b感染能显著性降低BVDV 拷贝数,抑制BVDV 体内复制,从而减弱BVDV 感染造成的病理变化;表明miR-29b过表达对BVDV 体内复制起到了抑制作用。
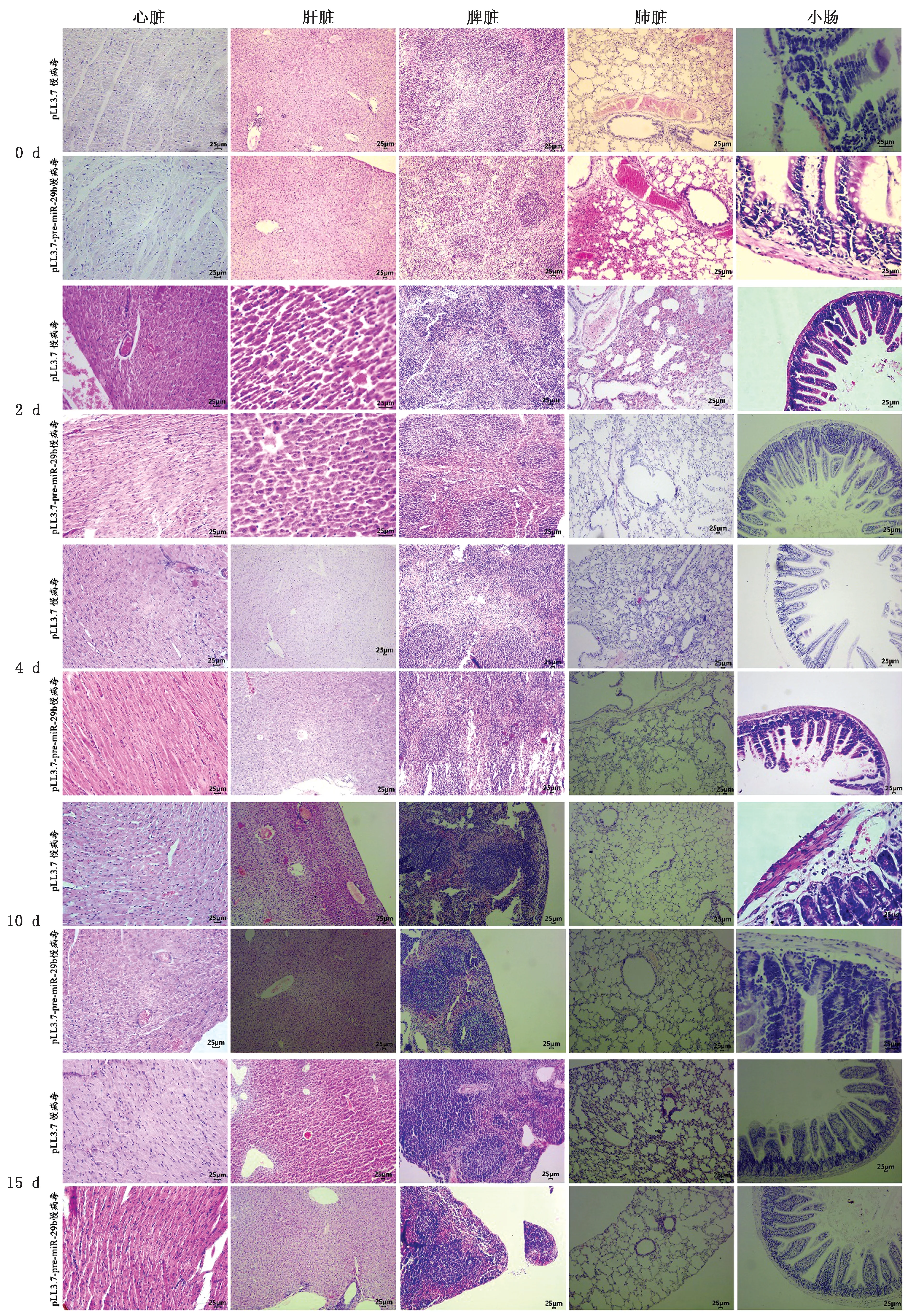
图8 BVDV 攻毒后组织病理切片检测结果

