N-氨甲酰谷氨酸对猪胎盘滋养层细胞增殖及基因表达的影响
韦尚丽,马文清,白佳桦,许晓玲,田见晖,刘 彦,冯 涛
(1. 甘肃农业大学 动物科学技术学院,兰州 730070; 2. 北京市农林科学院畜牧兽医研究所,北京 100097;3. 甘肃省平凉机电工程学校,静宁 743400; 4. 中国农业大学 动物科学技术学院,北京 100193)
在生猪养殖过程中产(活)仔数和仔猪初生重是影响母猪繁殖生产效率的主要因素。初生重变异大导致宫内发育迟缓(Intrauterine growth retardation,IUGR)仔猪(体重低于1.1 kg)的比例升高,目前IUGR仔猪占到总产仔数的25%左右,约76%的IUGR仔猪在断奶前死亡[1],存活下来的IUGR仔猪也普遍存在次级肌纤维发育畸形和延迟成熟的情况[2]。研究发现在妊娠后期日粮中添加营养因子可以改善IUGR现象,调控仔猪初生重及其变异,这些营养因子主要有氨基酸或蛋白质、能量(来源)和功能性添加剂等[3-5]。N-氨甲酰谷氨酸(N-carbamylglutamate,NCG)是一种新型饲料添加剂,在妊娠日粮中添加可以提高多胎动物(猪和鼠)窝产仔数和初生重[6],近期有研究表明,妊娠后期日粮中添加一定剂量的NCG可提高仔猪初生个体均重、胎盘均重并降低窝内体重变异[5],但前期研究仅观察到现象,NCG调控仔猪重量、胎盘发育的机理尚不清楚。
胚胎滋养层是发挥胎盘屏障等胎盘功能的主要部位,胚胎滋养层细胞是研究胎盘功能的主要模型之一。胎盘是由胚胎配模和母体子宫内膜联合长成组织结合器官,在胎儿发育过程中发挥物质转运、免疫屏障、内分泌等重要生理作用,这些功能与胎盘滋养层细胞的特性密切相关[7-8]。对于哺乳动物繁殖过程中营养因子调控胎儿生长发育的相关研究而言,由于胎盘生理功能的特殊性以及对胎儿正常发育的关键影响作用,体内实时探索胎盘生理变化的难度较大;胎盘滋养层细胞是构成胎盘绒毛结构的主要组成部分,是母体和胎儿进行营养物质交换的主要组织部位,因此阐述滋养层细胞的生理影响机制对反映胎盘正常功能具有重要意义[9-10]。本研究利用猪胎盘滋养层细胞系(Placenta trophoblast cells,pTr)为模型,体外研究NCG对猪pTr细胞增殖及其胎盘功能相关基因表达的影响,以期初步解释NCG促进胎盘发育的机理。
1 材料和方法
1.1 猪pTr细胞培养
本试验所用猪pTr为中国农业大学动物科学技术学院惠赠。将猪pTr从液氮取出后,37 ℃水浴快速解冻后放在超净台中用PBS重悬洗涤2次,1000 r/min离心5 min弃上清,加入DMEM/F12完全培养液(含有10%胎牛血清FBS、1%的ITS和1%青链霉素双抗),重悬后接种于25 cm2的细胞培养瓶(Corning公司),置于细胞培养箱(37 ℃、饱和湿度、5% CO2)无菌培养,每隔24 h更换新的完全培养液。显微镜观察pTr细胞融合度超过70%后,弃培养液,PBS洗涤2次后用胰酶(Try-EDTA,0.25%)37 ℃消化约2 min,显微镜观察待细胞开始从培养瓶壁上掉落漂浮在消化液中时,使用含有血清的DMEM/F12完全培养液终止消化,1000 r/min离心5 min,弃上清用完全培养液重悬后接入新的75 cm2培养瓶传代。pTr传代3次以上且细胞形态正常、状态稳定,传代时经细胞计数测定数量满足实验要求便可开展下一步研究,本试验所用pTr在3~12代之间[11-12]。
1.2 NCG处理猪pTr
传代时得到的pTr细胞悬液用细胞计数仪测定密度(方法详见1.3),根据细胞密度用DMEM/F12完全培养液稀释至0.5×106个/mL的浓度均匀接种至12孔板中,每孔2 mL,按照1.1中的条件培养。待细胞融合至70%以上时,无菌操作轻轻吸去培养液,PBS洗涤(1 mL/孔)2遍以去除血清对处理的干扰,吸尽PBS后每孔接入2 mL不同浓度的NCG溶液(用无血清DMEM/F12配制终浓度为0、1、10和25 mmol/L),重新置于二氧化碳培养箱并计时。本研究中每个处理至少3个重复。
1.3 猪pTr细胞计数及收集
猪pTr培养48 h后从培养箱中取出,吸取细胞培养液并收集细胞。使用胰蛋白酶消化法收集细胞沉淀(方法详见1.1),用200 μL的DMEM/F12完全培养液终止消化后,将吹打混匀的细胞悬液全部转移至RNase-free的离心管,充分重悬后吸取1 μL至99 μL无血清培养基中,再次重悬后吸取10 μL用细胞计数仪(Bio-Rad公司)进行计数。剩余的细胞悬液300 r/min离心4 min后弃上清并加入细胞裂解液,震荡混匀后立即提取RNA或存储于-80 ℃冰箱。
1.4 细胞总RNA提取
1.3中细胞裂解液总RNA的提取使用离心柱型“RNAprep Pure培养细胞/细菌总RNA提取试剂盒”(天根公司),按照使用说明在室温下操作,RNA的收集和浓度测定参考陈志龙等[11]的方法进行。
1.5 逆转录cDNA
采取“TIANGEN Quantscript RT Kit Quant cDNA第一链合成试剂盒” (天根公司)进行反转录,根据RNA浓度计算反转录体系中各组份的添加量。反转录步骤参考陈志龙等[11]进行。反转录体系如下:10×RT Mix、Super pure dNTPs、Oligo-(dT)15各2.0 μL,RNA模板根据浓度计算体积,用水补齐总体积20.0 μL。
1.6 Real-time PCR
采用FastFire qPCR PreMix(SYBR Green)快速荧光定量PCR预混试剂盒(天根公司),参照说明书进行基因荧光定量表达检测,以GAPDH为内参基因,引物序列参考已发表文献(表1)。
PCR反应采用20.0 μL体系,包括上下游Primer各0.5 μL、2×FastFire qPCR PreMix 10.0 μL、cDNA 1.0 μL、ddH2O 8.0 μL。95 ℃预变性1 min; 95 ℃变性 5 s,62 ℃退火10 s,72 ℃延伸10 s, 40个循环。使用荧光定量软件Bio-Rad CFX Manager 3.1读取荧光信号记录Ct值。

表1 本研究所用Real-time PCR引物序列
GAPDH: glyceraldehyde-3-phosphate dehydrogenase; CDK4: cyclin-dependent kinase 4; CCND1: Cyclin D; SLC2A1: Solute carrier family 2, facilitated glucose transporter member 1; CAT: catalase
1.7 数据统计与分析
基因表达根据荧光定量软件自动读取的Ct值(荧光信号到达阈值的循环数),采用2-△△Ct法计算对照组和试验组检测基因的相对表达水平[13]。
本试验所有结果采用SPSS19.0软件进行单因素方差分析,差异显著时使用Tukey法进行多重比较,所有数值以平均值±标准误表示。
2 结果与分析
2.1 NCG对猪pTr细胞增殖的影响
培养基中添加1~25 mmol/L的NCG培养猪pTr 48 h,细胞增殖情况如图1所示,NCG对猪pTr细胞增殖存在剂量依赖性促进关系(P<0.05),基因表达试验选择10 mmol/L的浓度进行。
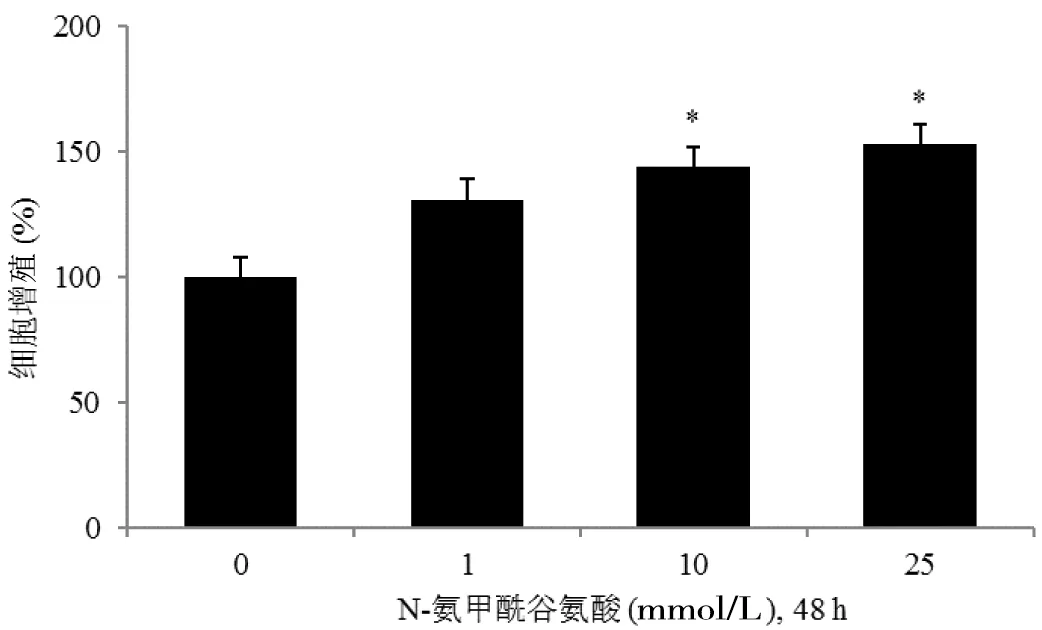
“*”表示与其他组存在显著差异(P<0.05)
图1不同浓度NCG对猪胎盘滋养层细胞增殖的影响
Figure 1 Effect of different concentrations of NCG on pTr cell proliferation
2.2 NCG对猪pTr相关基因表达的影响
NCG处理猪pTr 48 h相关基因表达情况如图2所示:体外用10 mmol/L的NCG处理可上调猪pTrCDK4、CCND1、SLC2A1和CAT基因表达(P<0.05)。
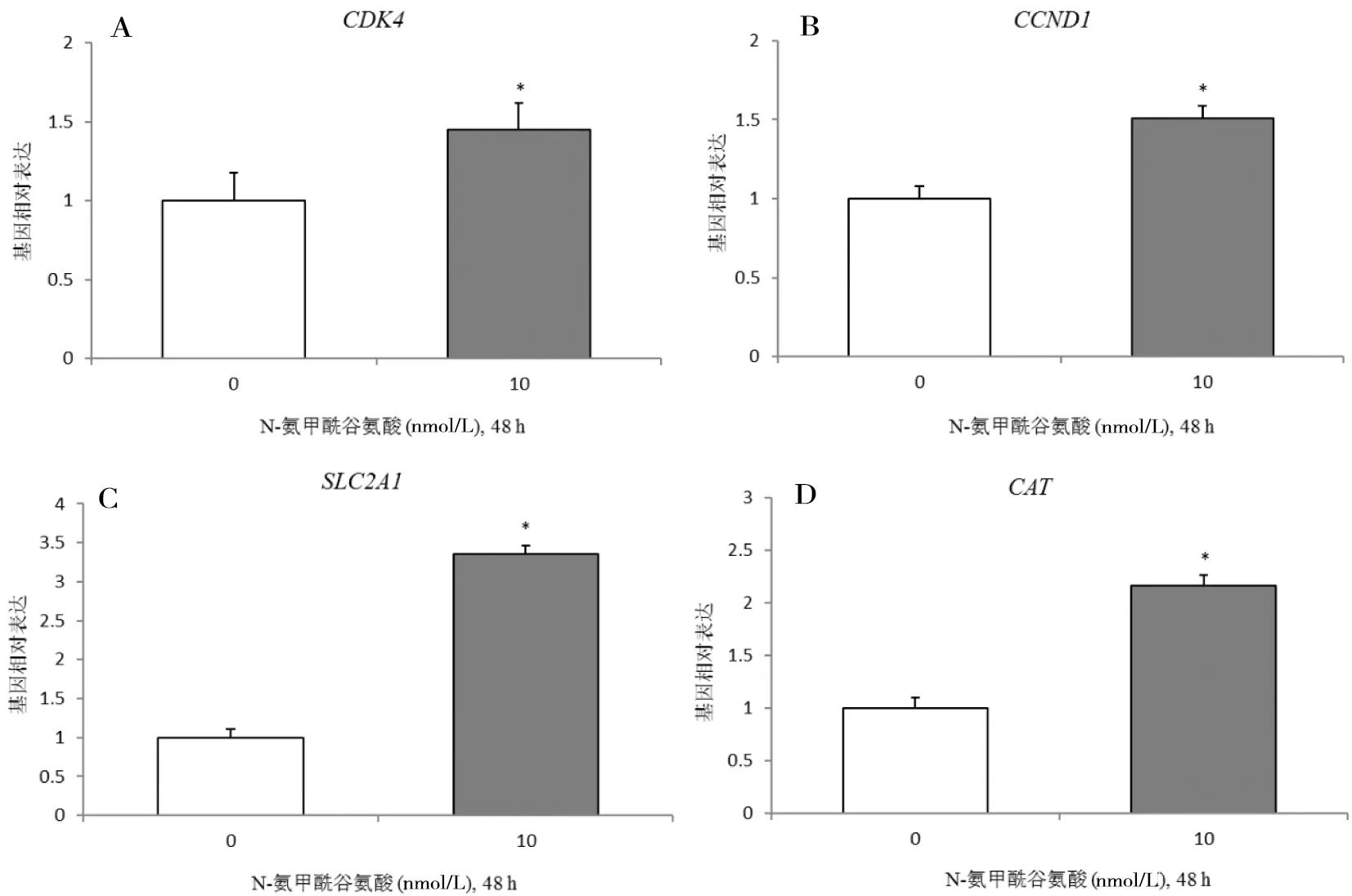
A:CDK4; B:CCND1; C:SLC2A1; D:CAT; “*”表示与对照组比存在显著差异(P<0.05)
图2NCG对猪胎盘滋养层细胞基因表达的影响
Figure 2 Effect of NCG on related gene expression in pTr cell
3 讨论
3.1 NCG对猪pTr细胞增殖的影响
体外培养测定细胞数量变化是评价细胞生长的最佳方法[14]。利用体外培养的方法,我们发现NCG可呈剂量依赖性促进猪pTr细胞增殖,随着培养浓度的增加,细胞增殖1.2~1.5倍。NCG又称之为精氨酸Raiser,大量研究都证实了NCG添加能够提高猪和大鼠血液中精氨酸的浓度[15-17],并增加血浆中鸟氨酸和脯氨酸的含量[17-18]。在胚胎发育过程中,氨基酸转运载体SL7CA1可运送精氨酸到子宫腔中,为胚胎的生长发育提供营养支持[19]。在体外,猪pTr对一些营养因子较为敏感。含葡萄糖(4 mmol/L)和果糖(4 mmol/L)的培养基体外处理猪pTr 48 h或96 h可显著促进细胞增殖1.5~5.0倍[20]。亮氨酸(1 mmol/L)体外培养猪pTr 24 h可显著促进细胞增殖[21]。另外,NCG体外对细胞增殖也有促进作用。1.0 mmol/L的NCG处理12 h可促进小鼠下丘脑GnRH细胞系GT1-7细胞增殖[12],2.0 mmol/L的NCG处理48 h可显著促进牛卵泡颗粒细胞增殖[22]。IUGR仔猪形成的一个主要原因就是胎盘生长发育受损[1, 23-24],前期研究表明妊娠后期添加NCG可能是通过促进母猪胎盘发育继而调控仔猪的初生重[5]。本研究结果显示体外NCG添加可促进猪pTr细胞增殖,说明NCG促进母猪胎盘发育的营养调控作用可能是通过促进pTr细胞增殖实现的。
3.2 NCG对猪pTr细胞功能的影响
本研究选取10 mmol/L的NCG进行基因表达研究的原因是高浓度NCG可以显著刺激细胞增殖,但对细胞分泌活性存在一定的抑制作用[12, 22]。
在细胞周期分裂的过程中,CDK4可以和CCND1特异性结合,从而促进细胞周期从G1期到S期的过度[25]。刘炀[21]体外用亮氨酸(1 mmol/L)处理猪pTr 24 h,发现G0-G1期细胞所占百分比升高,将有更少的细胞周期发展至S期。但他发现CDK4基因的表达量没有显著变化,而高浓度的亮氨酸(10 mmol/L)抑制了猪pTr细胞增殖和CDK4基因的表达,细胞周期检测显示pTr细胞周期停滞在了G0-G1期,减少向S期转化细胞的数量。在心外膜祖代细胞增殖研究中发现,CCND1基因mRNA表达水平升高时,CCK-8检测显示细胞增殖能力明显增强,流式细胞周期检查则提示G1期细胞数量减少,S/G2期细胞明显增多[26]。可见,CDK4、CCND1基因表达水平与细胞增殖密切相关。本研究发现NCG体外刺激猪pTr后CDK4和CCND1基因mRNA表达水平显著增加,表明细胞增殖能力旺盛,也暗示了NCG可通过上调细胞周期相关蛋白的表达促进猪pTr细胞增殖。
SLC2A1和SLC2A3是主要的葡萄糖转运载体,这两个基因mRNA和蛋白表达异常将降低胎盘的营养转运效率[27]。敖政[28]在研究克隆猪和人工授精猪胎盘功能的差异时发现,部分克隆猪胎盘组织中SLC2A1基因表达水平显著降低,说明了胎盘的营养供给异常是导致克隆猪初生重小和产后存活率低的一个主要原因。Lin等[29]研究日粮能量水平对IUGR仔数的影响时发现,在低脂低纤维妊娠日粮条件下,尽管仔猪胎儿体重降低但母猪胎盘SLC2A1基因表达水平升高,说明在能量水平低下的情况下,母体胎盘会通过上调SLC2A1基因表达来补偿仔猪生长发育所需的葡萄糖。母体营养主要通过调控胎盘脂质和能量代谢以及养分的转运等提高胎盘效率,继而影响胎儿的初生重,即高能量饲粮能够增加仔猪初生重,并有效降低初生窝内体重变异[30]。研究发现NCG能够上调猪pTrSLC2A1基因表达提高葡萄糖等能量物质的转运效率,从而增强胎盘功能。
CAT主要作用是催化H2O2分解为H2O和O2,使得H2O2不能与O2在铁鳌合物作用下反应生成有害的OH离子。在大鼠母体营养不良的情况下,添加褪黑素可提高胎盘效率并补偿胎儿的初生重,机理研究发现褪黑素通过提升 Mn-SOD和CAT蛋白表达水平增强胎盘的抗氧化能力[31]。近年研究发现,NCG在体内也具有抗氧化作用[5, 32-33]。本研究发现NCG在体外也具有抗氧化的功能,具体表现在可上调猪pTrCAT基因的表达。
4 结论
本研究发现体外10~25 mmol/L的NCG可以促进猪pTr细胞增殖,这种作用是通过上调细胞周期相关基因CDK4和CCND1、葡萄糖转运相关基因SLC2A1和抗氧化应激相关基因CAT的表达实现的。

