实时荧光定量PCR 分析中不同铁浓度处理下玛氏骨条藻内参基因的筛选
张梅,邢永泽,甄毓*,米铁柱,于志刚
( 1. 中国海洋大学 海洋环境与生态教育部重点实验室,山东 青岛 266100;2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室,山东 青岛 266237;3. 中国海洋大学 环境科学与工程学院,山东 青岛 266100;4. 中国海洋大学 海洋化学理论与工程技术教育部重点实验室,山东 青岛 266100)
1 引言
骨条藻(Skeletonema spp.)属于海链藻目(Thalassiosirales)、骨条藻科(Skeletonemataceae),是我国近海海域常见、数量多、分布范围极广的一类海洋浮游硅藻,有时会引发赤潮。由于不同骨条藻种类之间的形态学差异十分细微,准确鉴定的难度相对较大。因此,前些年国内的研究者通常将我国近海海域的骨条藻都定名为中肋骨条藻(Skeletonema costatum)并对其进行研究[1]。近些年来,分子生物学技术的快速发展为骨条藻的种类鉴定和遗传多样性研究提供了可靠的技术保证。到目前为止,我国近海海域共发现10 种骨条藻,分别为玛氏骨条藻(S. marinoi)、中肋骨条藻(S. costatum)、拟中肋骨条藻(S. pseudocostatum)、热带骨条藻(S. tropicum)、曼式骨条藻(S. menzelii)、江河骨条藻(S. potamos)、多恩骨条藻(S. dohrnii)、敏盐骨条藻(S. subsalsum)、桂氏骨条藻(S. grevillei)和亚当斯骨条藻(S. Ardens)[2]。随着分子鉴定技术的发展,研究者逐渐将目光聚焦在了单种骨条藻的研究上。
实时荧光定量PCR(Quantitative Real-time PCR,qRT-PCR)是定量分析基因表达的一种有效、精确的方法,具有重复性好、灵敏度高、特异性强等特点[3–4]。然而,在其分析过程中,RNA 的质量和完整性、反转录效率、引物的特异性和扩增效率以及其他阻碍因素都会对目的基因的相对表达结果的准确定量产生影响[5]。因此,需要选择合适的内参基因进行校正和标准化,从而保证实验结果的精确性[6–7]。目前,常用的内参基因有很多,包括细胞色素b(cytochrome b,Cyt b)、转录延伸因子(elongation factor 1 alpha, EF-1α)、次黄嘌呤磷酸核糖转移酶(hypoxanthine phosphoribosyltransferase, HPRT)、泛素结合酶(ubiquitin C,UBC)、甘油醛磷酸脱氢酶(glyceraldehyde-3-phosphate, GAPDH)、β-肌动蛋白(actin beta, β-actin)、β-微管蛋白(tubulin beta, β-tubulin)、18S 核糖体RNA(18S rRNA)和25S 核糖体RNA(25S rRNA)等。一个理想的内参基因应该在任何细胞类型或实验条件下均能稳定表达,但是迄今为止,并没有发现任何一个内参基因在所有实验条件下的表达都是稳定的。所研究的物种类型、组织结构、生长发育阶段以及实验条件都会对内参基因的表达产生影响[8–10],因此,需要对不同实验体系中内参基因的稳定性进行评价与鉴定,以便筛选出合适的内参基因。
研究者分析了两种拟菱形藻Pseudo-nitzschia multistriata 和Pseudo-nitzschia arenysensis 的9 个内参基因(RPS、H4、TUB A、TUB B、TBP、CDK A、GAPDH、ACT、COPA)在不同样本(不同生长时期、氮胁迫以及不同菌株)中的表达稳定性,结果表明,TUB A、TUB B 和CDK A 在所有样本中的表达比较稳定。就物种本身而言,TUB A、TUB B、CDK A、ACT 和COPA 在P. multistriata 中的表达稳定性较好,而TUB A、TUB B、CDK A、GAPDH、H4 以及 RPS 则在P.arenysensis 的表达稳定性较高[11]。在评估低温、不同光照强度以及不同昼夜周期培养条件下微拟球藻(Nannochloropsis sp.)的内参基因(ACT1、ACT2、
TUA、TUB、EF1-α、GAPDH、UBQ、HIS、CYP、UBCE、18S、rbcL)时发现,培养条件的差异会造成最佳内参基因的不同。该研究还发现ACT2 在所有样品中的表达最为稳定,但在单独处理组中却并不稳定,而18S 在所有样品中的表达最不稳定,但在低温处理组中的表达最为稳定[12]。另有研究分析了绿潮原因种缘管浒苔(Ulva linza)的10 个内参基因(ACT1、
ACT2、H2、H3、TUB1、TUB2、UBQ、EF1α、GAPDH、18S)在不同培养条件下的表达稳定性,发现不同盐度和紫外线处理组的最佳内参基因为TUB2,H2 在不同温度和干燥胁迫下均能稳定表达,而18S 在不同光照强度处理组表现出更好的稳定表达性。值得一提的是,在上述基因中并没有发现适用于分析所有样本的内参基因[13]。综上所述,内参基因在不同实验体系中的表达稳定性不同,根据实际情况选择合适的内参基因十分重要。
铁元素是叶绿体电子传递系统一个重要的辅助因子[14],它会影响细胞内功能基因的转录表达,从而对光合器官碳固定、电子传递以及光利用的能力产生影响[15–17]。研究发现,高铁浓度条件下小球藻Chlorella sorokiniana 的细胞密度显著高于低铁组,且参与细胞生长的碳酸酐酶(carbonic anhydrase, CA)以及与脂质合成相关的乙酰辅酶A 羧化酶(acetyl CoA carboxylase,ACCase)和胆碱转运体(choline transporter, CT)基因的表达量均有所增加,这说明铁离子浓度的增加不仅会影响细胞的碳固定,还可能会影响碳的流向[18]。目前,关于铁培养条件下微藻内参基因筛选的研究较少,Actin 和泛素连接酶(ubiquitin ligase, UBL)基因是较为常见的内参基因[19–20]。为了研究不同铁离子浓度培养条件下玛氏骨条藻碳固定相关功能基因的表达情况,十分有必要对内参基因的稳定性进行分析。为此,本研究选取7 个候选内参基因,包括Cytb、EF-1α、HPRT、UBC、GAPDH、β-actin 以及β-tubulin,采用qRT-PCR 技术,结合geNorm[21]、NormFinder[22]和BestKeeper[23]3 个统计学软件对它们在不同铁处理条件下的表达稳定性进行评估,同时,以磷酸烯醇式丙酮酸羧化酶(PEPC1、PEPC2)基因为目的基因,采用2−ΔΔCt法[24]来验证评估结果的准确性,以期筛选出合适的内参基因,为后续玛氏骨条藻碳固定相关功能基因的研究提供参考。
2 材料与方法
2.1 玛氏骨条藻的培养
玛氏骨条藻(Skeletonema marinoi)保存于中国海洋大学海洋环境与生态教育部重点实验室藻种室,以f/2 培养基为基础,光照周期为12 h/12 h,光照强度为80~100 μmol/ (m2·s),培养温度为(20±1)℃。实验时,取少量处于指数生长中期的玛氏骨条藻,离心去除培养液,将收集得到的藻细胞转接于不同浓度Fe3+(用FeCl3·6H2O 配制)的培养基中,共设5 个处理组,添加的Fe3+浓度分别为:1.5 μmol/L、3.0 μmol/L、6.0 μmol/L、12.0 μmol/L、24.0 μmol/L,每个处理组设置3 个生物学重复。其中,培养容器为500 mL 容量瓶,培养体积为400 mL。为了保证无菌环境,在培养起始时加入终浓度为50 mg/L 的氨苄青霉素。每天定时取样监测藻细胞密度,细胞密度的测定利用光密度法(680 nm)来完成,根据测定的吸光度值,结合已经绘制好的标准曲线(图1)来计算。待细胞生长进入稳定期后(培养第11 天),离心收集藻细胞,液氮速冻后−80℃保存备用。
2.2 样品总RNA 的提取和cDNA 的合成
参照Trizol reagent(Invitrogen,美国)试剂说明书对不同铁离子浓度培养条件下玛氏骨条藻的总RNA进行提取。利用DS-11 超微量紫外可见分光光度计(DeNovix, 美国)和1%的琼脂糖凝胶电泳对RNA 的质量和浓度进行检测,待检测质量合格后,每个样品选取400 ng 总RNA,使用PrimeScript RT reagent Kit with gDNA Eraser 试剂盒(北京宝日医生物技术有限公司,中国)进行基因组DNA 的去除和cDNA 的反转录合成,获得的cDNA 样品保存于−20℃备用。
2.3 引物的设计和验证
根据玛氏骨条藻转录组数据(原始序列已提交至https://www.ncbi.nlm.nih.gov/,登陆号为:GSE77468),获取Cytb、EF-1α、PEPC1 以及PEPC2 等9 个基因的序列,利用Primer Premier 5 软件进行引物设计。设计好的引物交由北京六合华大基因有限公司合成,用于后续的实验分析。
以反转录得到的cDNA 为模板进行PCR 扩增,采用20 μL 体系:1 μL 模板cDNA,正、反向引物(10 μmol/L)各1 μL,10 μL 2×Easy TaqPCR super mix(北京全式金生物技术有限公司,中国),7 μL 无菌水。每个样本设置2 个平行,反应设置阴性对照。反应程序为:95℃预变性5 min;95℃变性30 s,60℃退火45 s,72℃延伸1 min,35 个循环;72℃延伸5 min。反应完成后,取3 μL PCR 产物进行琼脂糖(2%)凝胶电泳检测,观察电泳条带是否单一,如若单一,将PCR 扩增产物和其对应的引物送至北京六合华大基因有限公司进行测序,检测PCR 产物是否为目的片段。
2.4 qRT-PCR 的反应条件的设置
采用SYBR GreenⅠ染料法,在7500 Real-Time PCR system(Applied Biosystems,美国)上进行qRTPCR 扩增和数据分析。采用20 μL 体系:10 μL Fast-Start Universal SYBR Green Master(Roche, 瑞士),正、反向引物(10 μmol/L)各0.6 μL,0.2 μL BSA(20 mg/mL),2 μL cDNA,6.6 μL 的灭菌水。反应程序为:95℃预变性5 min;95℃变性15 s,53℃(56℃,60℃)退火延伸1 min,40 个循环。每个反应设置3 个技术重复,每次实验设置阴性对照。引物的退火温度根据熔解温度(Tm值)来进行设置,其中,Cytb 的退火温度为53℃,UBC、GAPDH、HPRT 以及PEPC2 的退火温度为56℃,其余4 个基因的退火温度为60℃。
2.5 引物扩增效率的计算
利用稀释模板cDNA 的方法,通过qRT-PCR 反应获得不同浓度梯度下各个反应的Ct 值,计算引物的扩增效率。具体的实验方法如下:等量移取15 个样品的cDNA,充分混合后依次稀释7 个梯度,每个梯度稀释2 倍,则浓度分别为原液的1、1/2、1/4、1/8、1/16、1/32 和1/64。每个反应设置3 个技术重复,每次实验设置阴性对照。以稀释倍数的对数值和样本的平均Ct 值分别作为横、纵坐标做直线拟合分析,得到斜率k 和确定系数R2。根据公式A=10−1/k−1,计算出引物的扩增效率A。
2.6 数据的处理与分析
读取每个反应的Ct 值,计算出单个候选内参基因在每个样品中的平均值(Ct′),利用GeNorm、NormFinder 和BestKeeper 软件分析7 个候选内参基因在不同铁浓度培养条件下的稳定表达系数。其中,BestKeeper 软件可以直接对Ct′值进行分析,而GeNorm 和NormFinder 两个软件需要将Ct′值转化为Q 值(基因的相对表达量)后,才可进行分析。转化公式为Q=EΔCt′,其中,ΔCt′为该基因在所有处理组中的最小值减去该基因在各个处理组样品中的Ct′值,E=2A,当引物的扩增效率(A)接近100%时,E 通常默认为2。
3 结果与讨论
3.1 不同浓度Fe3+培养条件下玛氏骨条藻的生长状况分析
不同浓度Fe3+培养条件下玛氏骨条藻的生长曲线如图2 所示,培养11 d 后,5 个处理组的细胞生长均已进入稳定期,离心收集玛氏骨条藻细胞样品,以备后续实验的需要。由图2 可知,各组在前5 d 的细胞密度差异较小,表明此时培养基中的营养盐较为充足,适合玛氏骨条藻的生长。从培养第6 天开始,各组细胞密度开始出现不同,基本表现为培养液中初始Fe3+浓度越高,细胞的最终密度则越大。通过计算发现,1.5 μmol/L、3.0 μmol/L、6.0 μmol/L、12.0 μmol/L、24.0 μmol/L Fe3+处理组的平均生长速率分别为0.319 d−1、0.324 d−1、0.327 d−1、0.330 d−1以及0.335 d−1,其中,1.5 μmol/L Fe3+处理组的平均生长速率显著低于6 μmol/L、12 μmol/L以及24 μmol/L 处理组(p< 0.05),而与3 μmol/L 处理组的平均生长速率并无统计学上的显著差异。同时,3 μmol/L、6 μmol/L 和12 μmol/L 处理组的平均生长率并无显著差别,但前两者的平均生长率却显著低于24 μmol/L 处理组,而后者与24 μmol/L 处理组并无显著差别。简而言之,Fe3+浓度的升高从一定程度上可以促进玛氏骨条藻的生长。
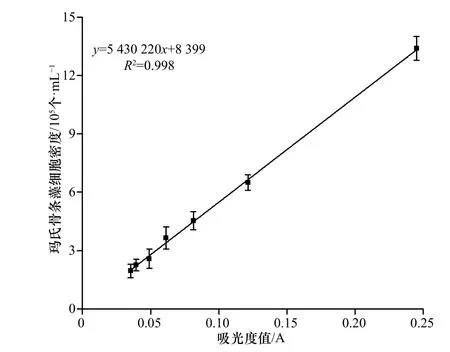
图 1 吸光度值与玛氏骨条藻细胞密度的线性关系Fig. 1 The linear relationship between absorbance value and cell density of Skeletonema marinoi
3.2 总RNA 的质量检测
在qRT-PCR 分析中,检测RNA 的纯度和完整性是十分必要的。使用DS-11 超微量紫外可见分光光度计(DeNovix,美国)检测总RNA 的浓度和纯度。检测结果表明,15 个样品的A260/A280在1.85~1.98 之间,说明RNA 的纯度较高;其中260 nm 是核酸的最高吸收峰的吸收波长,280 nm 是蛋白质的最高吸收峰的吸收波长。使用1%琼脂糖凝胶电泳检测RNA 的完整性,发现能够较为清晰的显示3 个条带,由上到下分别为28SRNA、18SRNA 以及small RNAs 条带,这说明RNA 的质量较好,基本没有发生降解,可满足后续qRT-PCR 实验的要求。
3.3 引物特异性验证和扩增效率的测定
以反转录得到的cDNA 为模板进行PCR 扩增,同时对9 对引物分别设置阴性对照,利用2%琼脂糖凝胶电泳对上述PCR 的结果进行检测,发现各对引物的扩增片段电泳条带单一且清晰,无弥散现象,且所有的阴性对照结果均为阴性,图3a、图3b 中展示的分别是Cytb、PEPC1 基因的阴性对照结果。将PCR产物和其对应的引物进行测序,将测序结果与原基因序列BLAST 比对发现,PCR 产物与原基因序列高度一致,表明这些引物均能成功进行目的片段的扩增。
以2 倍浓度梯度稀释的cDNA 为模板,进行qRTPCR 扩增,根据获得的数据进行线性拟合分析,从而获得9 个基因的标准曲线,结果显示上述9 个基因的确定系数R2≥0.984。将标准曲线的斜率k 带入公式A=10−1/k−1,获得引物的扩增效率,结果显示引物的扩增效率在99.0%~104.0%之间,符合qRT-PCR 对扩增效率的要求(表1)。同时,分析各个基因的熔解曲线发现,都只产生单一峰,技术重复样品间的曲线重叠性好,阴性对照组无对应的信号。上述结果表明所设计的引物特异性较强,qRT-PCR 反应的结果准确可信。
3.4 内参基因的表达分析
qRT-PCR 分析了7 个候选内参基因在5 个不同铁离子浓度处理组的表达丰度(图4),结果显示,所有候选内参基因的Ct 值在19.0~32.3 之间,其中,Cytb、EF-1α 和β-actin 基因的Ct 值较低,分别在19.0~21.0、19.7~21.8 和20.6~22.4 之间;GAPDH 和U B C 基因的C t 值较高,分别在2 6.4 ~3 0.9 和28.9~32.3 之间;而HPRT 和β-tubulin 的Ct 值则分别在23.6~28.5 和24.3~27.1 之间,上述这些结果说明上述内参基因不仅在表达丰度上存在一定的差异,而且表达稳定性也有所不同。
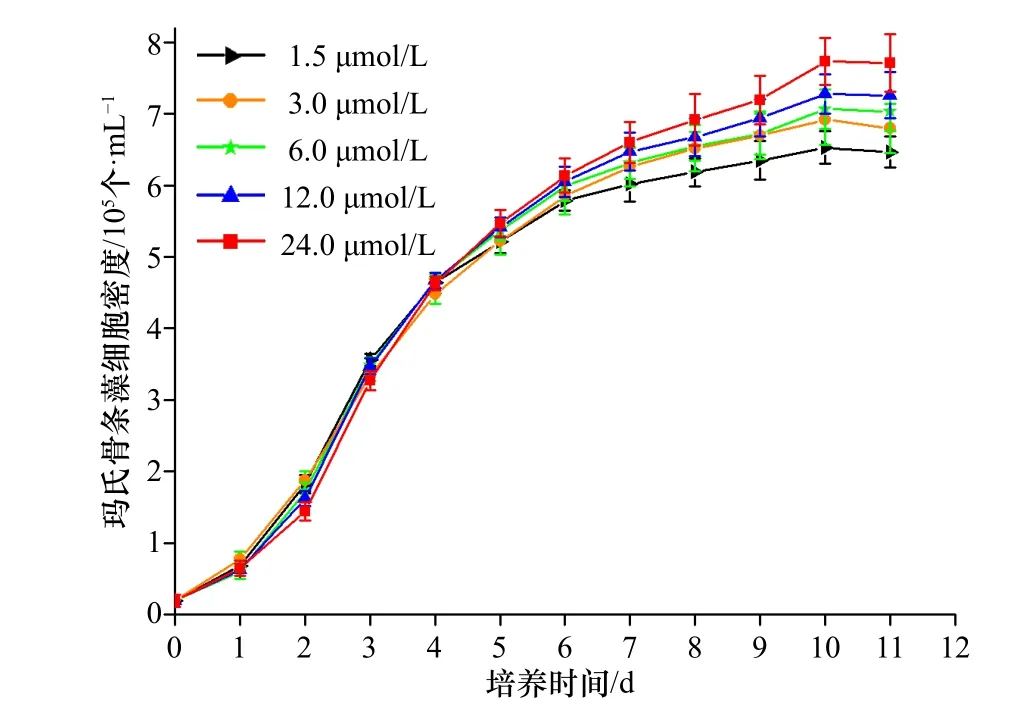
图 2 不同浓度Fe3+培养条件下玛氏骨条藻的生长曲线Fig. 2 Growth curves of Skeletonema marinoi in different concentration of Fe3+ conditions
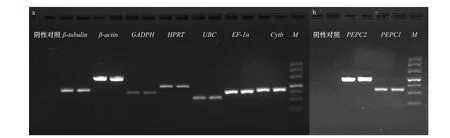
图 3 9 个基因的PCR 产物电泳结果Fig. 3 Agarose gel electrophoresis of PCR product of seven reference genes
3.5 内参基因的稳定性分析
3.5.1 GeNorm 分析
GeNorm 通过对内参基因在不同处理组中的平均表达稳定指数(average expression stability value, M)进行排序来确定最稳定表达的基因,M 值越大,内参基因的稳定性越低,反之,稳定性越好。在分析过程中,逐步排除掉M 值高的基因,然后再重新计算剩余内参基因的M 值,直至筛选出最稳定的两个内参基因。通常认为M<1.5 的内参基因表达相对稳定。GeNorm软件的分析结果表明,7 个候选内参基因的M 值均小于1.5,说明上述7 个基因的表达都较为稳定。在7 个候选内参基因中,Cytb 和EF-1α 的M 值最低(0.252),说明这两个基因的稳定性最好;HPRT 的M 值最高(0.786),说明它是所选内参基因中最不稳定的。根据M 值的大小对7 个候选内参基因的稳定性进行排序,稳定性由强到弱的顺序为:EF-1α=Cytb>β-tubulin>β-actin>UBC>GAPDH>HPRT(图5)。
GeNorm 还可通过引入一个新的内参基因计算标准化因子(normalization factor)的配对变异(pairwise variation)V 值来确定合适的内参基因数目。GeNorm 默认的V 值为0.15,即当Vn/(n+1)<0.15 时,则最适的内参基因数目是n 个,反之,最适的内参基因数目是(n+1)个。在本实验中,V2/3=0.110<0.15,所以本实验应该选择2 个内参基因对目的基因的qRT-PCR 反应进行校正和标准化(图6)。

表 1 qRT-PCR 检测中9 个基因的引物序列及其他相关信息Table 1 Primer sequences and other relevant information of nine genes in qRT-PCR
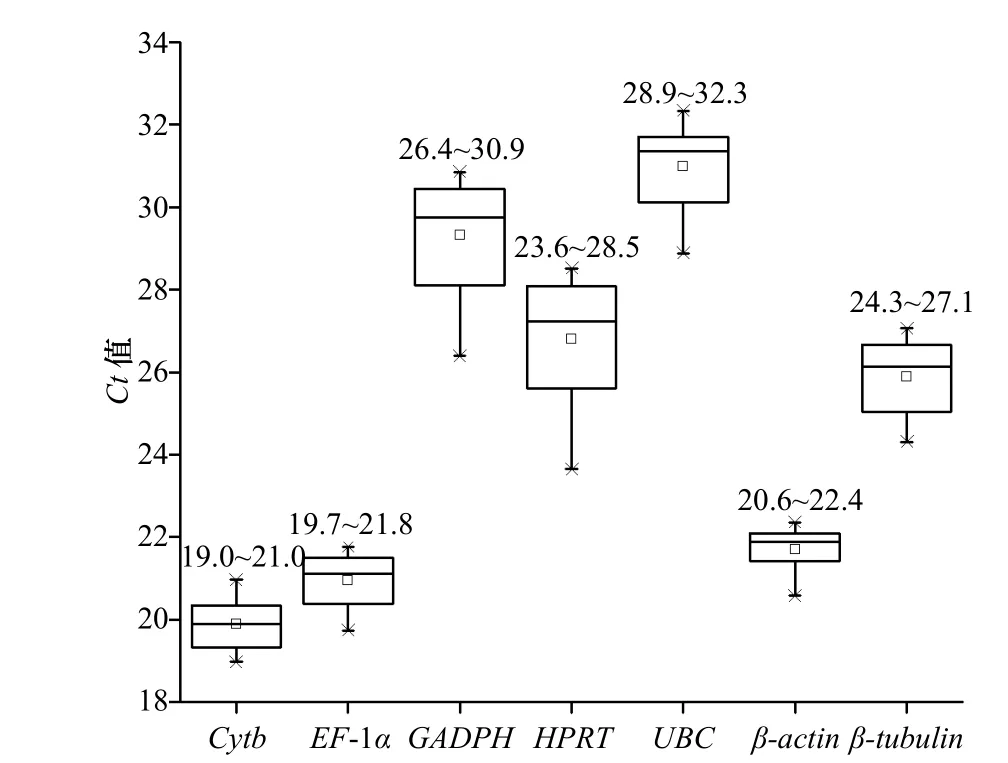
图 4 不同浓度Fe3+处理组中各个内参基因的表达丰度Fig. 4 The expression abundance of each reference gene in the treatment group with different concentration of Fe3+ conditions
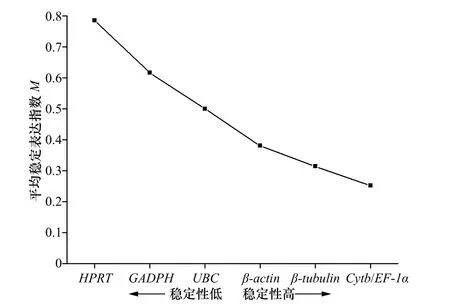
图 5 GeNorm 分析7 个候选内参基因的表达稳定性指数Fig. 5 The average expression stability value (M) of seven candidate reference genes calculated by GeNorm
3.5.2 NormFinder 分析
NormFinder 的计算原理与GeNorm 相似,也是先获得内参基因的M 值,再根据M 值的大小来筛选出最稳定表达的一个内参基因。结果表明(表2):不同浓度Fe3+培养条件下,EF-1α 的M 值最低(0.084),说明它的稳定性是所选内参基因中最好的;HPRT 的M 值最高(0.800),说明它的稳定性最差。7 个候选内参基因按照稳定性从强到弱排序依次为:EF-1α>β-tubulin>Cytb>UBC>β-actin>GAPDH>HPRT。值得注意的是,NormFinder 和GeNorm 两个软件筛选出来的最稳定表达的内参基因均为EF-1α,而稳定性最差的均为
HPRT。
3.5.3 BestKeeper 分析
BestKeeper 程序是一个内置公式的Excel 表格,通过输入Ct 值对各个内参基因的稳定性进行分析。在BestKeeper 的输出结果中,标准偏差(SD)和变异系数(CV)是表征内参基因在样品中表达稳定性的指标。内参基因稳定性的判定原则为:SD 和CV 越小,内参基因的稳定性越好,反之,稳定性越差,通常认为SD<1 的内参基因表达相对稳定。相关系数(r)则表征的是候选内参基因与其余内参基因的相关性,是选择内参组合的重要指标,r 越大,说明该基因与其他基因的相关性越高,适合同其他内参基因协同作为内参组合。BestKeeper 的分析结果(表3)显示:βactin 在不同浓度Fe3+培养条件下玛氏骨条藻样品中的表达比较稳定(SD 为0.23),适合作为qRT-PCR 反应的内参基因,而GAPDH 的SD 值为1.03,其稳定性较差,不适合被用作内参基因。7 个内参基因按照稳定性从强到弱排序依次为:β-actin>Cytb>EF-1α>β-tubulin>UBC>HPRT>GAPDH。相关系数的分析结果显示,EF-1α 和β-tubulin 最适合与其他内参基因协同作为内参组合,随后是UBC、Cytb、GAPDH 和HPRT,而β-actin 最不适合。
3.6 内参基因的确定
利用GeNorm、NormFinder 和BestKeeper 软件对不同浓度Fe3+培养条件下玛氏骨条藻7 个候选内参基因的稳定性进行评估,结果表明这些候选内参基因的排序结果略有差异,这可能是由于软件的统计学算法不同导致的。这种现象在黄瓜(Cucumis sativus)[25]、亚麻(Linum usitatissimum)[26]以及柑橘(Citrus genotypes)[27]等植物的研究中也曾出现过。基于上述结果,我们对每种软件分析得到的内参基因的稳定性进行排序并给予赋值,表达稳定性由强到弱依次赋值为1、2、3、4、5、6 和7,然后对3 种软件的分析结果(表4)进行统计,结果显示EF-1α 得分最低,Cytb次之,随后是β-tubulin、β-actin、UBC 以及GAPDH,而HPRT 的得分最高。因此,可以认为在不同浓度Fe3+培养条件下,玛氏骨条藻7 个候选内参基因稳定性的排序为:EF-1α>Cytb>β-tubulin>β-actin>UBC>GAPDH>HPRT。综合来看,EF-1α 和Cytb 基因的稳定性较好。
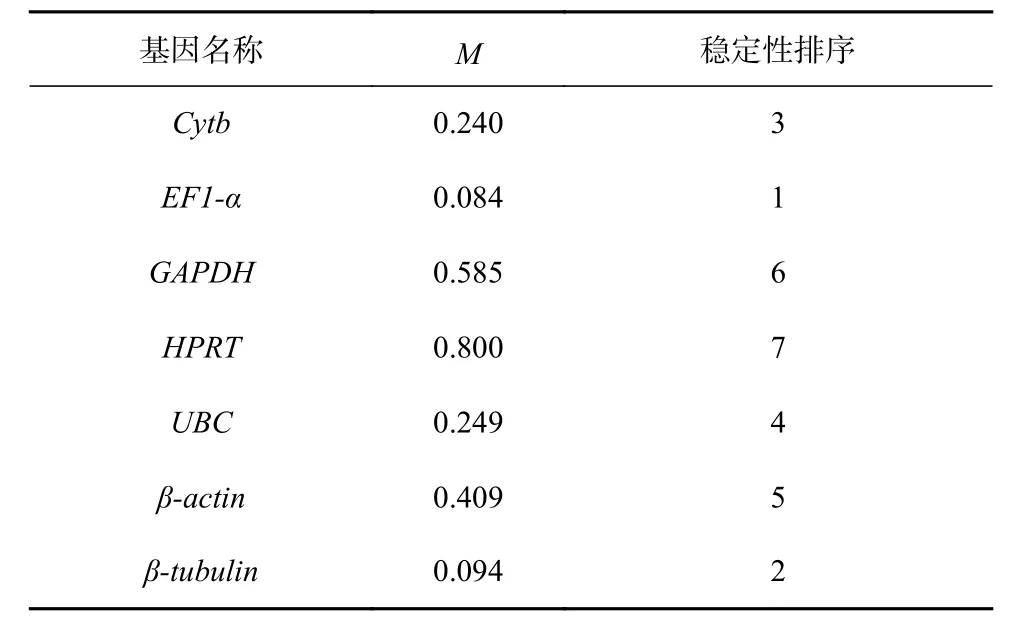
表 2 NormFinder 分析7 个内参基因的表达稳定性指数Table 2 The average expression stability value (M) of seven reference genes calculated by NormFinder
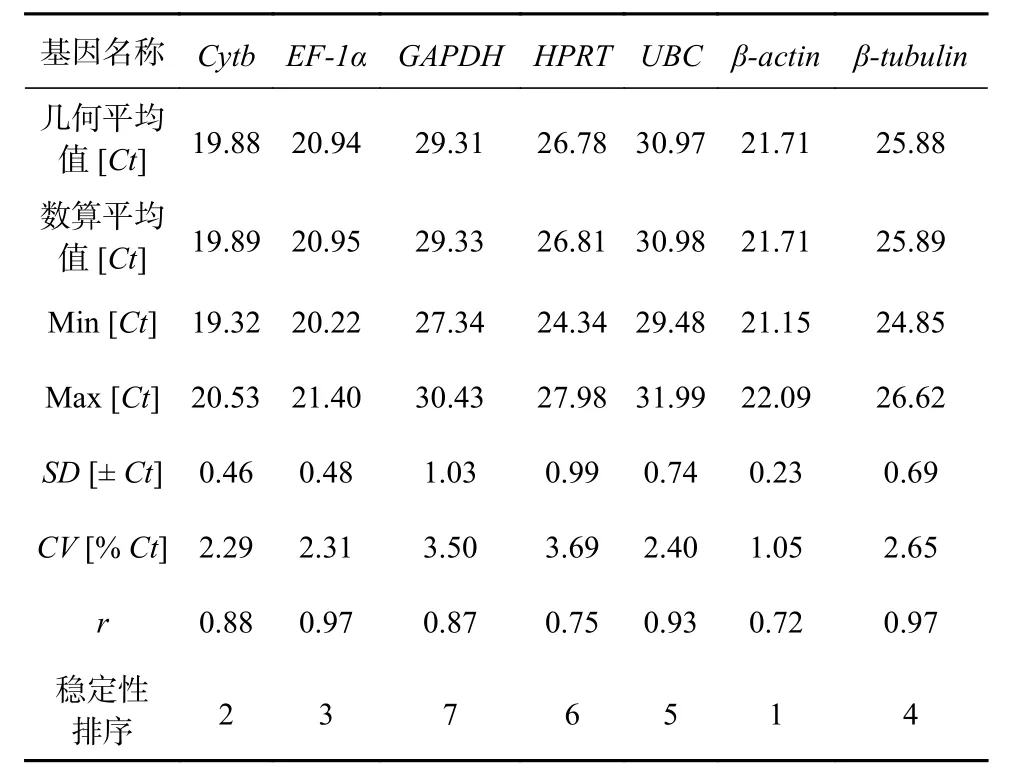
表 3 BestKeeper 分析7 个内参基因的表达稳定性指数Table 3 The average expression stability value(M)of seven reference genes calculated by BestKeeper
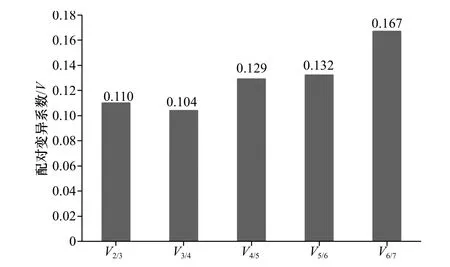
图 6 内参基因的配对变异分析Fig. 6 Analysis pairwise variations of reference genes
在qRT-PCR 分析中,使用不理想的内参基因会给实验结果带来偏差[28],同时,只使用单一内参基因进行校准和标准化,也会给结果的可靠性和准确度带来影响[29]。为了消除单一内参基因所带来的定量偏差,Schmid 等[30]建议在标准化过程中至少使用2 个内参基因对实验结果进行校正。前已述及,GeNorm软件的配对变异(pairwise variation)V 值结果表明最佳的内参基因数为2,通过上述分析发现最稳定表达的两个基因为EF-1α 和Cytb。同时,EF-1α 和Cytb 的相关系数(分别为0.97 和0.88)均较大,适合同其他基因协同作为内参基因。因此,建议选择(EF-1α+Cytb)的内参组合进行不同浓度Fe3+培养条件下目的基因的校正。
3.7 内参基因稳定性验证
磷酸烯醇式丙酮酸羧化酶(PEPC)广泛存在于植物中,是一种细胞质酶,其催化C4光合作用固定CO2的起始反应。我们在玛氏骨条藻转录组里发现了2 个PEPC 基因,分别命名为PEPC1 和PEPC2。为了验证不同内参基因对qRT-PCR 实验结果的影响,采用2−ΔΔCt法,分别以7 个内参基因和稳定性最佳的组合(EF-1α+Cytb)为内参基因,分析PEPC1 和PEPC2 在不同铁浓度处理组中的表达模式。由图8可知,以(EF-1α+Cytb)、Cytb 或EF-1α 为内参基因时,目的基因在不同浓度铁离子处理组的表达趋势基本一致,表明Cytb 和EF-1α 这两个基因的表达稳定性较好,而以GADPH、HPRT 等基因为内参基因时,我们发现目的基因的相对表达量与前三者存在明显的差别,表明这些基因在不同铁离子处理组的表达稳定性较差,不适合作为内参基因对目的基因的相对表达量进行准确校正。上述结果说明,运用qRT-PCR 分析目的基因时选用不恰当的内参基因会错误估计目的基因的相对表达量,由此可见,筛选合适的内参基因至关重要。
4 结论
本研究中,Cytb 和EF-1α 基因的稳定性最好。Cytb 是线粒体自身编码的为数不多的功能蛋白之一,其参与呼吸链的电子传递,在细胞的能量代谢中发挥着重要的作用[31]。何闪英等[32]在研究增殖细胞核抗原基因表达量与中肋骨条藻生长时发现,Cytb 基因表达量变化较小,可以作为内参基因对目的基因进行校正。EF-1α 是一种多功能蛋白,其与多种重要的细胞学过程密切相关,包括细胞骨架组成、信号传导、翻译控制及细胞凋亡等[33]。研究发现,在梧桐(Firmiana simplex)种子[34]和黑麦草(Lolium perenne)[35]的不同发育阶段、杨树(Populus L.)[36]和黄瓜(Cucumis sativus)[25]不同组织中EF-1α 基因的表达较为稳定,这说明在某些特定条件下,EF-1α 基金适合作为基因表达研究中的内参基因。本研究中β-tubulin、β-actin、UBC、GADPH 等基因的稳定性较差,在其他研究中既发现了类似的结果,也发现了相反的结果。辐射条件下,β-tubulin、β-actin 以及GADPH 在莱茵衣藻(Chlamydomonas reinhardtii)中的表达比较稳定,而UBC 的稳定性较差[37],但在对短柄草(Brachypodium distachyon)的研究中却发现UBC 的稳定性较好[38]。对毛果杨(Populus trichocapra)而言,β-tubulin 在不同组织中稳定性最差,GADPH 在锌胁迫的组织中表达最不稳定,不适合作为内参基因[39]。可见,同样的内参基因在不同物种或实验条件下的表达稳定性存在显著差异。因此,应该根据样品的类型筛选合适的内参基因进行目的基因的标准化。
近些年来的研究表明,传统的单一内参基因会给结果的可靠性和准确度带来不良影响,因此建议选择内参基因组合对目的基因进行校正和标准化[21]。吴文凯等[40]研究发现,以不同看家基因构成的多内参基因组合可能更有利于单细胞绿藻目的基因的相对表达分析。Shim 等[41]分析了红藻Bostrychia moritziana 的11 个内参基因(EF-1α、GAPDH、ACTB、PUB、30S、60S、TUBB、TUBA、TIF、UbCE、cdH)在不同生活史阶段(雄性、雌性、果孢子体和四分孢子体)的表达稳定性,结果表明,GAPDH 和30S 的组合更能保证目的基因相对表达的准确性。Liu 等[42]为冰冻胁迫条件下南极冰藻Chlamydomonas sp. ICE-L 筛选内参基因时发现,使用RPL19 和GAPDH 的内参基因组合有助于获得更加精确的实验结果。类似的现象也出现在了湛江等边金藻(Isochrysis zhangjiangensis)的分析结果中,研究发现在氮胁迫条件下,ACT 和TUB 的内参基因组合是研究目的基因表达最可行的内控方法[43]。上述结果表明,使用内参基因组合有助于获得更加精确的分析结果。从本研究的结果来看,HPRT、UBC、GAPDH、β-actin 以及β-tubulin 的稳定性较差,不适合用作铁处理条件下的内参基因,而EF-1α 和Cytb 的表达比较稳定,适合用作内参基因。同时,GeNorm 配对变异分析结果表明最佳内参基因个数为2,且EF-1α 和Cytb 的相关系数均较大(分别为0.97 和0.88),适合作为内参基因组合对目的进行进行校正。因此,本研究建议选择EF-1α+Cytb 组合进行不同Fe3+浓度处理下目的基因的校正。
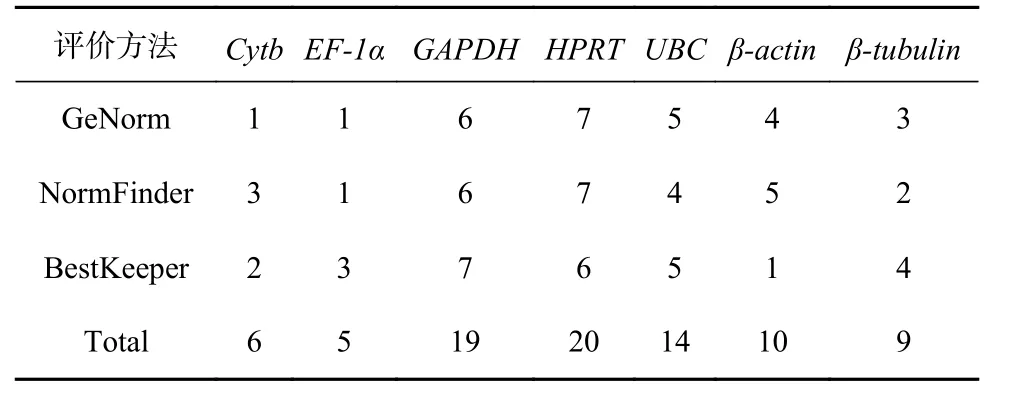
表 4 7 个内参基因的表达稳定性的统计分析Table 4 Statistical analysis of the expression stability of seven reference genes
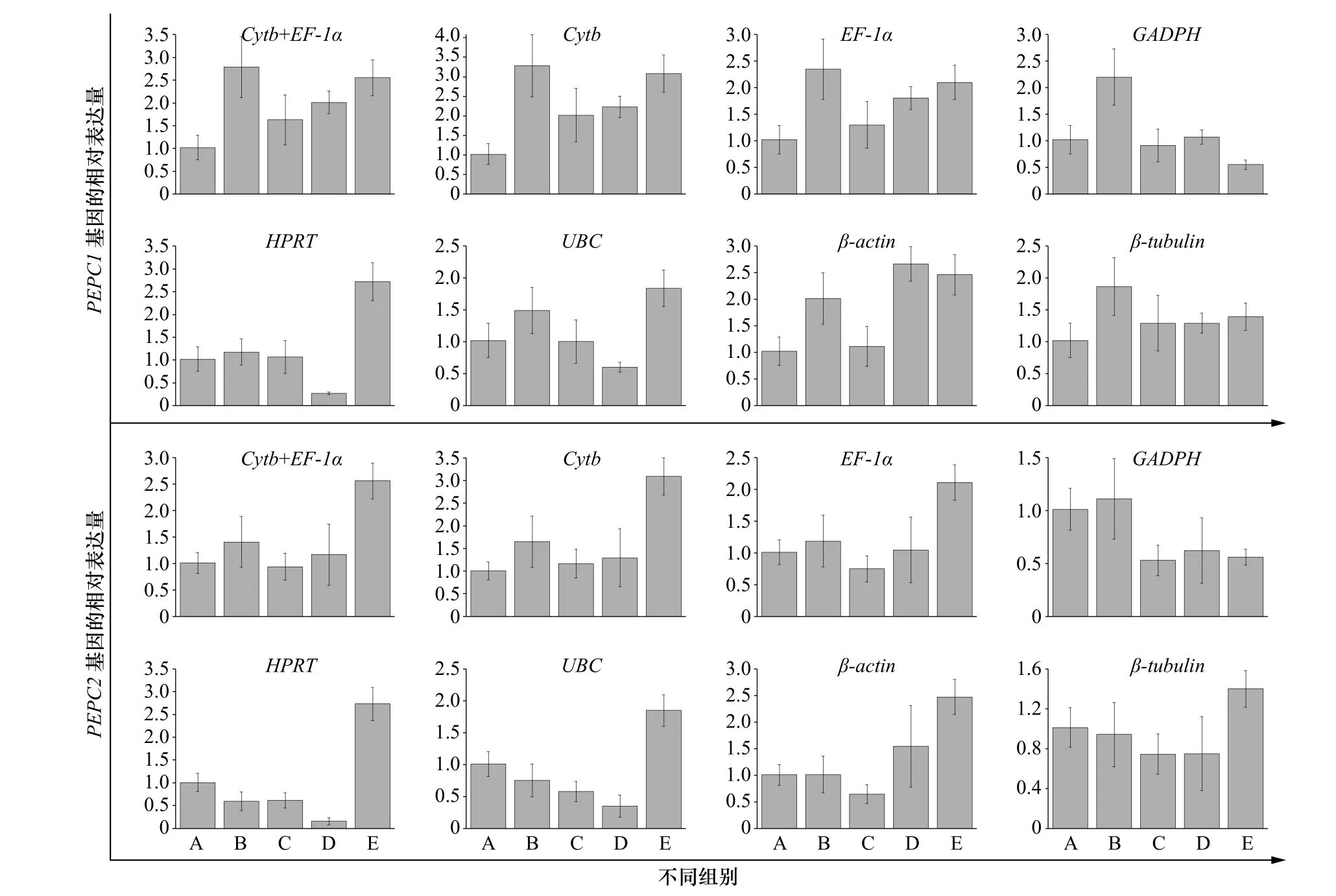
图 7 不同内参基因条件下PEPC1 和PEPC2 基因的相对表达量分析Fig. 7 Analysis of relative expression of PEPC1 and PEPC2 genes in different reference genes conditions

