急慢性布鲁氏菌病患者Th1/Th2细胞及相关转录因子研究
蔺志强,张 蕊,秦 莹,木尼热·库尔班,何雯雯,李智伟,丁剑冰, 张峰波
(1新疆维吾尔自治区第六人民医院检验科,乌鲁木齐 830013;2新疆医科大学基础医学院免疫学教研室,乌鲁木齐 830011;3新疆维吾尔自治区人民医院临床检验中心,乌鲁木齐 830001;4新疆医科大学第一附属医院检验科,乌鲁木齐 830054)
布鲁氏菌是由一种兼性厌氧的胞内感染菌,可引起布鲁氏菌病。我国新疆是流行区域,以羊种布鲁氏菌病为主[1]。病程长并且有近1/5转为慢性化[2],发病机制可能与T细胞的免疫应答机制有关,外周血T细胞亚群是反映患者免疫状态的重要指标,因此明确布鲁氏菌感染不同阶段患者的免疫状态可以为布鲁氏菌病慢性化的免疫机制研究提供理论依据。CD4+T细胞在效应阶段能分化成Th1和Th2细胞。Th1在发挥抗感染作用,Th2细胞发挥诱导体液免疫的功能,Th1和Th2细胞的平衡影响着感染性疾病的转归[3]。由于布鲁氏菌的慢性化的免疫机制尚不清楚,Th1和Th2细胞相关细胞因子也报道存在异常变化[4]。本研究通过流式细胞技术和实时定量PCR分别对急慢性布鲁氏菌病患者的Th1和Th2细胞比例及相关转录因子T-bet、GATA-3的mRNA表达情况进行检测,旨在明确布鲁氏菌病慢性化过程中Th1和Th2免疫细胞的变化情况,为布鲁氏菌病免疫治疗提供理论依据。
1 材料与方法
1.1 一般资料收集2019年1-6月在新疆维吾尔自治区第六人民医院住院并明确诊断为急性布鲁氏菌病的患者56例,年龄18~66岁,平均年龄(45.6±17.1)岁,男性35例,女性21例。收集慢性患者48例,年龄18~72岁,平均年龄(48.5±19.3)岁,其中男性33例,女性15例,分为急性布鲁氏菌病组和慢性布鲁氏菌病组。收集同期健康体检者为健康对照组。布鲁氏菌病诊断标准:疾病诊断符合2012 年颁布的《布鲁氏菌病诊疗指南(试行)》标准。急性组均为6个月以内病程,超过6个月仍未痊愈为慢性组。选择同期健康人群57例作为健康对照组,其中男性39例,女性18例,平均年龄(44.5±15.3)。各组性别、年龄差异无统计学意义(P>0.05)。排除标准:患有肿瘤、其他自身免疫病和感染性疾病。所有研究对象均都被告知标本采集的目的并签署知情同意书,批准号:KY201803742。
1.2 仪器和试剂美国BD FACS Calibur流式细胞仪,美国BIO-RAD实时定量PCR仪,CD3 percp(552851,SP34-2),CD4 FITC(550628,L200),IL-4 PE(551774,8D4-8),IFN-γ APC(554702,B27),破膜剂IntraSureTMKit(641776),溶血素(349202),均购自BD公司。美国GE淋巴细胞分离液Ficoll-Paque 密度梯度液(17-5442-02),上海爱必信PMA刺激剂(abs9107-5 mg),北京全式金TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix(AT311),北京天根Talent荧光定量检测试剂盒(SYBR Green)。
1.3 方法
1.3.1 样本处理 采集患者及健康人群静脉血6 mL乙二胺四乙酸(EDTA)抗凝,用Ficoll依照说明书操作步骤提取PBMC,分成2管,1管PBMC用于Th1和Th2细胞检测,其余加入TRLZOL冻入-80℃低温冰箱保存。
1.3.2 流式细胞检测 采用流式细胞仪检测Th1和Th2细胞比例。每个标本取200 μL外周血单个核细胞(PBMC,1×106个/L)于96孔板中,加入10 μL(1 μg/mL)PMA刺激4 h。刺激后的细胞取出加入抗体CD3和CD4各20 μL,室温避光孵育10 min。加入破膜剂A液100 μL,放置5 min。洗涤离心后去上清后加入20 μL IL-4和5 μL IFN-γ,同时加入破膜剂B液50 μL室温避光孵育15 min。洗涤离心后去上清后加入500 μL磷酸盐缓冲液(PBS)重悬后上机检测。
1.3.3 实时定量PCR检测 使用实时定量PCR检测Th1转录因子T-bet 和Th2转录因子GATA-3的mRNA水平。将冻存的标本取出,用Trizol试剂盒提取RNA,依照说明书步骤反转录成cDNA。扩增体系条件:95℃预变性3 min,95℃变性15 sec,55℃退火30 sec,72℃延伸30 sec,共40个循环,结果用2-△△Ct相对定量法,对急慢性布鲁氏菌病组与健康对照组的目的基因进行定量。引物由上海生工合成,T-bet-F:GGTTGCGGAGACATGCTGA,T-bet-R:
GTAGGCGTAGGCTCCAAGG;GATA-3-F:GCC-
CCTCATTAAGCCCAAG,GATA-3-R:TTGTGG-
TGGTCTGACAGTTCG;β-Actin_F:CATGTACG-
TTGCTATCCAGGC,β-Actin_R:CTCCTTAAT-
GTCACGCACGAT。
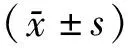
2 结果
2.1 流式细胞术检测Th1和Th2细胞结果3组人群Th1和Th2占CD4+T的比例见表1。急性布病组Th1细胞比例显著高于慢性布病组及健康对照组(P<0.01),慢性布病组Th2细胞比例显著高于急性布病组(P<0.01)和健康对照组(P<0.05),见图1。
注:CD4+ IFN-γ+为Th1细胞; CD4+IL-4+为Th2细胞。
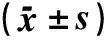
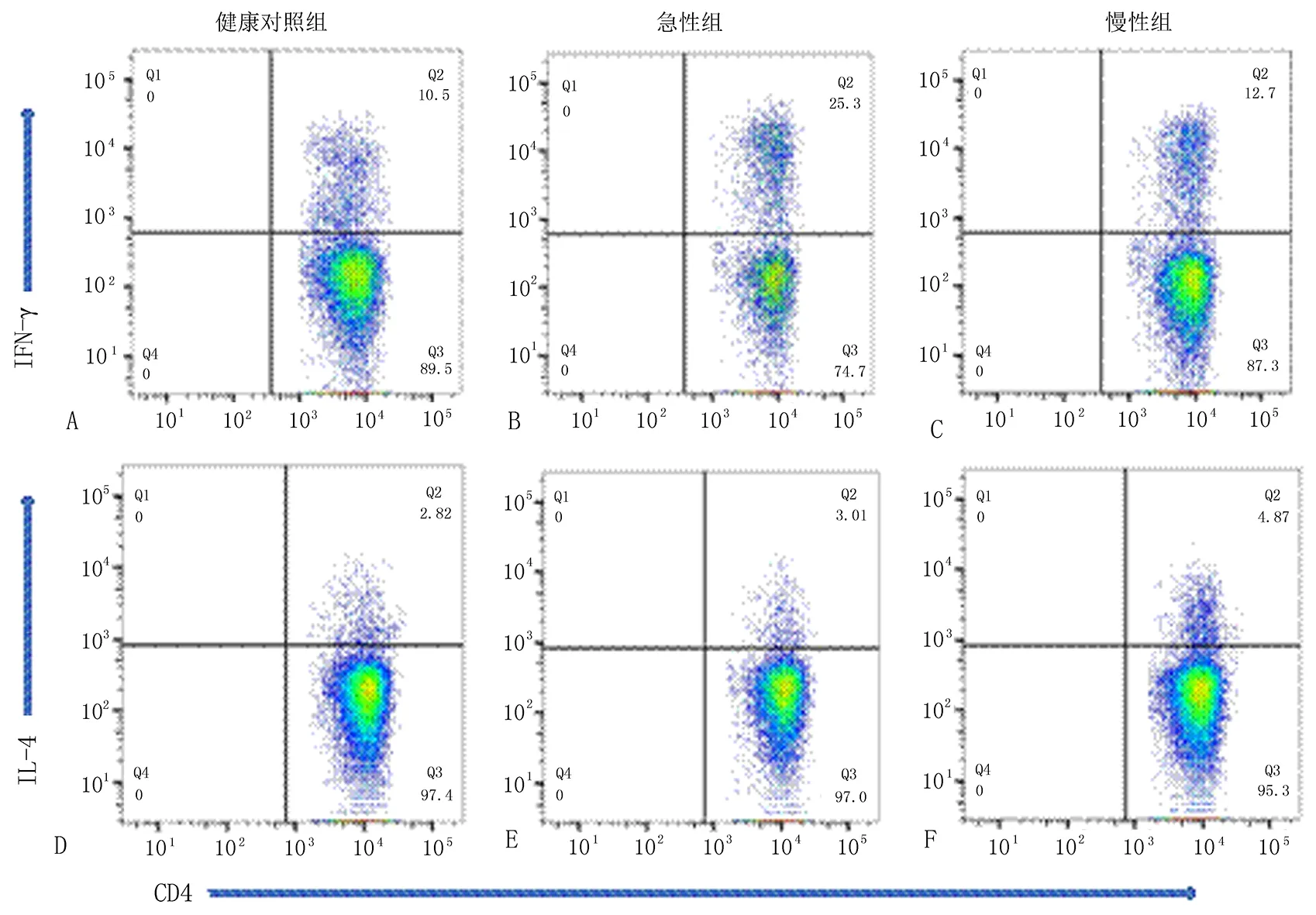
表1 3组人群Th1和Th2细胞比例
注:与健康对照组比较,*P<0.05,**P<0.01;与急性对照组相比较,▲P<0.01。
2.2 实时荧光定量PCR检测mRNA结果3组人群T-bet和GATA-3 mRNA表达水平见表2。急性布病组T-bet mRNA表达水平显著高于慢性布病组及健康对照组(P<0.01)。慢性布病组GATA-3 mRNA表达水平显著高于急性布病组和健康对照组(P<0.01)。
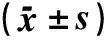
表2 3组人群T-bet和GATA-3 mRNA表达水平
注:与健康对照组比较,*P<0.05;与急性对照组比较,▲P<0.01。
3 讨论
布鲁氏菌病慢性化率较高,发生的免疫机制尚不清楚。布鲁氏菌是胞内寄生菌,细胞免疫发挥主要作用[5]。有研究认为T淋巴细胞亚群平衡发生紊乱可能是导致宿主不能清除布鲁氏菌的原因,最终转为慢性病程[6]。外周血T细胞是反映患者免疫状态的重要指标[7],辅助性T细胞是适应性免疫的关键作用细胞,它通过分化为Th1和Th2等亚型来发挥功能。Th1细胞主要通过分泌IFN-γ、TNF、IL-2等细胞因子介导细胞免疫和迟发型超敏反应。Th2细胞主要介导体液免疫应答,两者保持动态平衡以维持细胞免疫功能的稳定性。
本研究结果发现,布鲁氏菌在急性期的Th1细胞比例显著升高,而Th2细胞则未明显增加。说明Th1型细胞是急性布鲁氏菌病的主要亚型,在急性期发挥重要作用。这与Vitry等[8]证实在小鼠中布鲁氏菌感染时Th1细胞发挥了关键抗炎作用一致。T-bet是Th1细胞的转录因子,调控着Th1细胞的分化。T-bet通过增加IL-12R表达来活化IFN-γ基因,而T-bet降低会导致Th1细胞无法分化[9]。本研究mRNA结果显示在急性布病组比健康对照组的T-bet表达量高,说明在急性布鲁氏菌病时Th0细胞可以向Th1细胞分化。已有研究发现IFN-γ在急性布鲁氏菌病时也会大幅增加,而治疗后则恢复至正常水平[10]。本研究的结果进一步说明急性布鲁氏菌病时Th1型细胞开始分化,并且转录因子T-bet表达上调,分化成熟的Th1细胞分泌了更多的促炎性细胞因子来发挥抵御布鲁氏菌的感染的功能。
本研究发现在慢性期时,与急性布病组相比Th2细胞比例显著增加,而Th1细胞比例则开始下降,但都比健康对照组比例高。说明急性到慢性布鲁氏菌病时的演变过程中,发生了Th1细胞向Th2细胞的变迁。GATA-3是调节Th2细胞分化的重要转录因子,它可以促进IL-4基因的活化,同时会抑制Th1细胞的分化[11]。本研究结果显示,慢性布病组GATA-3明显较其他组增高,说明慢性布鲁氏菌病时,Th2细胞免疫占据了优势地位,并对Th1细胞产生了抑制作用。这种Th1向Th2细胞漂移的现象在其他感染类疾病中也报道,如结核、病毒、寄生虫均会发生不同程度的平衡漂移现象[12],导致病原菌无法完全清除。
总之,Th细胞通过分泌多种细胞因子在体内形成复杂的免疫网络,保持人体的正常免疫功能,一旦这种平衡被打破,会导致疾病的转归发生变化[13];因此控制Th1和Th2的平衡对于布鲁氏菌病的治疗显得尤为重要。本研究结果解释了部分布鲁氏菌病患者之所以发生急性期向慢性期的转变,是由于细胞免疫的类型由Th1型向Th2型漂移,但是引起Th1向Th2变化的原因仍需进一步深入研究。

