多发性骨髓瘤骨髓组织中磷脂酰肌醇-3激酶表达及其临床意义
多发性骨髓瘤(multiple myeloma,MM)为骨髓浆细胞恶性疾病,约占整个血液系统恶性肿瘤的10%以上,多见于老年人,现阶段随着人口老龄化进程的加快,我国MM的发病率逐年升高[1]。目前MM的治疗主要通过联合化疗及自体干细胞移植,然而治疗过程中仅有一小部分患者受益,绝大多数患者的生存和预后并未得到改善,因此寻找更有效的治疗方案与手段对改善MM患者的预后具有重要意义[2,3]。磷脂酰肌醇-3激酶(phosphatidylinositol-3 kinase,PI3K)由蛋白质合成,在转录与翻译过程中调节靶基因的表达,与肿瘤的发生及发展密切相关,参与细胞周期调节,促进肿瘤细胞的增殖[4,5]。本研究通过检测MM患者骨髓血浆PI3K水平,判断其在不同分期患者中的差异,阐述其与患者预后的关系,现报道如下。
1 材料与方法
1.1 一般资料 选择2013年1月~2015年5月我院住院MM患者40例,其中男19例,女21例;年龄40~75岁,平均(56.33±3.59)岁;依照DS分期标准包括Ⅰ期10例,Ⅱ期12例,Ⅲ期18例。另选取同期于我院门诊就诊者,通过临床和骨髓穿刺排除血液疾病,其中男20例,女20例;年龄41~77岁,平均(56.18±3.66)岁。纳入标准:①所有患者均签订骨髓穿刺同意书,通过临床和骨髓穿刺、免疫固定电泳等检查确诊;②经医院伦理委员会批准,患者及家属知情同意。排除标准:①肝实质病变或有机磷中毒者;②原发性浆细胞白血病或反应性浆细胞增多症者;③合并慢性呼吸道疾病;④合并其他恶性肿瘤、创伤或感染者;⑤合并其他全身性疾病者。
1.2 免疫组织化学法 所有非肿瘤骨髓组织标本通过10%的中性福尔马林进行固定,通过石蜡包埋后制片,通过免疫组织化学SP三步法进行检测,试剂盒购自北京中杉金桥生物技术有限公司,修复抗原,在室温条件下以3%的H2O2孵育20min,灭活过氧化物酶活性,PBS液冲洗,滴加正常山羊血清工作液,于室温条件下孵育20min,加入一抗,4℃条件下放置12h,再次以PBS液冲洗,滴加二抗,孵育25min,再以PBS液冲洗,加入辣根酶标记链酶卵白素工作液,孵育25min,PBS液冲洗,以DAB显色液显色,最后采用蒸馏水冲洗、复染、脱水、透明、封片。
1.3 染色结果判断 由2名病理科医师采用双盲法评估。在高倍镜下随机选取5个以上的不同高倍镜视野,同时需保证每一个视野能够观察到的细胞数在200个以上,阳性细胞表达为细胞质呈现淡黄色或棕黄色,依照阳性细胞所占的百分比进行评分[6]:阳性细胞≤5%计0分,阳性细胞为5%~10%计1分,11%~50%计2分,51%~75%计3分,>75%计4分,0分为无表达(-),1分为低表达(+),2分为中度表达(++),3分为高表达(+++),4分为极高表达(++++)。
1.4 化疗方案 采用VAD+MelP(VCR 0.5mg d1~d4,THP 10mg d1~d4,DEX 20mg d1~d4,MelP 6mg Bid d1~d4),合并肾功能不全者,可依据肌酐清除率水平调整MelP用量;合并尿毒症患者,不使用MelP;合并骨骼病变患者,化疗前使用两次2、3代骨磷酸盐,骨骼症状明显或孤立病灶加用局部治疗。
1.5 临床病理特征
1.5.1 DS临床分期标准 Ⅰ期:血钙正常,血红蛋白≥100g/L,X线显示骨髓表现正常或仅存在少量孤立性浆细胞,IgA<30g/L,IgG<50g/L,尿本周蛋白<4g/24h;Ⅱ期:介于Ⅰ期和Ⅲ期之间;Ⅲ期:符合以下一项或多项:血红蛋白<85g/L,血钙水平>2.98mmol/L,多处发生溶骨性病变,IgA>50g/L,IgG>70g/L,尿本周蛋白>12g/24h[7]。
1.5.2 ISS分级标准 1级:血清β2微球蛋白含量<3.5mg/L,血清白蛋白含量>35g/L;2级:介于1级和3级之间;3级:血清β2微球蛋白含量>5.5mg/L[8]。
1.5.3 骨病分级 0级:未出现骨质破坏;1级:普通骨质疏松或有1处出现骨质溶骨性破坏;2级:超过1处少于3处出现骨质破坏症状;3级:超过3处出现骨质破坏,或出现病理或压缩性骨折[9]。
1.5.4 生活自理状况 1级:患者存在临床症状,但不影响日常生活;2级:患者日常生活可自理,且每日需卧床休息半天以下;3级:患者日常生活可自理,且每日需卧床休息半天以上;4级:患者卧床不起,生活不能自理[10]。
1.6 统计学方法 采用SPSS 20.0统计学软件,率之间的比较采用卡方检验,生存率分析通过Kaplan-Meier模型,P<0.05表示差异有统计学意义。
2 结果
2.1 PI3K在正常及MM骨髓组织中的表达 MM患者骨髓组织中PI3K阳性表达率高于正常骨髓组织,见表1。
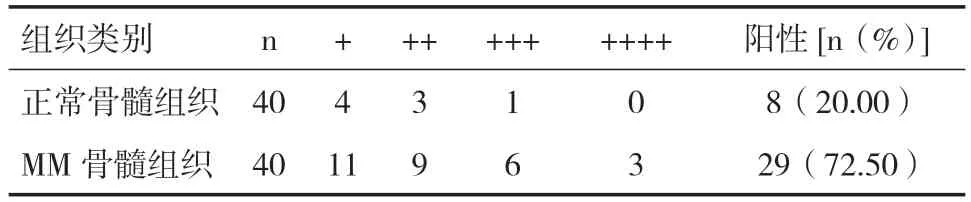
表1 PI3K在正常与MM骨髓组织中的表达情况比较
2.2 PI3K表达和临床病理特征之间的关系 骨质破坏≥3分、日常生活自理能力较差患者PI3K阳性率高于其他患者,DS分期Ⅲ期患者PI3K阳性率高于Ⅰ~Ⅱ期患者,ISS分级3级患者PI3K阳性率高于1~2级患者,差异有统计学意义(P<0.05),见表2。
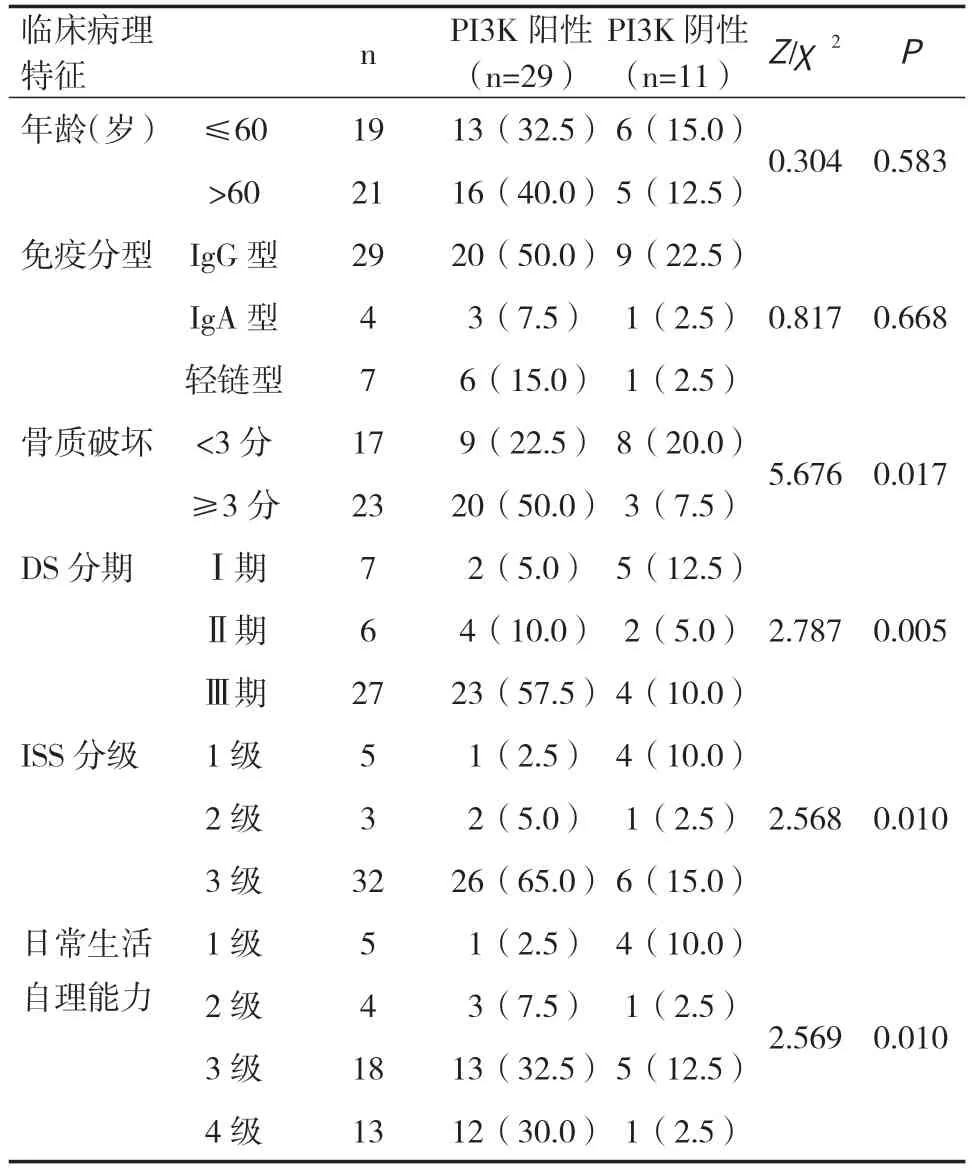
表2 MM骨髓组织中PI3K表达与临床病理特征的关系[n(%)]
2.3 PI3K阳性与阴性表达MM患者化疗后生存时间 PI3K阴性患者3年无进展生存率为72.73%,高于PI3K阳性组48.28%(P<0.05);PI3K阴性患者3年总生存率为81.82%,高于PI3K阳性患者62.07%,(P<0.05)。见图1、2。
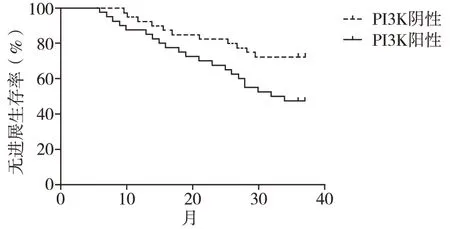
图1 3年无进展生存率
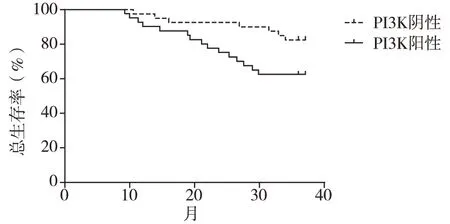
图2 3年总生存率
3 讨论
MM肿瘤细胞起源于浆细胞,其发病和癌基因的激活与抑癌基因的失活及骨髓微环境的改变、多种细胞因子相互作用等因素有密切关系,患者常伴有多发性溶骨性损害、贫血、高钙血症、肾脏损害,患者由于正常的免疫球蛋白的生成受到抑制,易导致各种细菌性感染的发生[11]。
PI3K由一个催化亚基和一个调节亚基构成,细胞受到生长因子刺激后,PI3K活化[12]。PI3K下游的Akt可与PIP3结合,并经磷脂酰肌醇依赖性激酶1,2使第308位上的苏氨酸及473位上的丝氨酸被激活。活化后的PI3K/Akt通路激活哺乳动物雷帕霉素靶蛋白,磷酸化后进一步激活P70S6激酶,使下游核糖体S6激酶活化,促进核糖体蛋白的翻译过程,与此同时哺乳动物雷帕霉素靶蛋白还可将4EBP1磷酸化,使其从elF4E中解离,促进后者对于cyclinD1等周期调节蛋白的翻译过程。PI3K信号通路可调节细胞周期,具有抗凋亡和调节瘤细胞生存的作用,还有利于血管的形成,增强肿瘤的侵袭性,促进肿瘤的转移[13]。
本研究中MM患者骨髓组织PI3K阳性率明显高于正常组织,MM组织中PI3K信号活化,促进瘤细胞增殖与分化过程,反过来又进一步活化更多PI3K信号,使得PI3K浓度进一步升高。本研究对比各种免疫类型骨髓血浆PI3K阳性率差异,其中IgE和IgD类型本研究未纳入有效病例,对比其他几种免疫类型和PI3K阳性率的关系,IgG型、IgA型、轻链型PI3K阳性率均未有明显差异,提示PI3K表达增高可能是各种类型MM患者表现出的一种共同信号,也有可能与本研究所纳入的样本数量过少有关。DS临床分期侧重评估患者总体瘤负荷,涉及多种参数[14]。本研究中Ⅲ期患者PI3K阳性率高于Ⅰ、Ⅱ期患者,表明患者体内PI3K水平和瘤负荷相关。ISS临床分期是近年来提出的MM临床分期指标,虽只涉及血清β2微球蛋白和血清白蛋白含量,但血清β2微球蛋白和体内骨髓瘤细胞总数密切相关,血清白蛋白是负性急性期蛋白,与瘤细胞的生活与增殖具有密切关系,因此ISS临床分期在预测MM患者化疗治疗后的生存情况方面具有重要价值,本研究中ISS临床分期和MM患者PI3K阳性率相关,提示瘤负荷状态,对于负荷越高者,其包括自分泌或旁分泌在内激活的PI3K信号的途径则越强,上述研究显示,PI3K阳性表达率越高者,疾病分期更接近于晚期。
林琳等[15]研究表明骨骼破坏为MM患者最常见的临床症状之一,瘤细胞和骨髓基质细胞相互黏附后激活大量破骨细胞激活因子等,导致破骨细胞和成骨细胞动态平衡遭到破坏,造成溶骨性破坏。MM患者瘤负荷越高,骨质破坏越严重。本研究中PI3K水平与骨髓瘤的分级有关,PI3K的阳性表达率随骨质破坏严重程度增高。同时本研究中患者日常生活自理能力与PI3K阳性表达率存在一定的关系,这也从侧面说明了PI3K的阳性表达和骨髓病变的严重程度相关,Piddock 等[16]研究结果支持本结论。对两组患者随访至化疗治疗后3年,PI3K阳性表达患者3年无进展生存率与总生存率均低于PI3K阴性表达患者,阐明了PI3K在预测MM患者预后方面的价值。
综上所述,PI3K在MM骨髓组织中高表达,与患者临床病理特征具有密切关系,可作为判断MM患者预后的标志物之一。

