樟树胚萌发早期影响因素及植株再生
杨 柳,林立彬,李志辉
(1.韶关市植物保护站,广东 韶关 512001;2.中南林业科技大学,湖南 长沙 410004; 3.韶关国家森林公园管理处,广东 韶关 512023)
樟树Cinnamomum camphora为樟科Lauraceae樟属Cinnamomum植物,又名香樟、臭樟,是优良的行道树和绿化树[1]。樟树木材耐腐防虫,是家具、雕刻的良材[2],樟树的根、茎、叶、花等器官富含芳香油[3],在化妆品中得到广泛应用,樟树还在医药和化工方面有广泛的使用价值。近年来,对于樟树体细胞胚胎发生的研究不多,仅有杜 丽[4],施雪萍[5]、陈甘明[6]对樟树体细胞胚胎发生有过研究,实验证明樟树体胚具有直接和间接发生两种途径,杨柳[7]对直接发生途径有过相关研究,但是对早期幼胚萌发条件、影响因素及间接发生途径没有进行探讨,研究早期影响因素对后期诱导胚性愈伤组织及体胚发生、成熟具有指导意义。针对以上问题,本研究以樟树未成熟合子胚为外植体,研究不同因素对未成熟合子胚萌发的影响,并对湖南省不同种源樟树胚性愈伤组织进行诱导,对体胚发生途径进行补充,旨在完善樟树的体胚发生培养技术,为基因技术提供有力的科学依据。
1 材料与方法
1.1 实验材料
不同因素对樟树胚萌发的影响实验中,选择中南林业科技大学校园内树干饱满、生长健壮、无病虫害、长势一致、年龄相当的樟树植株为供试母体,于7月15 日、8月15 日、9月15 日、10月15 日采集发育正常、大小一致的樟树种子用作实验材料。不同种源樟树愈伤组织诱导的材料则选择于2016年7月采自湖南省长沙、岳阳、娄底、醴陵、郴州、怀化的樟树未成熟种子。
种子采集后放入4 ℃冰箱冷藏,每天进行定期检查,发现种子褐化、霉变要及时筛出,避免感染其他种子。
1.2 实验方法
1.2.1 不同因素对樟树幼胚萌发的影响
1.2.1.1 预处理对樟树胚萌发的影响
种子消毒接种前,做以下处理:一是低温处理,将樟树种子提前放入0 ℃冰箱24 h;二是浸泡处理,将樟树种子在消毒前用无菌水浸泡24 h。另外设置一个对照组,不做任何预处理,采种后统一放入4 ℃冰箱保存。3个处理的樟树种子消毒后接种于培养基MS+1 mg/L 6-BA+0.1 mg/L 2,4-D上,附加水解酪蛋白(CH)700 mg,蔗糖30 g,琼脂粉7.5 g,每个处理30个外植体,3 次重复。
1.2.1.2 不同采种时间对樟树胚萌发的影响
将7月15 日、8月15 日、9月15 日、10月15 日采取的樟树种子在无菌条件下接种于MS 基本培养基,统一添加1.0 mg/L 6-BA,0.1 mg/L 2,4-D,水解酪蛋白(CH)700 mg,蔗糖30 g,琼脂粉7.5 g。该实验每个处理30个外植体,3 次重复。
1.2.1.3 活性炭浓度对樟树胚萌发的影响
在樟树种子启动培养基MS+1 mg/L 6-BA+ 0.1 mg/L 2,4-D中添加活性炭浓度分别为0、50、100、150、200 mg/L,附加水解酪蛋白(CH)700 mg, 蔗糖30 g,琼脂粉7.5 g,每个处理30个外植体,3 次重复。
1.2.1.4 肌醇浓度对樟树胚萌发的影响
该实验中,将7月樟树幼胚接种于添加了不同肌醇浓度和附加物种类和浓度同上的基本培养基上,肌醇设置浓度分别为0、50、100、200 mg/L,每个处理30个外植体,3 次重复。
1.2.1.5 正交组合对樟树胚萌发的影响
该实验以MS 为基本培养基,研究了不同浓度的6-BA、NAA、IBA、链霉素组合对樟树幼胚萌发的影响,采用L9(34)正交试验设计方法,进行4 因素3 水平试验,共9个处理。因素间的交互作用不在考虑之列,各因素随机分布排列。每个处理30个外植体,重复3 次。

表1 6-BA、NAA、IBA 和链霉素正交组合试验设计Table 1 Orthogonal combination of 6-BA,NAA,IBA and Streptomycin
1.2.2 不同种源樟树胚性愈伤组织的诱导与增殖
前期围绕幼胚下胚轴产生的愈伤组织切除褐化部分,转入增殖培养基,MS 为基本培养基,添加0.5 mg/L TDZ、0.5 mg/L 6-BA、设置2,4-D 浓度为0.1、0.2、0.3、0.4、0.5 mg/L,每个种源不少于30 瓶,30 d 后统计胚性愈伤组织诱导率。
1.2.3 不同种源樟树胚性愈伤组织诱导体细胞胚胎发生
胚性愈伤组织在增殖培养基上生长稳定后,挑选色泽饱满、透明紧密的黄白色颗粒状组织转入体细胞胚胎诱导培养基,每个处理附加 0.2 mg/L 2,4-D、2 mg/L 6-BA、30 g 蔗糖、7.5 g 琼脂,设置GA3浓度为0.1、0.5、1.0 mg/L,每个种源至少30 瓶,30 d 后统计体细胞胚胎发生率。成熟体胚转入萌发培养基MS+1.0 mg/L 6-BA+ 0.2 mg/L NAA+0.2 mg/L GA3继续生长,直至小苗展开完整地叶片。
1.2.4 不同种源樟树根的诱导
将继代培养的体胚苗转入诱导生根培养基,30 d 后观察并记录生根率,采用MS 培养基为基本培养基,添加激素为IBA(1 mg/L)、NAA(0、0.1、0.3、0.5 mg/L),水解酪蛋白(CH)700 mg,蔗糖30 g,琼脂粉7.5 g,以上培养基用HCl 或NaOH 标准滴定溶液调节pH 值5.8~6.0,培养基在121 ℃灭菌20 min,培养条件均为光照培养16 h,黑暗培养 8 h,光照强度为1 000 lx,培养温度为(23±2) ℃(如无特殊说明,下同)。
1.3 数据统计与分析
接种后的外植体培养4 周后分别统计各个处理的胚萌发率、平均出芽数,观察褐化率及后续愈伤组织生长情况,记录相应数据。用SPSS 软件进行方差分析和多重比较,最小显著性差异水平P=0.05。
胚萌发率(100%)=(萌发的幼胚数/接种幼胚总数)×100%;
平均出芽数=出芽总数/诱导出芽的外植体总数;
褐化率=( 褐化的外植体总数/ 接种总数)×100%;
胚性愈伤组织诱导率=(胚性愈伤组织数/接种的愈伤组织总数)×100%;
体细胞胚胎发生率=(诱导出体胚数/接种的胚性愈伤组织总数)×100%;
植株生根率=(诱导出根的外植体总数/接种的芽总数)×100%。
2 结果与分析
将幼胚接种于培养基上,可以观察到两种情况。一种是接种一周左右外植体开始有萌动迹象,渐渐在胚芽处直接抽生出芽器官,通常一个子叶胚形成多个芽,伴随着芽器官的发生不久之后便看到有根的生成,继续培养可以观察到环绕子叶胚胚轴有愈伤组织形成,部分愈伤组织具有胚性,后期可诱导体胚发生。若先形成根器官,则无法看到后面有芽的形成,不能形成完整植株,故把根器官发生不计入胚萌发;二是幼胚逐渐长大,从刚开始的小点发育成白色子叶状结构,在白色子叶状周围随后观察到有愈伤组织的形成,愈伤组织继续培养,可以诱导体胚直至萌发出嫩芽。以上两种情况均计入胚萌发的外植体总数。
2.1 不同因素对樟树胚萌发的影响
2.1.1 预处理对樟树胚萌发的影响
低温与浸泡预处理对樟树幼胚萌发的影响见表2,由表2 可知,不同的预处理方式对樟树胚萌发率没有显著差异,能观察到幼胚萌发均在20 瓶以上,本质上没有太大差别,观察到各处理的芽苗均发育正常,叶片大小较均一,大部分颜色较绿,没有出现大批量黄化的现象。但是对种子提前浸泡24 h 处理会较早出现褐化,幼胚边缘少许水渍化,接种后培养基颜色随着时间的推移逐渐加深,到了第五天可观察到较为明显的黄褐色,而低温与对照组在第7 天观察到褐化现象,褐化较轻,经后续芽苗生长观察,低温处理与对照组没有明显区别。这可能是采种后的种子放入4 ℃冰箱保存,而0 ℃低温处理与之相差不大,没有达到樟树种子的临界温度故没有太大差异,而提前浸泡种子没有化学上的本质变化,而在一定程度上破坏了包裹幼胚的果肉,吸收了更多的水分,故较早褐化与水渍化,不利于后续芽的生长和愈伤组织的诱导。综上所述,各预处理对樟树胚萌发没有显著性差异,浸泡处理不利于幼胚后续生长发育。

表2 预处理对樟树胚萌发的影响†Table 2 Effect of pretreatment on germination of Cinnamomum camphora embryo
2.1.2 不同采种时间对樟树胚萌发的影响
采种时间对樟树胚萌发的影响见表3,分析不同采种时间对樟树胚萌发有明显的影响。7月樟树种子幼胚萌发率和平均出芽数高于其余月份,在实验的过程中,观察不到9、10月樟树种子的胚萌发和胚性愈伤组织发生,把9月和10月种子接种到培养基上,种子直接褐化严重,无法观察到胚正常萌发。7月樟树种子可诱导产生愈伤组织,多为白色透明状组织,表面有光泽,经过培养,后期可以成功诱导出体胚直至诱导不定芽长成完整植株,9月与10月愈伤为灰褐色组织,褐化严重,继代过程中易死亡,无法诱导正常芽,此外,相同处理下污染率、褐化率明显高于7月份,虽然有观察到8月种子胚萌发的过程,但是胚萌发率和平均出芽数低于7月,幼胚萌动也比7月晚。综上所述,随着采种时间的推移,胚萌发率和平均出芽数下降,污染率、褐化率增加,7月幼胚对樟树胚萌发诱导效果最好,实验时选择7月的未成熟合子胚最佳。

表3 采种时间对樟树胚萌发的影响Table 3 Effect of seed selection time on germination of Cinnamomum camphora
2.1.3 活性炭浓度对樟树胚萌发的影响
活性炭浓度对樟树幼胚萌发的影响,从表4可以看出,诱导率随着活性炭浓度的变化而变化,低浓度(≤100mg/L)的活性炭对发芽率没有显著差异。当活性炭浓度为150 mg/L 时,樟树种子有最大的胚萌发率88.89%,此时褐化率最低,可观察到胚性愈伤组织表面光泽度明显,呈透明或乳白状,最低诱导率54.44%是当活性炭浓度为 200 mg/L 时,此时褐化数最多,以非胚性愈伤组织居多,另外我们发现,活性炭浓度为100 mg/L时,各指标与对照组没有明显区别,胚萌发率甚至略低于对照组,继续增大活性炭浓度,当活性炭浓度为200 mg/L 时,胚萌发率明显低于对照组,褐化数显著增加。活性炭对胚萌发率的促进作用可以理解为活性炭有吸附乙烯等代谢物质的作用,使各营养物质保持在一种平衡的状态,pH 在合理的范围内,活性炭的抑制作用则是除了吸附代谢物质,也会对激素浓度进行一定程度上的改变,激素浓度过低,无法满足其生长发育的需求。综上所诉,当活性炭浓度为150 mg/L 时樟树幼胚有最大的萌发率,但是还要进一步探讨活性炭与幼胚萌发变化规律,找出最有效控制褐化、提高诱导率的技术措施。
2.1.4 肌醇浓度对樟树胚萌发的影响
肌醇浓度对樟树幼胚萌发早期的影响,见表6。肌醇作为一种有效的有机化合物渗透剂,不仅可以调节渗透压,还可以为植物体提供碳源,分析表中各项数据,随着肌醇浓度的小范围增大,幼胚萌发率逐渐上升,但没有显著性差异,各项处理幼胚萌发率均大于70%。平均出芽数在2~3个之间,无显著差异。虽然两项指标没有达到显著性差异,发生途径也以出芽和愈伤组织发生为主,但附加100 mg/L 肌醇的培养基上观察到胚性愈伤组织生成,胚性愈伤组织的产生在后期可直接诱导体胚发生,为植株再生提供发生基础。

表4 活性炭浓度对樟树种子胚萌发的影响Table 4 Effect of activated carbon concentration on germination of Cinnamomum camphora seeds

表5 ANOVA 单因素分析-诱导率Table 5 ANOVA single factor analysis - Induction rate

图1 樟树种子组织培养过程中的褐化情况Fig.1 Browning in the seed tissue culture of Cinnamomum camphora

表6 肌醇浓度对樟树胚萌发的影响Table 6 Effect of inositol concentration on germination of Cinnamomum camphora
2.1.5 6-BA、NAA、IBA 和链霉素对樟树胚萌发的影响
6-BA、NAA、IBA 和链霉素正交设计试验结果见表7。分析表中数据,樟树幼胚萌发率随着6-BA 浓度的增加而增加,在不含6-BA 的处理上,诱导率普遍偏低,在6-BA 的基础上添加另外激素,诱导率均在50%以上,可见6-BA 是影响胚萌发的主要影响因子。不添加任何激素的情况下,可观察到胚萌发的低频发生,证明樟树未成熟胚生长分化能力较强,是适合诱导后期体胚发生的外植体类型。另外,链霉素的添加可在一定程度上抑制培养基褐化,吸附酚类物质,改善生长条件,最大的胚诱导率是在处理1(0.5 mg/L6-BA+ 0.1 mg/LNAA +0.5 mg/LIBA)中得到的达75%。对表中各试验因素进行主次分析,以幼胚诱导率作为评价指标,其影响的主次顺序为:6-BA >NAA >链霉素>IBA。
对主要影响因子6-BA进行方差分析,见表8~ 10。表8 表明随着6-BA 浓度的增加,均值也呈现显著增加的趋势;从表9 可以看出6-BA 各处理之间诱导率在0.05 水平上达到显著差异(P <0.05);对表10 中的数据进行分析,发现不添加6-BA 与其余两个处理之间存在显著性差异,0.1~0.5 mg/L 之间没有显著差异。综合生长情况可得出,较高浓度的6-BA 表现较好,其诱导率明显优于不添加6-BA 的处理,同时也说明了细胞分裂素6-BA 对胚萌发的重要性,只有生长素与细胞分裂素结合使用,才能有较好的结果。

表7 6-BA、NAA、IBA 和链霉素对樟树幼胚萌发的影响Table 7 Effects of 6-BA,NAA,IBA and streptomycinon germination of Cinnamomum camphora
2.2 不同种源樟树胚性愈伤组织的诱导与增殖
在体胚诱导过程中,围绕幼胚下胚轴常伴有愈伤组织的出现,视觉上与外植体轻微连在一起,不同种源愈伤组织不尽相同,挑选结构致密、略带粘性、生长旺盛的愈伤转入不同激素配比的相应培养基上继代培养,观察胚性愈伤组织生长情况及速度,不同种源樟树胚性愈伤组织诱导率见表11,从表中我们可以看出,各种源诱导率基本分布在30%~70%之间,娄底例外,个别处理效果不理想,诱导率仅仅只有16.67%和26.67%。当培养基只添加细胞分裂素6-BA 时,各种源诱导率偏低,集中分布在30%左右,各种源随着6-BA浓度的变化呈现不同的变化趋势,没有固定的规律可循,在这种情况下,胚性愈伤组织诱导率相对较好的是长沙和岳阳种源。在细胞分裂素6-BA的基础上添加生长素2,4-D 可有效提高愈伤组织向胚性愈伤组织的转换,在两者结合使用的条件下,诱导率大部分都提高到50%以上,相比单独使用6-BA 有更好的诱导效果,其中郴州和长沙达到最高的诱导率66.67%。细胞分裂素6-BA 浓度不变,随着生长素2,4-D 浓度的增加,各种源变化趋势不一,岳阳种源樟树为先减小后增大,其余种源大体上表现为先减小后增大。虽然各种源在不同激素配比下胚性愈伤组织变化规律不完全一致,但我们可以得出细胞分裂素与生长素共同使用可提高诱导效果,细胞处于不断分化状态,需要积累营养物质,单独的细胞分裂素不足以支持细胞增殖,2,4-D 作为体胚诱导过程中不可缺少的生长素,在愈伤组织分化中同样重要。

表8 6-BA 单因素描述Table 8 6-BA single factor description

表9 主因素6-BA ANOVA 分析Table 9 Main factor 6-BA ANOVA analysis

表10 6-BA 组间多重比较†Table 10 Multiple comparisons between groups 6-BA
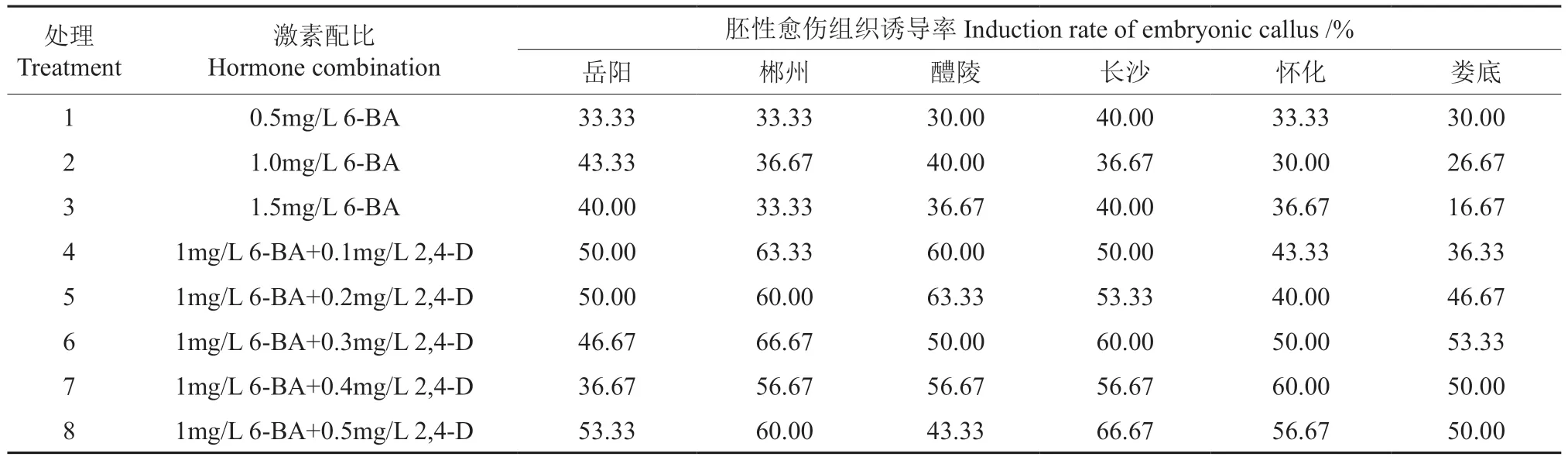
表11 激素配比对不同种源樟树胚性愈伤组织诱导的影响 Table 11 Effect of hormone ratio on callus induction in Cinnamomum camphora embryo of different provenance
观察不同种源樟树愈伤组织生长情况,从表12中可以看出,长沙和岳阳愈伤组织增殖较快,产生的胚性愈伤组织较多,大多为黄白色、质地较松散的愈伤组织,生长旺盛且前期不易褐化,后期能成功诱导体细胞胚胎发生;其次生长状况良好的是郴州与怀化种源的樟树,黄色结构较紧密,但愈伤组织表面略微褐化,生长速度较慢,增殖效果不是太明显;相对较差的是醴陵和娄底种源,在这两种种源的培养基上,均发现了个别细胞较大的愈伤组织,前期透明化,后期逐渐褐化,少数能进行下一步培养,褐化的愈伤组织生长速度快,仅仅几天可扩大几倍体积,部分褐化的愈伤组织经过后期培养有体细胞胚胎产生,着生于褐化的愈伤底部或顶部。
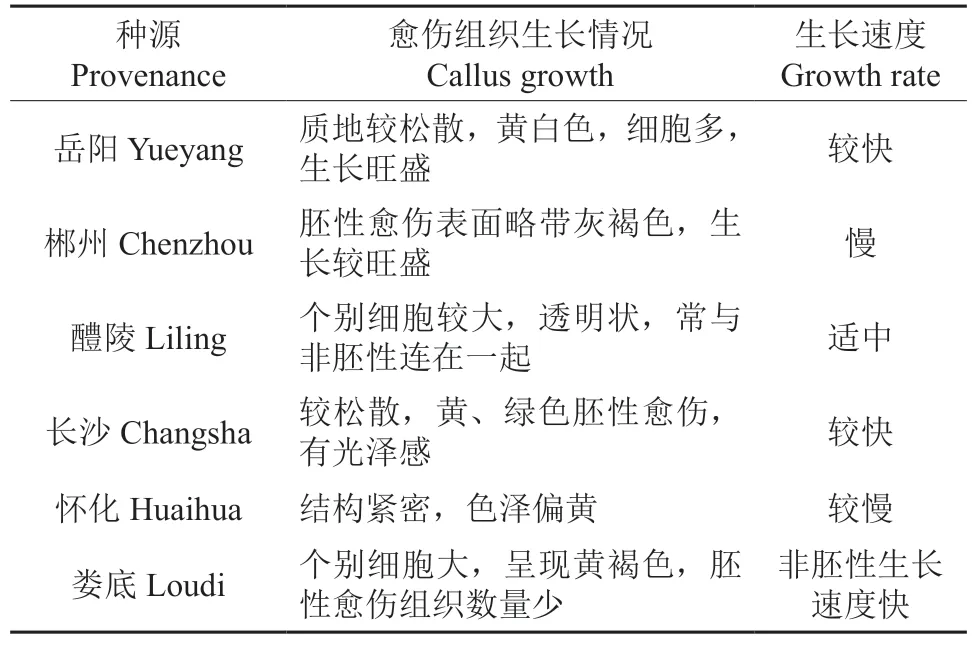
表12 不同种源樟树愈伤组织的生长比较Table 12 Comparison of the growthcallus of Cinnamomum camphora in different provenances

图2 不同种源愈伤组织形态对比 Fig.2 Comparison of callus morphology of different provenances
2.3 不同种源樟树胚性愈伤组织诱导体细胞胚胎发生
将诱导的胚性愈伤组织转接到含有不同激素配比的培养基上诱导体细胞胚胎发生,培养20~30 d, 肉眼可见愈伤组织表面有乳白色体胚发生,随着体胚发生进程,愈伤组织逐渐褐化,胚性愈伤组织生长速度减缓。不同种源体胚诱导率见表4~5,6-BA 浓度一定,附加相同浓度的生长素2,4-D 和NAA,各种源体胚诱导率在两种处理下没有太大差别,且诱导率较低,诱导率相对较好的是长沙和娄底种源樟树。一定量的6-BA 和KT,添加不同浓度的NAA,由表中数据可知,随着NAA 浓度的增加,岳阳、醴陵体胚诱导率逐渐减小,郴州、长沙、怀化、娄底呈现先增加后减小趋势,总体看来,0.1 mg/L 和0.5 mg/L 的NAA 由较高的诱导率,诱导效果好,均与处理1 和处理2 相比诱导率有较大的提升。体胚诱导率较差的郴州种源在后期培养中愈伤组织易褐化,容易在褐化的愈伤组织上长出一定数量的体胚,胚性愈伤组织难保存,导致体胚诱导率低。表现较好的为长沙种源,愈伤组织结构较松散,黄白色胚性愈伤组织分布较为广泛,后期体胚容易萌发嫩芽。
将诱导出的体胚转入MS+1 mg/L 6-BA+ 0.2 mg/L NAA+0.2 mg/L GA3培养基中继续生长,一个月后体胚逐渐变得白、绿相间,继续培养,绿色芽点萌发成小苗,在相同培养基上经过一段时间的壮苗,可直接萌发生根,但是有的根脆弱易断,必须转入生根培养基诱导生根,少数可长出茁壮的根且后期不需要另外诱导生根。

表13 激素配比对胚性愈伤组织诱导体胚的影响 Table 13 Effects of hormone composition on somatic embryo induction in embryonic callus

图3 樟树愈伤组织诱导植株再生过程Fig.3 Callus induction of plant regeneration in Cinnamomum camphora
2.4 不同种源樟树在不同激素组合上根的诱导
从表14 中可以看出,激素浓度对不同种源樟树生根率有影响,各处理生根率基本都在50%以上,由此看来,樟树是较易诱导生根类型。不添加任何激素,樟树也能生根,生根率在40%~60%左右;单独添加1 mg/L 的IBA,生根率并没有在空白对照组上明显提高,甚至个别种源略低于空白对照组;在IBA 上附加0.1 mg/L 的IAA 和NAA,生根率均有明显提高,提高到70%~90%之间,总体看来,IBA 与NAA 的组合略好于IBA与IAA 组合。由表中可知,长沙种源樟树有最高的生根率,达89.25%,其次为岳阳种源88.36%。各种源生根率不同,根长、数量均不同,平均长根数在2~5 条之间,常常以绕圈的形式盘踞培养基底部。醴陵和郴州种源樟树最佳生根激素配比为1 mg/L IBA+0.1 mg/L IAA,其余种源生根最适激素均为1 mg/L IBA+0.1 mg/L NAA。

表14 激素对不同种源樟树生根的影响Table 14 The effect of hormonefor root fromdifferent provenances of Cinnamomum camphora
3 结论与讨论
3.1 结 论
低温和浸泡预处理种子对樟树幼胚萌发没有显著性差异,浸泡处理不利于幼胚后续生长发育;不同的采种时间对胚萌发率和平均出芽数影响很大,随着采种时间的推迟,胚萌发率显著降低,甚至在9月份和10月份没有观察到出芽发生,7月幼胚对樟树萌发诱导效果最好,实验时选择7月的未成熟合子胚最佳;附加150 mg/L 的活性炭,培养基褐化率较低;肌醇浓度对樟树幼胚萌发早期诱导无显著性影响;对6-BA、NAA、IBA 和链霉素进行正交设计试验,其影响的主次顺序为:6-BA >NAA >链霉素>IBA。
综合各种源胚性愈伤组织诱导率和生长情况,生长较好的是长沙和岳阳种源樟树,生长郴州与怀化种源的樟树次之,相对较差的是醴陵和娄底种源。岳阳、郴州、醴陵、长沙、怀化、娄底胚性愈伤组织最大诱导率分别为53.55%、66.67%、63.33%、66.67%、60%、53.33%;岳阳、郴州、醴陵、长沙、怀化、娄底愈伤组织诱导体胚发生最大诱导率分别为56.41%、42.31%、48.96%、64.71%、63.25%、56.31%;醴陵和郴州种源樟树最佳生根激素配比为1 mg/L IBA+0.1 mg/L IAA,其余种源生根最适激素均为1 mg/L IBA+ 0.1 mg/L NAA。
3.2 讨 论
3.2.1 采种时间与胚萌发的关系
影响体胚发生的因子很多,如外植体采种时间、培养基、母株基因型和激素种类及用量等,在对各种因子进行研究后发现,外植体采种时间直接影响了外植体的发育程度,对整个组织培养以及体胚发生具有非常重要的作用,针对此项研究已经在不同的树种中有所体现。刘艳芝[8]、王萍[9]等发现大豆Glycine max的不同生长发育阶段、取材时间对体细胞胚胎诱导有显著地影响;习洋[10]等在研究刺槐Robinia pseudoacacia体细胞胚胎发生时,得出开花后55 d 的刺槐是诱导体细胞胚和胚性愈伤组织的最佳时候;于晓芳[11]利用马尾松Pinus massoniana不同采种时间的种子诱导其愈伤组织的发生,结果发现胚性愈伤组织诱导的最佳采种时间为7月25 日。在樟树体细胞胚诱导方面,对于胚龄对于体胚发生早期的影响,仅有陈甘明[6]有此研究,他的实验结果表明开花后不同时间采种的樟树幼胚对体细胞胚胎发生有显著差异,得出了开花60 d 的樟树合子胚体胚诱导率明显高于开花后70、80 d。由此可见,掌握好外植体取材时间非常重要,外植体过于幼嫩或者过于成熟都难以诱导得到理想的结果。本试验研究结果与之前的类似,结果显示采种时间为7月15 日胚萌发率最高,为81.11%,而到9月份采种的种子幼胚萌发率为0%,基本观察不到胚性愈伤组织的发生,由此得出樟树幼胚最佳采种时间为7月。本次试验为樟树幼胚早期萌发和后期体胚发生采种时间做了相关研究,此前并没有外植体采种月份对于樟树胚萌发的相关报道,但试验存在许多不足的地方,取材间隔时间太长,未对7月进行几天一采种,没有观察到种子外部变化,一个月的时间对于幼嫩种子来说发育程度不一致,在以后实验中尽量进行更加细致的处理,不断完善樟树离体培养发生的技术,为后人提供一个可借鉴的试验基础。
3.2.2 胚萌发过程中的褐化现象
褐化是组织培养过程中的常见现象,其褐化程度与外植体状态、取材部位、培养方式、生理年龄、激素浓度等多重因素有关,进行其组培过程中优化研究实际上就是为了控制褐化率,提高体胚发生出芽率及增殖系数,尤其在培养的前期,褐化直接会影响种子发芽、愈伤组织的形成。针对樟树种子在组织培养过程中褐化、发芽率低等问题,本研究也从种子预处理、在培养基中添加一定量的激素、活性炭等几个方面开展了实验,结果表明虽然樟树种子细胞里的酚类物质易被氧化为棕褐色的醌类物质,但是幼嫩的外植体氧化的程度有限,即使不添加活性炭,褐化程度也没有那么严重,通过不断继代,外植体在培养基中仍然可以正常生长发育,这也与7月未成熟种子诱导胚萌发更佳的实验结果相符合。燕丽萍[12]等曾对香樟种子开展过消毒实验,处理为剥取种子蜡质层及种皮,研究表明较厚蜡质层不是抑制香樟种子发芽的原因,这与本实验研究结果类似,带果肉种子仍有较高出芽率;甘艳[13]等探讨了香樟继代及生根的最适活性炭浓度,结果表明1.8 g/L 的活性炭对香樟继代培养过程中控制褐化效果最好;蒋建林[14]等研究发现活性炭为1.5 g/L 时外植体褐化程度最低。本实验的外植体为未成熟种子,所以活性炭用量规则不同,但是同样可以证明活性炭在一定程度上能有效控制培养基褐化;有研究表明水培预处理时间越长能够降低外植体褐化率[15],这与本文的浸泡处理相类似,但是本研究并没有得到理想的结果,褐化率反而略高于其余处理,这可能是因为一定程度上外植体为未成熟种子,不能归类于“水培法”,且樟树新鲜种子为浆果,含水量高,长时间浸泡果肉易腐烂。在樟树种子萌发后,经过在同种培养基上的继代培养、芽分化,培养基MS+1 mg/L IBA+0.3 mg/L NAA 的生根诱导,能发育为完整植株。本实验对樟树种子胚萌发过程中褐化问题进行研究,并在前人的基础上进行优化,旨在为高频率诱导樟树组培苗提供依据,为樟树规范化栽培提供技术参考,以获得更高的经济和生态效益,这也在一定程度上填补了樟树未成熟种子萌发过程中控制褐化方面的研究空缺。
3.2.3 肌醇的渗透调节作用
肌醇是一种水溶性维生素,有促进植物生长发育、促进细胞新陈代谢、提供碳源、调节渗透压,从而影响植物体细胞胚胎发育过程等作用。在许多研究中,肌醇对愈伤组织及体细胞胚胎发生都有促进作用,郭家雁[16]等研究发现缺肌醇的饥饿处理可以影响后期体细胞的形成,饥饿处理的体细胞数量与时间的增加成反比,缺肌醇时间越长,形成的体细胞数量越少;在禾本科植物芦苇中,吴国良[17]等发现肌醇对愈伤组织的形成是必须的,尤其对愈伤组织的良好生长有着不可或缺的作用;在针叶树中,宋跃[18]等得出肌醇浓度为10 g/L,体胚发生量较好,与预测值一致;但在落叶灌木刺五加研究中,李香竹[19]认为在肌醇缺失的培养基中,培养物生长状态更好,同步率更高。可见,肌醇对于愈伤组织及诱导体细胞胚胎胚发生是个非常复杂的问题,不可一概而论,既有研究表明有促进作用,也有实验证明有抑制作用,这要视不同树种、不同外植体、不同添加物、外植体不同生长状态等而异,在本实验中,少量肌醇(≤100 mg/L) 对幼胚萌发有少许促进作用,但是促进效果不明显,各实验处理没有显著性差别,这可能是培养基中添加的蔗糖抵消掉了一部分培养物对于碳源的需求,渗透压趋于平衡,故没有达到显著性差异。对于其中的机理,以后还需设置更多的实验加以验证。
4 展 望
胚性愈伤组织诱导率不高、体胚难以成熟发芽、褐化问题没有完全解决等都在一定程度上制约着樟树的进一步发展,可对激素种类及用量再做细致的研究,可设置更多的浓度梯度来得出更加准确的结论;樟树体细胞胚胎发生还处于初级阶段,今后应在此基础上开展关于樟树生理生化以及细胞学观察等机理研究,揭示体细胞胚胎发生的起源方式、发生方式、细胞学形态、特点等,完善胚胎发育的全过程,为体胚的发生机理提供有力的理论基础。

