调节性T细胞在肺癌中的研究进展
刘海洋 孔英君 李世敏 于悦 李萌 关丽娜
到2018年,估计有1810万新癌症病例和960万癌症患者死亡。其中肺癌是最常见的癌症(占总病例的11.6%),也是癌症死亡的主要原因(占癌症死亡总数的18.4%)[1]。随着肺癌发生率及死亡率的急剧上升,肺癌也急需新的治疗策略,而免疫治疗是一个很有前景的治疗方法。据报道,已经发现多种癌症患者的外周血和局部肿瘤组织中调节性T细胞(Tregs)升高,其中包括乳腺癌,胰腺癌,胃癌和肝癌[2-3]等。Treg在肿瘤的发生、生长、侵袭、转移中发挥重要作用。目前正在临床上测试的几种靶向 Treg细胞的癌症免疫疗法,有望为癌症患者带来希望,其中包括Treg细胞的耗竭,免疫检查点阻断也可归因于Treg细胞的耗尽。本文就Treg在肺癌的研究进展做一综述。
Treg概述
一、Treg的发现
Treg于1995年首次由Sakaguchi等提出,叉头翼状螺旋转录因子 (Forkhead Box P3, Foxp3)被认为是Treg最特异的标记物和主要的调节转录因子,因为 Foxp3基因突变可诱导Treg缺陷,导致人和小鼠的严重自身免疫缺陷和过敏,因此目前将FOXP3作为区分Treg与普通T细胞的特异性标志。Treg中FOXP3表达的诱导受环氧合酶-2(COX-2)/前列腺素E2(PGE2)信号传导的控制;T细胞抗原受体(TCR)与共刺激分子CD28之间的高亲和力相互作用可以形成CD+25Treg细胞前体,这种相互作用还通过NF-κB-c-Rel转录因子负责FOXP3的染色质重塑。信号转导和转录激活因子5(STAT5)转录因子是 Treg细胞前体向Foxp3+Treg细胞转化的必要条件。
二、Treg的分类
三、Treg的免疫抑制功能
Treg与肺癌的关系
一、Treg与肺癌发生和发展的关系
二、Treg 与肺癌侵袭和转移的关系
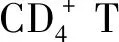
针对Treg的治疗:已经发现抗CD25单克隆抗体可以通过消除Treg细胞和诱导肿瘤特异性效应T细胞来根除小鼠肿瘤模型中的肿瘤细胞。目前,抗CD25单克隆抗体或IL-2融合毒素(Denileukin diftitox,Ontak)[17],IL-2R激动剂(NKTR-214)[18-19],抗CCR4单克隆抗体[20],抗PD-1或抗PD-L1单克隆抗体并且针对Treg细胞的靶向GITR[21-24]或OX40[25-28]的免疫疗法已经进入临床试验的不同阶段;其中一些已经显示出有希望的临床结果。AMG 228是GITR的IgG1单克隆抗体,最近在一项首次人类临床试验中,对30例难治性头颈部鳞状细胞癌,尿路上皮癌,黑色素瘤的患者进行了研究。所有患者均未发现总缓解率(OR),也未发现剂量限制毒性,高达90%(27/30)的患者经历了电解质失衡,贫血,发热等不良反应[24]。其他类似的药物,包括MEDI 1873、MK-4166、INCAGN01876和GWN 323也在多个实体肿瘤和血液恶性肿瘤中研究(NCT 02583165,NCT 02132754,NCT 02697591,NCT 03126110, NCT 02740270)。PF-04518600(PF-8600)是OX40的IgG2人源化激动性单克隆抗体,目前正在进行首次人体试验(NCT 02315066)。选定肿瘤患者的初步结果包括黑色素瘤和非小细胞肺癌在内的肿瘤没有剂量限制毒性,9例中有4例显示SD(疾病稳定期)[26],其他类似药物,包括MEDI 6383、MEDI 0562、MEDI 6469、INCAG 01949和GSK 3174998是其他Ⅰ期临床试验的一部分,尚未获得初步结果(NCT02221960, NCT02528357, NCT02923349, NCT02705482)。抗CTLA-4单克隆抗体(Ipilimumab)已获FDA批准用于治疗恶性黑色素瘤,抗PD-1抗体(Pembro lizumab)被批准用于晚期或不可切除的黑色素瘤患者[29]。 趋化因子受体CCR 8由Treg细胞在间充质和上皮来源的多种癌症中表达,包括黑素瘤,肺癌和结肠直肠癌以及血管肉瘤,靶向Treg细胞和/或抑制性分子也可能使肺癌患者受益[30]。有研究证明,S-腺苷甲硫氨酸(SAM)降低了FOXP3和IL-10水平,但增加了IFNG水平, SAM可以赋予Treg细胞类似Th1的特性,并且它可以是免疫调节候选药物[4]。总之,目前的研究证明肺癌患者外周血中Treg细胞的数量增加,这可能为肺癌的肿瘤免疫治疗提供新的靶点。
总 结
Treg细胞在肺癌中的重要作用现已被广泛接受,Treg细胞及相关细胞因子的靶向治疗正在积极研究中,但是其中也存在一些需要考虑的问题。一个是如何规避可能伴随Treg细胞耗竭的有害自身免疫。还需要考虑Treg细胞和活化的效应T细胞有相同的表型; 这意味着对这些分子特异的细胞耗尽Treg也可以消耗肿瘤反应性激活的效应T细胞,从而减少抑制肿瘤免疫,这些都需要我们进一步去研究。

