锰掺杂硫化锌量子点磷光探针对蜂蜜中四环素类抗生素残留的高灵敏检测
刘振平,姜 容,庞钶靖
(重庆安全技术职业学院,重庆 404020)
1 引 言
四环素类抗生素(Tetracyclines,TCs)对革兰氏阳性和革兰氏阴性菌、支原体、衣原体、立克次体和原虫具有广谱、高效的抗菌活性[1-3]。四环素类抗生素已广泛应用于动物疾病的预防和治疗,同时也有被用作生长促进剂的报道[4]。随着集约养殖业的发展,细菌病害的频繁爆发给人类造成了巨大的经济损失,TCs可有效控制这些病害[1]。但是,TCs会对人体产生肝损伤、牙齿变黄和肠道菌群紊乱等副作用,日常的摄入还会增加微生物的耐药性[5]。另外,在低浓度时,TCs可能会引起敏感个体的过敏反应[6]。因此,建立动物食品中TCs残留的检测方法对于保障食品安全具有重要意义。
近年来,研究人员开发了很多TCs及其类似物残留的检测方法,比如利用紫外高效液相色谱法、二极管阵列、荧光法、质谱分析法等对动物的肝、肾、脂肪、蛋、血浆和鱼、虾等进行TCs残留定量分析[7-16]。这些方法虽然灵敏但存在成本高、操作复杂、检测时间长、所用试剂有毒等问题,限制了实际应用。以荧光信号为基础的荧光检测方法已被证明是快速检测目标的有效和可行的方法[17-20]。基于量子点(Quantum dots,QDs)的荧光或室温磷光信号用于探针研究引起了广泛关注[21]。与传统有机染料相比,量子点具有激发光谱宽、连续、发光效率高、光化学稳定性高、光谱窄对称、颜色可调等优点[22],因此,也被广泛应用于微生物、生物大分子、无机分子和金属离子的定量检测[23-27]。另外,由于寿命和发射波长较长,量子点的磷光特性在一定程度上优于荧光,可避免目标物自荧光发射和荧光散射光的干扰[28]。
內滤效应(Inner-filter effect,IFE)是目标物的吸收光谱与荧光或磷光物质的激发或发射光谱重叠时,当有目标物存在的情况下,激发或发射光被部分吸收而导致荧光或磷光猝灭的现象[29]。本研究利用TCs对锰掺杂硫化锌量子点(Mn∶ZnS QDs)室温磷光产生的內滤效应,以强力霉素(Doxycycline,DTC)为代表,建立了简便、高效、低成本探针体系,实现了对蜂蜜中TCs残留的定量检测。
2 材料与方法
2.1 试剂
强力霉素,重庆葆光生物技术有限公司;Zn-SO4、NaOH、C2H5OH、MnCl2、Na2S·9H2O,成都市科龙化工试剂厂;L-半胱氨酸,上海阿拉丁生化科技股份有限公司;DTC阴性蜂蜜样品,重庆蜂谷美地生态养蜂有限公司。
2.2 仪器与设备
TU-1901紫外可见分光光度计,北京普析通用仪器有限责任公司;LS-55发光分光光度计,美国Perkin Elmer公司;KQ-700DB超声设备,昆山市超声仪器有限公司;pH-S20K pH计,瑞士Mettler Toledo公司;Tecnai F20透射电子显微镜,美国FEI公司;FLS920荧光寿命光谱仪,英国Edinburgh公司(Edinburgh analytical instrument FLS920 fluorescence spectrometer);Bruker vetex70傅里叶红外光谱仪,德国 Bruker公司;Zeta Sizer Nano ZS90粒径及Zeta电位分析仪,英国Malvern公司;超纯水系统,重庆摩尔水处理设备有限公司。
2.3 试验方法
2.3.1 原理
基于內滤效应的Mn∶ZnS QDs磷光探针对DTC的高灵敏检测原理如图1所示。L-半胱氨酸修饰的Mn∶ZnS QDs在289 nm波长的激发光作用下,在583 nm处发射磷光,目标物DTC的紫外吸收光谱与Mn∶ZnS QDs的磷光激发光谱存在较大程度重叠,因此,当Mn∶ZnS QDs体系中存在DTC时,部分激发光被DTC吸收,导致Mn∶ZnS QDs磷光发射强度降低,进而建立DTC浓度与磷光信号的线性关系,实现对DTC的快速定量检测。
2.3.2 Mn∶ZnS QDs的合成
为增加Mn∶ZnS QDs的水溶性,以L-半胱氨酸作为稳定剂,合成方法在参考文献[30]的基础上进行了部分优化:50 mL 0.03 mol·L-1-半胱氨酸与5 mL 0.1 mol·L-1ZnSO4混合于三口烧瓶中,用2 mol·L-1NaOH溶液将混合溶液pH调整为11,通氮气室温搅拌1 h后,隔绝空气注射1.4 mL 0.01 mol·L-1MnCl2继续搅拌30 min,5 mL 0.1 mol·L-1Na2S 快速注入溶液中继续搅拌30 min后,放入50℃水浴中在空气中陈化3.5 h。用等体积的无水乙醇离心分离(10 000 r/min,20 min),乙醇洗涤两次后沉淀物真空干燥即得L-半胱氨酸作为稳定剂的Mn∶ZnS QDs粉末,备用。
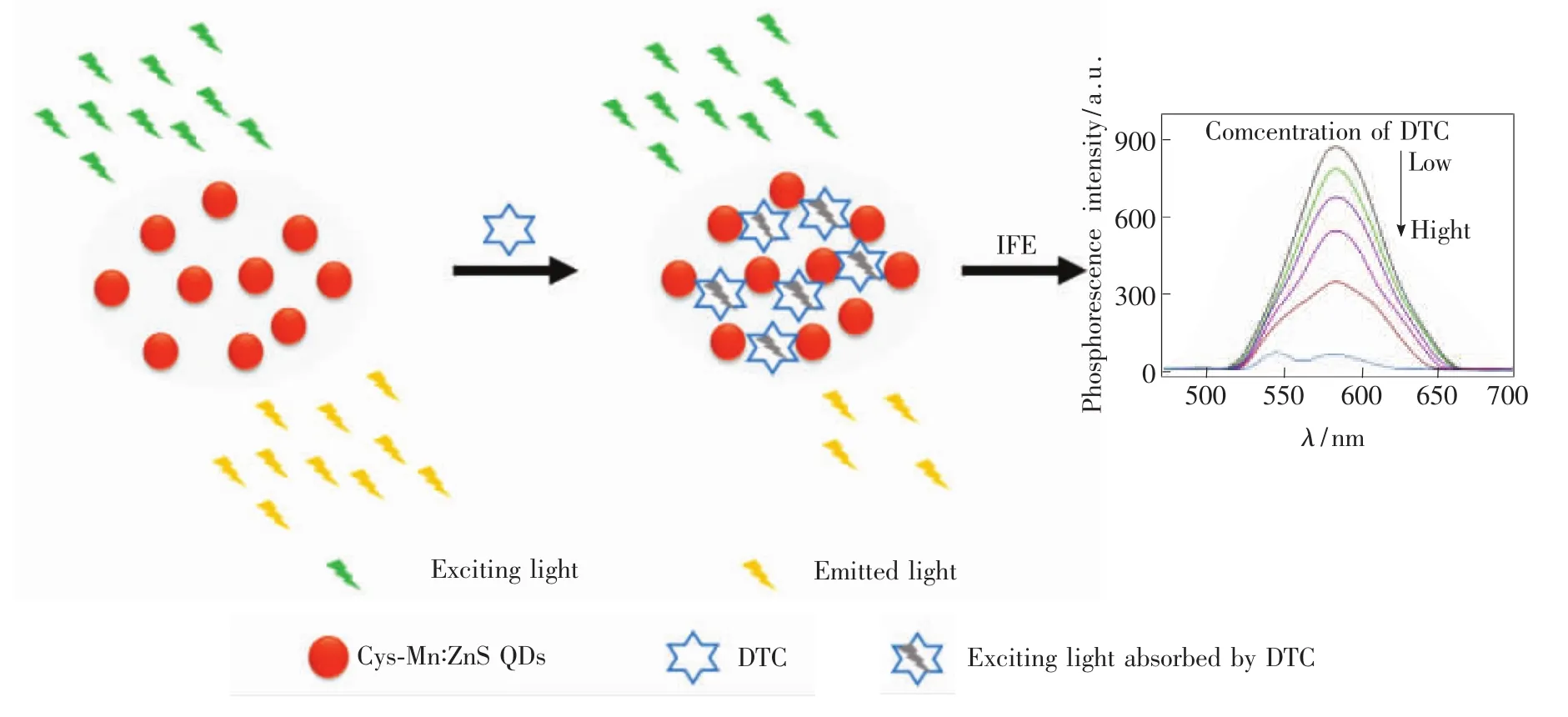
图1 基于內滤效应的Mn∶ZnS QDs磷光探针检测强力霉素原理示意图Fig.1 Schematic diagram of DTC detected principle for Mn∶ZnS QDs phosphorescence probe based on IFE
2.3.3 试验条件优化
Mn∶ZnS QDs浓度的选择:根据 LS-55分光光度计的量程和Mn∶ZnS QDs磷光强度,经过反复实验确定最终体系中Mn∶ZnS QDs浓度为0.1 mg·mL-1。
探针体系 pH的确定:根据 pH对 Mn∶ZnS QDs磷光强度的影响,选择磷光最强时的pH作为体系最终pH。
2.3.4 DTC检测
精确称取一定量的Mn∶ZnS QDs粉末超声分散在pH=9的PBS中,配制成0.3 mg·mL-1Mn∶ZnS QDs溶液,取1 mL上述溶液,加入不同浓度的DTC溶液后用pH=9的PBS稀释至3.0 mL,分别配制成含有 DTC 0.05,0.25,1,2.5,5,10,25,50,100,150 μmol·L-1的标准溶液。将 L-55型分光光度计设置为磷光模式,在289 nm激发波长下测量583 nm处的磷光强度。
2.3.5 选择性试验
按照2.3.4的方法分别测定最终浓度为25 μmol·L-1的四环素、链霉素、卡那霉素、克林霉素和呋喃西林溶液,重复3次,结果与空白对比。
2.3.6 实际样品处理
本研究以蜂蜜为检测对象来测试基于Mn∶ZnS QDs磷光探针对实际样品检测的实用性。DTC与较多金属离子如Cu2+、Al3+、Mg2+等有较强的螯合作用,为避免金属离子的干扰,本研究参考已报道的检测蜂蜜中四环素的样品前处理方法对样品进行处理[31-32]。具体步骤为:5 g蜂蜜样品加入一定量的DTC标准溶液后与20 mL McIL-vaine-Na2EDTA缓冲溶液(M-E,柠檬酸12.93 g,37.33 g Na2EDTA,22.38 g Na2HPO4·12H2O 配成1 L溶液,pH=4.0)混合,加入5 mL 5%的三氯乙酸,旋涡混合5 min,超声5 min,4℃ 下4 000 r/min离心20 min,取上清液用pH=4的NaOH调节pH=9,避光4℃储存,使用前用5倍10 mmol·L-1Tris-HCl(pH=9)稀释,配制成含DTC最终浓度分别为 0.5,5,20,60,120 μmol·L-1的蜂蜜样品。
2.4 数据分析
利用Microsoft Office Excel 2010对实验所得数据进行基本处理,采用OriginPro 8.5作图和线性分析。
3 结果与讨论
3.1 Mn∶ZnS QDs的表征
分别通过透射电镜、傅立叶变换红外光谱和磷光光谱对合成的以L-半胱氨酸为稳定剂的Mn∶ZnS QDs进行表征。如图2所示为Mn∶ZnS QDs的透射电镜图像,经过计算其平均粒径为3.8 nm,与文献报道相符[33]。在L-半胱氨酸修饰的Mn∶ZnS QDs红外光谱图(图3)中可以看出,3 468 cm-1处为羧基中羟基的伸缩振动峰,3 331 cm-1和3 269 cm-1处是氨基的特征吸收峰,1 602 cm-1处出现的吸收峰为N―C伸缩振动峰,1 128 cm-1处的强吸收峰由羧基中的羰基产生,但是2 600 cm-1处的巯基振动峰消失了,这是由于巯基在内部与量子点结合的缘故[34]。上述结果表明,L-半胱氨酸已键合在Mn∶ZnS QDs表面。从 Mn∶ZnS QDs的磷光光谱图(图4)中可以看出,在289 nm的激发光作用下,Mn∶ZnS QDs在583 nm处发出较强的磷光。

图2 Mn∶ZnS QDs透射电镜图像,嵌图为粒径分布图。Fig.2 TEM image of Mn∶ZnS QDs,the illustration is a particle size distribution.
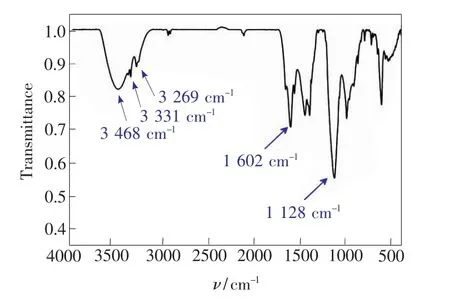
图3 L-半胱氨酸修饰的Mn∶ZnS QDs红外光谱Fig.3 FT-IR spectra of Mn∶ZnS QDs modificated by L-cysteine

图4 L-半胱氨酸修饰的Mn∶ZnS QDs磷光光谱Fig.4 Excitation and emission phosphorescence spectra of Mn∶ZnS QDs
3.2 磷光猝灭机理分析

图5 不同浓度DTC紫外吸收光谱Fig.5 Ultraviolet absorption spectra of different concentrations of DTC

图6 Mn∶ZnS QDs磷光激发光谱和DTC紫外吸收光谱Fig.6 Excitation spectra of Mn∶ZnS QDs and DTC ultraviolet absorption spectra
如图 5 所示,浓度分别为 8,12,25,50,75 μmol·L-1DTC的紫外吸收光谱,在289 nm处的吸光度随浓度的增大而增强。从图6可以看出,DTC的紫外吸收光谱和Mn∶ZnS QDs磷光激发光谱图存在较大程度的重叠,同时根据朗伯比尔定律计算得到DTC在最大紫外吸收波长处的吸光系数为1.35×104。向Mn∶ZnS QDs体系溶液中加入一定浓度的DTC时,Mn∶ZnS QDs的磷光信号会出现一定程度的猝灭,且随着DTC浓度的增大磷光信号猝灭程度也随之增大(图7)。一般地,磷光寿命可以代表物质的激发态信息,因此确定磷光寿命对于研究能量转移或电子转移引起的磷光猝灭具有重要意义[33]。如图8所示,对在最大激发波长下测试的磷光寿命曲线进行拟合后得到Mn∶ZnS QDs中加入DTC前后的磷光寿命分别是2.399 ms和2.062 ms,未发生明显变化,表明DTC对量子点的猝灭效应不是基于Mn∶ZnS QDs和DTC之间的能量转移。如图9所示,左纵轴为25 μm DTC的紫外吸收光谱,右纵轴各点表示在对应波长的光作为激发光时 DTC(25 μmol·L-1)对Mn∶ZnS QDs磷光的猝灭程度,即P0-P(P0为猝灭前的磷光强度,P为体系存在DTC时的磷光强度),猝灭效应随激发波长的变化而变化,在 DTC的最大紫外吸收波长处猝灭效果最强。另外,本研究还对Mn∶ZnS QDs、DTC及其混合物的Zeta电位进行了测量,分别为-30.7,-28.3,-29.1 mV,说明 Mn∶ZnS QDs和 DTC 均带负电不存在相互吸引的静电作用。以上结果表明,DTC对Mn∶ZnS QDs磷光的猝灭机理是內滤效应。

图7 Mn∶ZnS QDs磷光信号强度随DTC浓度增大而降低Fig.7 Signal strength of Mn∶ZnS QDs decreases with the increase of the DTC concentration

图8 Mn∶ZnS QDs和Mn∶ZnS QDs+DTC磷光寿命曲线Fig.8 Phosphorescence lifetime curve of Mn∶ZnS QDs solution and Mn∶ZnS QDs+DTC solution
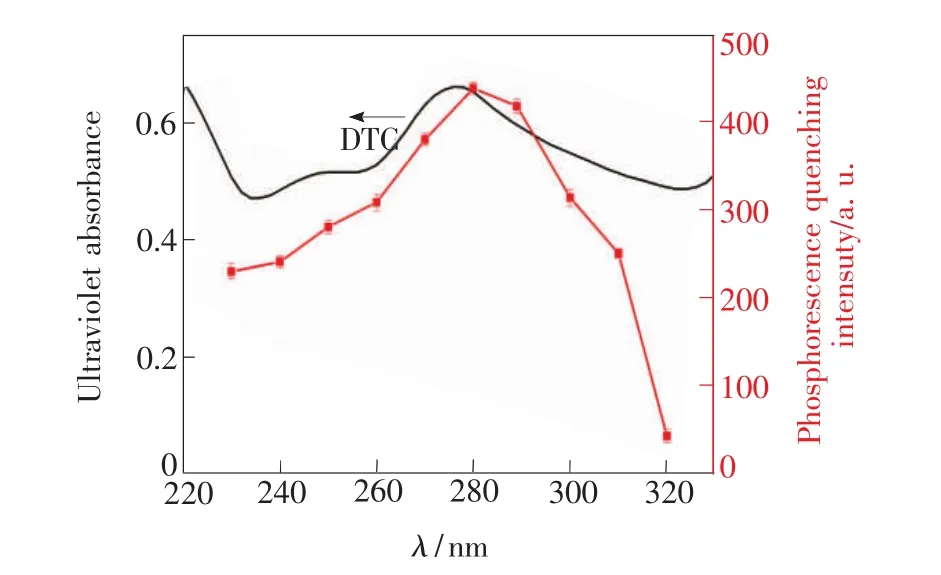
图9 Mn∶ZnS QDs(25 μmol·L-1DTC)磷光猝灭程度与DTC紫外吸收光谱的关系Fig.9 Comparison of absorbance of DTC and the excitation wavelength-dependent phosphorescence quenching of Mn∶ZnS QDs in the presence of 25 μmol·L-1DTC
3.3 探针体系pH优化结果
通过实验发现,Mn∶ZnS QDs的磷光信号受pH影响较大,如图10所示,Mn∶ZnS QDs在酸性条件下磷光强度低的原因可能与量子点和稳定剂的解离有关;随着pH逐渐增大稳定剂与量子点的共价键作用逐渐增强,表现为磷光强度不断增大,且在pH=9~11范围内具有较强磷光信号且相对稳定。同时测试了DTC稳定性受pH的影响,随着pH逐渐增大,DTC的紫外吸光度无显著变化。综合以上结果,本研究选择9作为体系的pH值。

图10 pH对Mn∶ZnS QDs磷光强度和DTC紫外吸光度的影响Fig.10 Effect of pH on phosphorescence intensity of Mn∶ZnS QDs and UV absorbance of DTC
3.4 DTC的定量检测
在优化的实验条件下,本研究建立磷光探针对 DTC 浓度梯度为 0.05,0.25,2.5,25,50,100,150 μmol·L-1的标准品进行了测定。如图11所示,随着DTC浓度的不断增大,Mn∶ZnS QDs磷光信号不断减弱。DTC 在0.05~150 μmol·L-1浓度范围内与Mn∶ZnS QDs磷光猝灭前后比值的自然对数[ln(P0/P)]呈良好的线性关系,线性方程为lnP0/P=0.01758C(DTC)+0.01351,相关系数 R2=0.999,检出限为 0.009 7 μmol·L-1(信噪比为3(S/N=3))。该磷光探针与其他文献报道的DTC检测法相比,有较低的检测限和较宽的检测范围(见表1)。此外,将制备好的Mn∶ZnS QDs磷光探针体系置于4℃ 条件下避光保存,在最优实验条件下,每隔一天对浓度为25 μmol·L-1的DTC进行检测,用来检验该探针的稳定性。在25 μmol·L-1的DTC条件下,紫外吸收测定结果的日内精密度为3.34%,日间精密度为4.15%。上述结果表明,放置一段时间的探针体系检测效果与制备初期检测效果差异不大,具有良好的稳定性(7 d)。

图11 不同DTC浓度对Mn∶ZnS QDs磷光强度的影响Fig.11 Effect of DTC concentration on phosphorescence intensity of Mn∶ZnS QDs
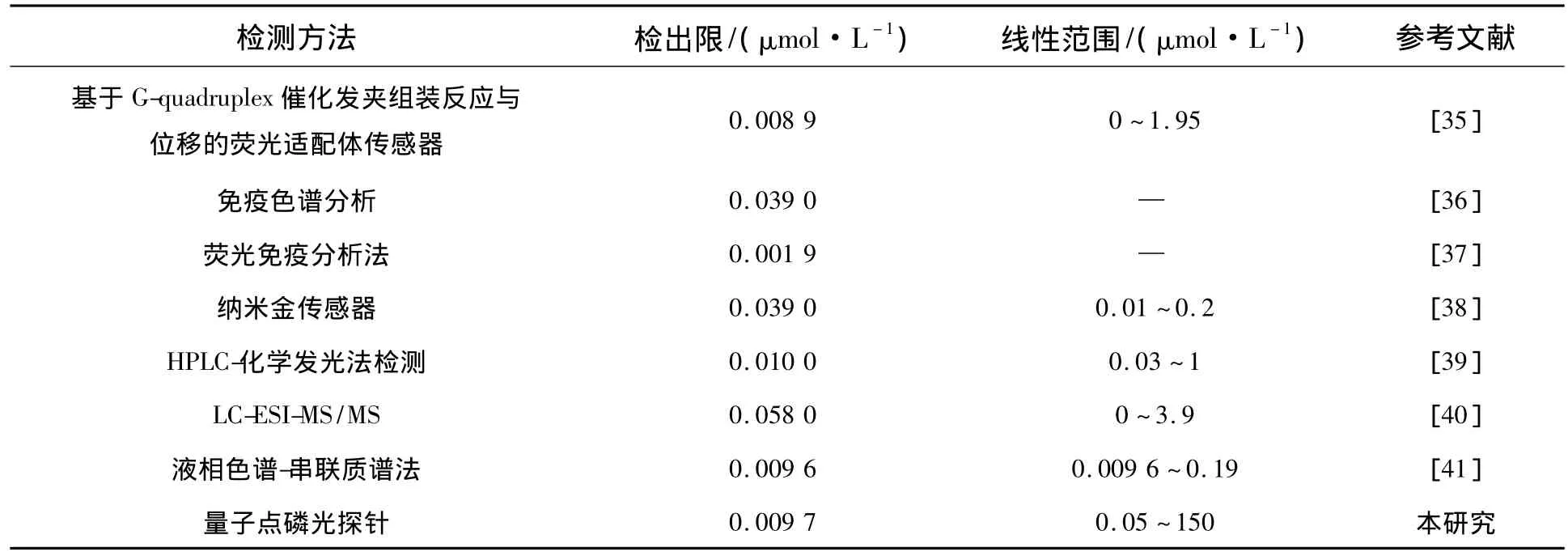
表1 本研究磷光探针与其他方法比较Tab.1 Comparison with other detection methods
3.5 选择性试验
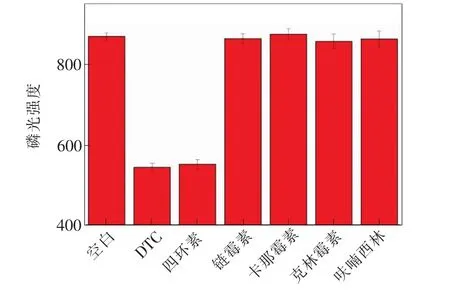
图12 磷光探针选择性分析Fig.12 Selectivity analysis of phosphorescence probe
为验证本研究磷光探针的选择性,排除实际样品检测中可能遇到的其他族类或结构类似抗生素的干扰,分别加入25 μmol·L-1的四环素、链霉素、卡那霉素、克林霉素和呋喃西林进行磷光信号测定,结果如图12所示。与空白对照,当检测体系中存在25 μmol·L-1DTC或四环素时,磷光信号明显降低,但是当检测体系中的DTC或四环素由其他抗生素替代时,磷光信号无明显变化。
3.6 蜂蜜样品检测结果
取适量DTC阴性蜂蜜样品,按照2.3.6方法进行加标回收实验,每个样品平行测定3次,以实际测得的DTC浓度与添加的DTC浓度的比值来计算加标回收率,所得加标回收率为92.4%~110%,RSD均小于4.15%(n=3)。结果表明,该磷光探针准确可靠,可用于实际蜂蜜样品中DTC含量的测定(见表2)。
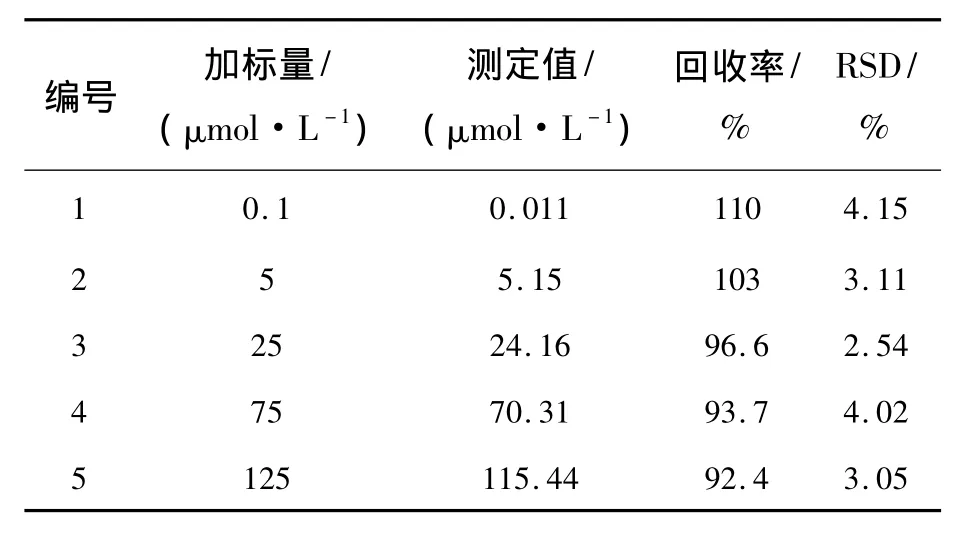
表2 蜂蜜样品中DTC的检测Tab.2 Detection for DTC in honey samples
4 结 论
本研究以TCs对Mn∶ZnS QDs磷光的內滤效应为基础,以DTC为代表构建了用于检测蜂蜜中TCs残留的磷光探针,所需设备简单,操作简便,成本低,效率高,在pH=9的PBS溶液中简单地将Mn∶ZnS QDs目标物混合在一起,就可以得到检测结果,并且具有较高灵敏性。在优化的实验条件下,DTC 在 0.05 ~150 μmol·L-1浓度范围内与Mn∶ZnS QDs磷光猝灭前后比值的自然对数[ln(P0/P)]呈良好的线性关系,线性方程为lnP0/P=0.01758C(DTC)+0.01351,相关系数R2=0.999,检出限为 0.009 7 μmol·L-1。同时,对实际样品蜂蜜做了加标回收率实验,回收率为92.4%~110%。由于DTC与四环素同属于四环素类抗生素,它们具有相似的结构和性质,通过对四环素、土霉素和金霉素的紫外吸收光谱的扫描发现四种四环素类抗生素具有相似的紫外吸收光谱和吸光系数,因此,可对本研究建立的磷光探针在蜂蜜中四环素类抗生素残留总量的定量分析做进一步研究。另外,从本研究基于内滤效应的磷光猝灭机理分析可以看出,如果被测样品溶液中含有在225~325 nm具有较强的紫外光吸收物质时,即可对本磷光探针产生干扰,因此该探针在直接用于复杂基质样品的测定时存在一定局限性。但是,根据被测样品的特点,结合相应分离技术,也可实现除蜂蜜外的其他动物性食品和环境分析中强力霉素残留的快速高灵敏检测。

