119份临床常用中成药说明书内容调查分析
陈 波,刘兆华,贺琳贻
(衡阳市中医医院,湖南 衡阳421000)
药品说明书是载明药品重要信息的法定文件,是临床医师、患者选用药品的法定文件[1]。为规范说明书,保证说明书的安全性和科学性,国家食品药品监督管理局颁布了《药品说明书和标签管理规定》及相关文件,详细制定了药品说明书的撰写要求[2-4]。中成药是在中医学理论指导下,以中草药为原料制成的中药制剂[5],具有使用方便等优势,尤其受到患者青睐,在我国药品市场上占有很大比例。近年来,随着中药不良反应报道逐渐增多[6],中成药说明书在合理用药方面所发挥的作用日益受到重视[5]。本研究对我院2018年度临床常用的中成药说明书项目标注情况进行调查分析,为药品生产企业修订中成药说明书提供参考和数据。
1 资料与方法
1.1 资料来源
收集我院2018年度临床常用的119种中成药说明书,包括处方药80种,非处方药39种。其中注射剂23种,丸剂22种,片剂19种,胶囊剂19种,颗粒剂8种,合剂7种,滴丸剂3种,散剂2种,酊剂2种,煎膏剂2种,其他外用制剂12种。
1.2研究方法
根据国家食品药品监督管理局颁布的《药品说明书和标签管理规定》[2]《中药、天然药物处方药说明书撰写指导原则》(下称《指导原则》)[3-4]等相关文件,利用Excel表格对收集的中成药说明书功能主治、用法用量、不良反应、储藏方法等项目进行统计分析。
2 结果
2.1 功能主治标注
119份临床常用中成药说明书中,功能主治标注度100%,包括仅中医术语标注、仅西医术语标注和中医、西医术语结合标注。结果见表1。
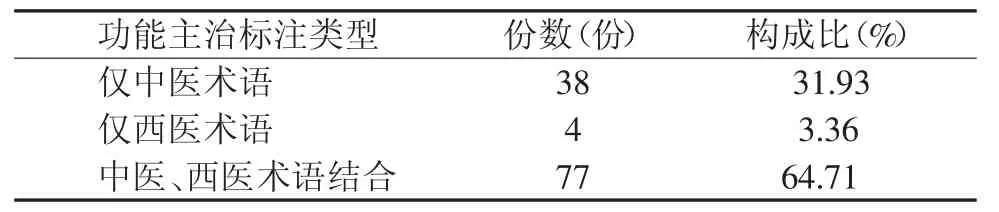
表1 功能主治标注分类表
2.2 用法用量标注
119份临床常用中成药说明书中,用法用量标注度100%,明确标注使用时间的仅13份,占10.9%。
2.3 不良反应、禁忌和注意事项标注
119份临床常用中成药说明书中,不良反应、禁忌和注意事项标注都达到了100%,但“不良反应”项有2份标注“无明显不良反应”。结果见表2。
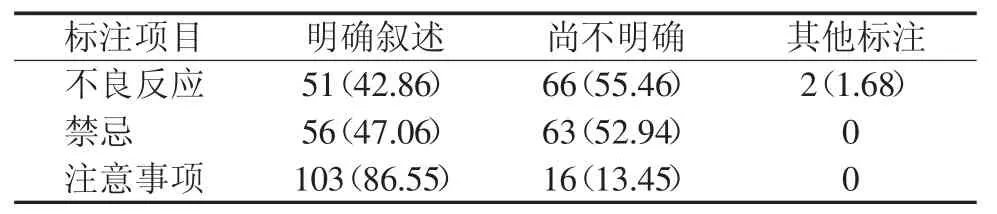
表2 119份中成药说明书不良反应、禁忌和注意事项标注情况[份(%)]
2.4 特殊人群用药标注
119份临床常用中成药说明书中,特殊人群用药均存在缺项。结果见表3。
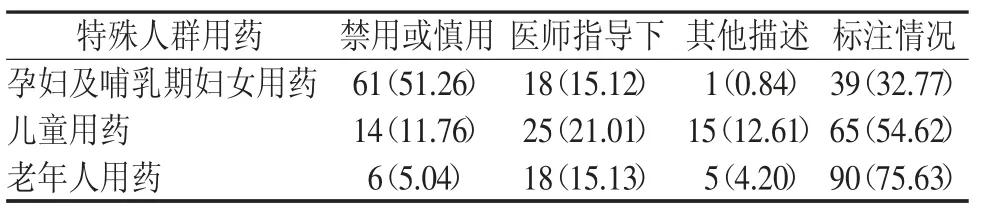
表3 119份中成药说明书特殊人群用药标注情况 [份(%)]
2.5 药物相互作用、临床试验和药理毒理标注
39份非处方药中成药说明书“药物相互作用”项标注度100%,均按《中成药非处方药说明书规范细则》[4](下称“《规范细则》”)要求标注。《规范细则》对非处方药说明书无“临床试验和药理毒理”项要求。而调查中80份处方药说明书的药物相互作用、临床试验和药理毒理缺项严重。结果见表4。

表4 80份处方药说明书药物相互作用、临床试验和药理毒理标注情况 [份(%)]
2.6 储藏标注
119份中成药说明书中,储藏标注度100%,但仅有34份标明储藏温度,占28.57%;储藏条件中含干燥或防潮字样的,仅15份,占12.61%。
3 分析与讨论
本调查研究的119份临床常用中成药说明书,功能主治标注度100%,仅借助中医术语描述的有38份(31.93%),仅借助西医术语描述的只有4份(3.36%),而借助中医术语、西医术语结合描述的有77份(64.71%)。功能主治是中成药说明书中最重要的内容之一[3],其内容的科学性和准确性关系到中成药的合理使用问题[7]。有文献报道,综合医院西医临床医师也开具了大量的中成药[8-9],同时有很多患者自行到药店选择中成药类非处方药使用,这极大地挑战了中成药的合理使用。因此中成药说明书“功能主治”项除了在符合《指导原则》科学、客观、准确的基础上,还应尽可能做到简洁、通俗易懂[10]。
119份临床常用中成药说明书中,用法用量标注度100%,明确标注使用时间的仅13份,占10.9%。如参一胶囊标注“饭前空腹服用”,尿毒清颗粒(无糖型)明确标注使用次数、时间、数量,“每日4次,6、12、18时各服1袋,22时服2袋”。用法用量是药品说明书的重要内容,根据《指导原则》第10条要求,用法用量应包括用药途径、方式、时间、用量、药引等相关内容[3]。说明书中“用法用量”项的科学性、正确性和细致性也直接关系到中成药的合理使用[11]。此外,调查中还发现有不少说明书未标注给药频次,含有“小儿酌减”“约”等字样,这些药品在实际使用过程中,将存在安全隐患。
调查的119份临床常用中成药说明书中,特殊人群用药均存在缺项。“孕妇及哺乳期妇女用药”在说明书中未描述的有39份(32.77%),儿童用药未描述的有65份(54.62%),老年人用药未描述的有90份(75.63%),其他标注情况见表3。中成药处方药和非处方药说明书对特殊人群用药的规定相似,《指导原则》指出“如未进行特殊人群用药相关研究,可不列该项,如有该人群用药需注意的内容,应在[注意事项]项下予以说明”[3]。本研究调查结果显示特殊人群用药缺项严重,与相关报道相符合[12-13],这也表明了药品生产企业对特殊人群用药上市后相关观察、研究不足以及药品说明书更正、修订不及时。
调查中,39份非处方药说明书“药物相互作用”项均按《规范细则》要求注明“如与其他药物同时使用可能会发生药物相互作用,详情请咨询医师或药师”[4]。而80份处方药说明书“药物相互作用、临床试验和药理毒理”项均存在很大比例缺项。其中有21份中成药注射剂说明书药物相互作用标注“尚无本品与其他药物相互作用的信息”[3],还有1份说明书“临床试验和药理毒理”项标注“尚无系统研究资料”。同时中药之间还存在“十八反、十九畏”等配伍禁忌,中成药与化学药联用还存在增毒或者减效作用。而这些项目的缺失,会影响药品说明书的科学性和准确性,也会影响临床医师和药师对药物的安全性和疗效的判断,增加临床用药的安全隐患。建议国家药品管理部门应加强对药品说明书,尤其是中成药药品说明书的审批管理,细化质量标准[14],同时药品生产企业和相关科研机??构可以增加这些项目的研究投入,加强药物上市后的临床观察和研究,并及时修订药品说明书。
药品说明书是医师、患者选用药物的主要依据,是药物在临床前研究和上市后临床观察、研究得出的载有药品重要信息的法定文件。本研究通过调查我院119份临床常用中成药说明书内容标注情况,发现中成药说明书存在缺项和其他不合理之处。有待药品管理部门和药品生产企业共同努力,借助国家药品安全“十四五”规划,严格落实药品生产企业的安全主体责任,加强药品上市后再评价,及时修订并完善中成药说明书,为临床和患者提供科学的用药依据,保障患者安全用药。

