载绞股蓝皂苷纳米结构脂质载体的制备及体外评价
陈敏燕,杨 刚,吴飞华,原永芳
(上海交通大学医学院附属第九人民医院药剂科,上海 200011)
绞股蓝[Gynostemmapentaphyllum(Thunb.) Makino]为我国常用的药食同源品,可以起到保护心脑血管、调血脂、降血糖、抗肿瘤、增强免疫力等作用,因其独特的功效,在医药、食品、保健品中被广泛应用。绞股蓝的主要活性成分是绞股蓝皂苷[1],与其他皂苷类成分一样,绞股蓝皂苷性质不稳定,在肠内菌作用下被代谢成多种代谢产物,在胃液中也容易被降解[2];另外,较差的水溶性和脂溶性也影响其生物利用度[3]。目前,市售制剂主要有绞股蓝含片、绞股蓝总苷胶囊、绞股蓝口服液以及复方绞股蓝等。为改善其生物利用度,国内外研究人员还将其制备成微囊、脂质体等制剂[4-5]。
纳米结构脂质载体(nanostructured lipid carriers,NLCs)是继固体脂质纳米粒(solid lipid nanoparticles,SLNs)之后的二代脂质体系,与SLNs不同之处在于,它是采用混合类脂为载体材料,将液态脂质混合到固体脂质中制备而得,载体中具有较高的晶体缺陷,可以容纳更多的药物分子,使其具有更高的载药能力[6]。同时,NLCs还保留了SLNs缓释、生物相容性好、易制备的优点,且增强了稳定性[7]。与微囊和脂质体等剂型相比,NLCs具有载药量高、生物稳定性好、缓释效果显著等优势。高压均质法是目前报道的制备NLCs的主要方法,该方法操作简便,易于控制,且可避免使用对人体有害的附加有机溶剂[8]。本文采用高压均质法制备载绞股蓝皂苷纳米结构脂质载体(GPS-NLCs),并对其体外释放行为进行了考察,现报道如下。
1 材 料
1.1 仪器 高效液相色谱仪 (美国安捷伦公司);RC-806溶出度仪(天津因赛科技发展有限公司);NS1001L高压均质机 (意大利GEA Niro Soavi公司);Nano ZS 90激光粒度仪(英国Malvern公司);D8 Advance X射线衍射仪(德国布鲁克公司);Q2000差示扫描量热仪(美国TA公司);T25高度分散仪(德国IKA公司);超滤离心管(美国Pall公司)。
1.2 药品和试剂 绞股蓝皂苷对照品(纯度>98%,批号112033-201701,中国食品药品检定研究院);绞股蓝皂苷原料药(纯度≥95%,批号 S31402-5g,上海源叶生物科技有限公司);单硬脂酸甘油酯 (国药集团药业股份有限公司);单亚油酸甘油酯(Maisine 35-1)和油酰基聚乙二酯甘油酯(Labrafil M1944 CS)由法国Gattefossé公司提供;大豆磷脂(Lipoid S 100,德国Lipoid公司);吐温-80 (美国Sigma公司);乙腈(色谱纯,德国Merck公司);其余试剂均为分析纯。
2 方法和结果
2.1 绞股蓝皂苷分析方法的建立
2.1.1 色谱条件 色谱柱:Diamonsil Plus C18柱(250 mm×4.6 mm,5 μm);流动相:乙腈-水(35∶65);检测波长:203 nm;流速:1.0 ml/min;柱温:30 ℃;进样量:20 μl。在该色谱条件下,绞股蓝皂苷峰的理论塔板数≥10 000,分离度>1.5。
2.1.2 标准曲线的制备 精密称取绞股蓝皂苷对照品适量溶于甲醇,分别配制成浓度为2、12、30、60、90、150 μg/ml的绞股蓝皂苷对照溶液,分别吸取20 μl,注入高效液相色谱仪,记录峰面积值(A),以浓度(c)对A作线性回归,得到回归方程为:A=9.249c+21.253(r=0.999 4)。结果表明,在2~150 μg/ml的浓度范围内线性关系良好。
2.2 GPS-NLCs及GPS-SLNs的制备 (1)GPS-NLCs的制备:采用高压均质法制备GPS-NLCs。将处方量的混合脂质(固体脂质为单硬脂酸甘油酯,液态脂质为单亚油酸甘油酯和油酰基聚乙二醇甘油酯)水浴加热至65 ℃,搅拌条件下充分混合,熔融得到油相;将处方量的绞股蓝皂苷和乳化剂(大豆磷脂∶吐温-80=1∶1)置于烧杯中混合后,加适量蒸馏水搅拌溶解,并加热至油相的温度,即得到水相。在T25高度分散仪高速分散下,将水相加入到油相中,持续搅拌一段时间,得到初分散体系,再经高压乳匀,即得GPS-NLCs。以粒径和多分散系数(polydispersity index,PDI)为指标,对分散仪的搅拌功率、搅拌时间、均质压力以及均质次数这4个参数进行筛选。工艺参数的设置以及各参数下制备的GPS-NLCs的粒径和PDI见表1。由表1可知,搅拌功率对粒径和PDI的影响均较小,随着搅拌时间、均质压力以及均质次数的增加,粒径呈先减小后增大的趋势。考虑到均质压力和均质次数的增加会导致体系温度升高,粒径减小,故确定工艺参数如下:搅拌功率6000 W,搅拌时间6 min,均质压力80 MPa(800 bar),均质次数8次。 (2)GPS-SLNs的制备:仅以固态脂质替代液态脂质,其余组分与GPS-NLCs处方相同,采用高压均质法以同样的工艺制备GPS-SLNs。
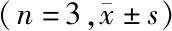
表1 高压均质法制备GPS-NLCs的工艺参数优化Table 1 Optimization of the process parameters of GPS-NLCs prepared by high-pressure homogenization method
2.3 理化性质考察
2.3.1 粒径及zeta电位的测定 将制备好的GPS-NLCs用适量去离子水稀释后,测定粒径及zeta电位。GPS-NLCs的平均粒径为(159.6±6.6) nm,PDI为(0.221±0.009),其粒径分布较窄,为60~200 nm,GPS-NLCs的zeta电位为(-31.1±1.3) mV,表明制得的纳米粒表面带负电荷,稳定性较好。
2.3.2 包封率及载药量的测定 采用超滤法测定GPS-NLCs的包封率(entrapment efficiency,EE)及载药量(drug loading,DL)。精密移取0.5 ml制得的GPS-NLCs混悬液,加入适量乙腈破乳,超声(功率500 W)30 min后经0.45 μm微孔滤膜过滤,用HPLC法测定GPS浓度,计算总药量(W总)。另取0.5 ml GPS-NLCs置超滤离心管中(截留分子量10 ku),以相对离心力2.795×103×g离心15 min,取滤液,经HPLC法测定,计算游离指标性成分的含量(W游离)。参照下列公式分别计算包封率和载药量:EE=(W总-W游离)/W总×100%,DL=(W总-W游离)/W脂质×100%,其中W脂质为制剂中加入的脂质材料的质量。测得GPS-NLCs的包封率和载药量分别为(74.30±3.17)%和(4.91±0.39)%(n=3),表明NLCs对药物有较好的包裹和装载能力。
2.3.3 形态观察 利用透射电镜(transmission electron microscopy)对GPS-NLCs的外观形态进行观察。将GPS-NLCs分散于适量去离子水中,取适量滴加至铜网上自然干燥,约20 min后形成薄膜,再滴加2%磷钨酸负染10 min,用滤纸从铜网边缘吸除多余液体,晾干后放至透射电镜下进行观察。GPS-NLCs的透射电镜观察结果见图1。由图1可见,纳米粒近球形,分布较均匀。
图1 GPS-NLCs的透射电镜图Figure 1 Transmission electron micrograph of GPS-NLCsGPS-NLCs:载绞股蓝皂苷纳米结构脂质载体
2.4 体外溶出实验 为了验证 NLCs 在提高药物溶出度上的优势,将其与绞股蓝皂苷原药粉混悬液以及初代脂质体系SLNs进行比较,采用透析袋法对各制剂的体外溶出行为进行考察。将制备好的GPS-NLCs、GPS-SLNs以及绞股蓝皂苷混悬液各5 ml加至处理好的透析袋内,透析袋两端用医用编织线扎紧,用橡皮筋固定在搅拌浆上,浸没在100 ml溶出介质[PEG 400的生理盐水溶液,PEG 400∶生理盐水=1∶4(V/V)]中,恒温(37±0.5) ℃,搅拌速度为120 r/min,采用桨法。分别于特定时间点吸取溶液1 ml,同时补充等体积空白溶出介质,样品经0.45 μm微孔滤膜过滤后,经HPLC法测定GPS浓度。每种制剂做3份平行操作。
释药曲线如图2所示,绞股蓝皂苷原药粉的溶出速率要高于SLNs组和NLCs组,在30 min内就达到了溶解平衡。SLNs组和NLCs组则在40 h后才达到溶解平衡,这是由于药物要通过脂质层才得以释放。同时,SLNs组和NLCs组的体外累积溶出度均明显高于原药粉组。推测原因可能是因为经高压均质制成SLNs和NLCs后,药物可能以无定型状态存在于载体中[9]。此外,NLCs组在48 h内的体外累积溶出度要高于SLNs组,可能是由于液态脂质的加入打乱了纳米粒的有序结构排列,使得NLCs具有更高的体外累积溶出度[10]。因此,NLCs能够显著改善绞股蓝皂苷原药粉的溶出度。与SLNs相比,NLCs在改善药物溶出度上也具有一定的优势。
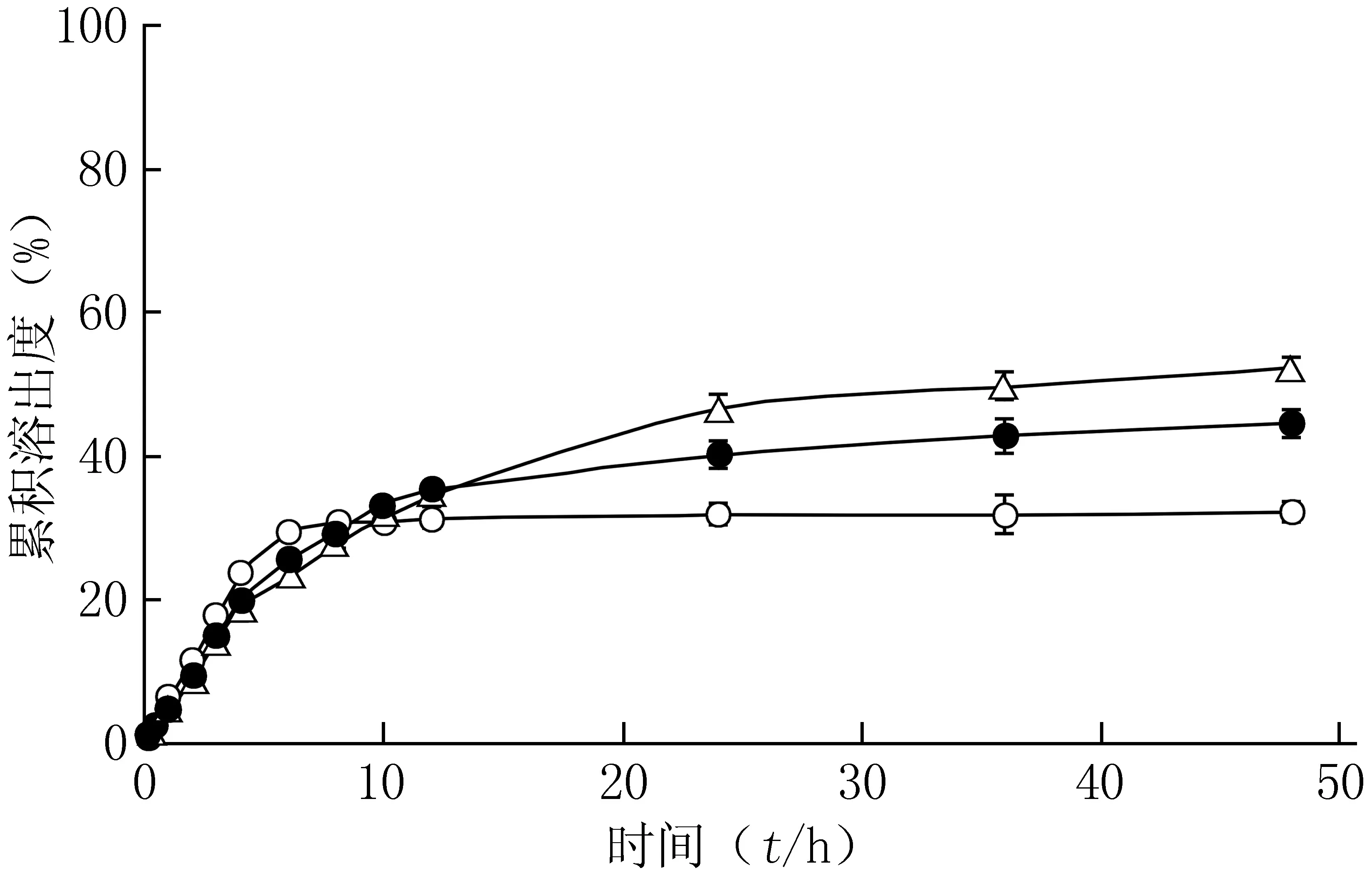
图2 GPS的释药曲线Figure 2 Drug release profiles of GPS○:GPS混悬液;●:GPS-SLNs;△:GPS-NLCs;GPS:绞股蓝皂苷;GPS-SLNs:载绞股蓝皂苷固体脂质纳米粒;GPS-NLCs:载绞股蓝皂苷纳米结构脂质载体;
3 讨 论
绞股蓝皂苷水溶性差,性质不稳定,限制了其在临床的应用。本研究采用高压均质法将其制成GPS-NLCs,提高了其体外释放,且GPS-NLCs释药特点是前期快速释放,后期缓慢释药,具有明显的缓释效果。GPS-NLCs体外释放显著提高的原因可能是降低了制剂的粒径,增大了其比表面积。从药物学来说,药物的溶出速率与药物颗粒的比表面积成正比,而比表面积与粒径成反比。因此,药物的粒径越小,其比表面积越大,接触周围介质的面积愈大,越有助于药物有效成分的溶出[11]。GPS-NLCs粒径约为160 nm,降低粒径后增大了比表面积和药物饱和溶解度,从而提高了药物的释放量。GPS-NLCs的生物利用度有待通过药动学试验进一步研究,期望本研究能为绞股蓝新型制剂的研究和开发提供一定实验基础。

