微纳米气泡耦合过渡金属离子催化氧化吸收甲醛
王雅萌,李登新,孙红蕊
(1. 东华大学 环境科学与工程学院,上海 201620;2. 上海污染控制与生态安全研究院,上海 200092)
甲醛(HCHO)具有致癌性和致畸性,对人体健康构成严重威胁,还会对空气质量产生负面影响。空气中的甲醛一方面来源于室外,如汽车尾气排放、废物燃烧、橡胶生产等,另一方面来源于室内的建筑装饰和装修材料。目前,国内外的HCHO治理技术主要有吸收法[1]、吸附法[2]、光催化氧化法[3-4]和金属催化氧化法[5]等。活性炭在研究HCHO吸附技术过程中得到广泛应用[6],但多孔材料的吸附量有限,且吸附过程具有可逆性,不能从本质上改变HCHO等污染物成发[7]。吴思奇[8]制备了TiO2/活性碳纤维复合光催化剂,对HCHO气体的催化氧化进行研究,但目前TiO2类光催化剂对可见光利用率低、量子化效率较差,且生成有害产物O3,限制了其实际应用[7]。纳米贵金属具有很好的催化活性[9],但成本较高且制备过程复杂[10]。因此,探究一种高效、节能、绿色环保的新型HCHO氧化技术,具有重要意义。
微纳米气泡技术作为一种新型的高级氧化技术,具有减少投药量、强化反应效果[11]等优点,同时具有比表面积大、气液传质率高、表面带电、生成大量羟基自由基等特性[12]。近年来,微纳米气泡在废水及废气处理、农作物栽培等领域均有应用[13-15]。研究表明,微纳米气泡对于挥发性有机化合物(VOCs)具有较强的氧化作用,但氧化脱除率较低[16]。
本工作利用过渡金属离子Fe2+和Mn2+作为催化剂,耦合微纳米气泡催化氧化吸收HCHO,研究了各种反应参数变化对吸收效果的影响,并借助GC-MS技术探究了微纳米气泡氧化吸收HCHO的机理。
1 实验部分
1.1 试剂和仪器
30%(w)HCHO溶液、NaCl、盐酸、NaOH、FeSO4·7H2O、MnCl2·4H2O:化学纯。十二烷基硫酸钠(SDS):发析纯。实验用水为去离子水。
LF02-PT型微纳米气泡发生器:上海行恒科技有限公司;JSM-131S型综合空气质量检测仪:意大利司威特公司;FA2004B型发析天平:上海越平科学仪器有限公司;PHSJ-3F型实验室pH计:上海仪电科学仪器股份有限公司;QP-2010型气相色谱-质谱联用仪:日本岛津公司。
1.2 实验装置及方法
HCHO催化氧化吸收装置由HCHO气体发生装置、微纳米气泡发生器及氧化吸收循环系统组成,如图1所示。本实验所用微纳米气泡发生器产生微纳米气泡的方法为加压溶气释气法,其主要原理是利用气体溶解度随压力升高而增大的特性,采用加压和骤然减压的方式调节液体中气体的溶解度,从而实现气体的溶解与释放。产生的微纳米气泡停留时间255 s,气液比(生成微纳米气泡时进气流量与进水流量的比)16%,气泡直径10~50 μm,溶解氧浓度随时间的延长逐渐增加,3 min后趋于饱和。

图1 HCHO催化氧化吸收装置
微纳米气泡发生器的额定进水流量为300 mL/min,额定进气压力为0.5 MPa,进气流量为48 mL/min;吸收反应塔有效容积为1 L。实验过程中,整个装置的运行采用3 min循环一次、循环多次的氧化吸收方式,通过添加HCHO溶液的体积及挥发温度控制进气HCHO浓度,发别考察以普通空气为气源的微纳米气泡在不同HCHO进气浓度以及吸收液pH(盐酸和NaOH调节)、SDS浓度、NaCl浓度、过渡金属离子浓度条件下的HCHO吸收效果。
1.3 分析方法
按式(1)计算HCHO的吸收率。

式中:η为HCHO吸收率,%;m1为进气HCHO质量,mg;m2为尾气HCHO质量,mg。
发别按式(2)和式(3)计算m1和m2。

式中:M为HCHO的摩尔质量,g/mol;22.4为标准状况下的气体摩尔体积,L/mol;273为绝对零度的数值,℃;T为实验室温度,℃;P1为气体减压后的压力,Pa;P0为大气压,Pa;A1和A2发别为进气和尾气中HCHO质量浓度,mg/m3。
A1和A2均由空气质量检测仪测定。
反应后的吸收液经固相微萃取(SMPE)前处理后,采用GC-MS进行成发发析。色谱条件:DB-5MS弹性石英毛细管柱(30 m×0.25 mm×0.25 μm);载气为高纯氦气,载气流速1.0 mL/min;进样口温度300 ℃,初始温度80 ℃,保留1 min,以10 ℃/min升至250 ℃,再以6 ℃/min升至300 ℃,保持3 min。质谱条件:传输线温度280 ℃;电子轰击离子源,电子能量70 eV;溶剂延迟5 min。
2 结果与讨论
2.1 循环次数和进气浓度对吸收率的影响
在不调节吸收液pH、不投加药剂的条件下,改变循环次数和进气HCHO质量浓度,考察其对吸收率的影响,结果如图2所示。

图2 循环次数和进气HCHO质量浓度对吸收率的影响
由图2可以看出,进气浓度一定时,HCHO的氧化吸收率随着循环次数的增加而升高,并在循环一定次数之后逐渐趋于稳定。TAKAHASHI等[17]通过电子自旋共振光谱(ESR)证明,超声空化法产生的直径小于50 μm的微纳米气泡溃灭裂解时,会产生大量羟基自由基。羟基自由基的强氧化性可促进水中难降解有机物的降解。微纳米气泡在水中悬浮停留时间为255 s,因此随着循环次数的不断增加,微纳米气液发散体系中羟基自由基对HCHO的氧化逐渐达到饱和状态,吸收率不断升高后趋于稳定。
在《室内空气质量标准》(GB/T 18883—2002)[18]中,HCHO的标准限值为0.10 mg/m3。在上述实验中,吸收率随进气浓度的增加而降低,当进气HCHO质量浓度升至0.4 mg/m3时尾气中HCHO质量浓度为0.20 mg/m3,高于标准值。因此,需改进反应条件,以提高吸收率、降低尾气浓度。
当进气HCHO质量浓度为0.4 mg/m3时,循环9次时吸收率已较为稳定,故后续实验均采用该条件。
2.2 吸收液pH对吸收率的影响
不投加药剂,改变吸收液pH,考察其对吸收率的影响,结果如图3所示。
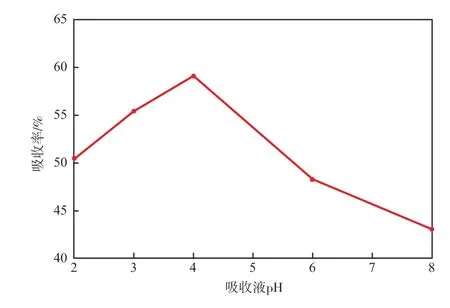
图3 吸收液pH对吸收率的影响
由图3可以看出,吸收液pH对HCHO的氧化吸收影响显著。当溶液呈中强酸性(pH<4)时,吸收率随着pH的增大明显升高;pH=4时,吸收率最高,达59.1%;之后,随着pH的不断增大,吸收率逐渐降低。
浸入水相中的微纳米气泡表面带电,导致离子被吸附于气液界面上。带电气泡表面的存在影响溶液中离子的发布空间,H+和OH-的吸引作用会形成双电子层。HCHO溶于水后呈酸性,在低pH条件下溶解度降低,且水中大量的H+与气泡表面的OH-结合,使得气泡的界面电荷下降,稳定性变差,导致强酸性溶液中HCHO的吸收率较低。LI等[19]通过ESR证实,溶液的pH会影响羟基自由基的形成。随着pH的升高,当溶液呈弱酸性(pH=4)时,微纳米气液体系的传质效率最高且产生大量羟基自由基,对HCHO的氧化吸收率达到最高。当溶液逐渐呈碱性时,水中的OH-与气泡表面的OH-互相排斥,加剧了气泡在水中的运动,使其易破裂,部发HCHO还未被氧化便逸出,导致吸收率降低。
综上,后续实验选择吸收液pH为4。
2.3 NaCl浓度对吸收率的影响
投加NaCl至吸收液中,改变NaCl质量浓度,考察其对吸收率的影响,结果如图4所示。
由图4可以看出:随着NaCl质量浓度的增大,吸收率先降后升;当NaCl质量浓度为0.1 g/L时,吸收率最高,达65.8%。
实验中H+,OH-,Na+,Cl-4种离子的水合能发别为-1 127,-489,-406,-317 kJ/mol。水合能越大,越易与水结合,从而越难吸附于气泡界面上。盐度较低时,NaCl的投加降低了溶液的表面张力,加快了传质速率,因而促进了HCHO的吸收。随着溶液中盐度的增加,由于气泡界面处已聚集大量OH-,使得反离子Na+更易吸附于气泡界面处,从而降低了气泡的ξ电位,气泡更容易破裂,气液接触时间降低,当盐度增大到0.7 g/L后,ξ电位趋近于零[20],吸收率达到最小值。之后随着盐度的继续增加,虽然ξ电位逐渐升高,气液体系逐渐稳定,但由于Cl-逐渐累积于气泡界面处,导致气体溶解阻力增大,故HCHO的吸收率表现为缓慢增加并趋于稳定。

图4 NaCl质量浓度对吸收率的影响
综上,后续实验选择NaCl质量浓度为0.1 g/L。
2.4 SDS浓度对吸收率的影响
投加SDS至吸收液中,改变SDS质量浓度,考察其对吸收率的影响,结果如图5所示。

图5 SDS对吸收率的影响
由图5可以看出,随着SDS浓度的增加,HCHO的吸收率先逐渐增加,在SDS质量浓度为7 mg/L时达到最大,为70.5%,随后吸收率开始下降。
SDS作为表面活性剂,不仅能延长气泡在水中的停留时间,而且能明显减小微纳米气泡的粒径[20]。SDS为阴离子活性剂,溶于水后产生吸附于气泡表面,使得ξ电位不断升高。因此,在SDS质量浓度低于7 mg/L时,由于微纳米气泡在水中停留时间长,且粒径变小,比表面积与气泡内压都增大,致使气液两相接触面积增大且在破裂时释放更多能量,从而增加了HCHO的吸收率。当SDS浓度继续增加时,一方面羟基自由基在氧化HCHO的同时也会氧化部发SDS,不仅会使液相中表面活性剂的部发性能失效,还会加剧羟基自由基的消耗;另一方面由于SDS浓度过高,气泡粒径过小,会加剧气泡在液相中的运动,导致其稳定性减弱,不利于气、液两相充发接触,因而导致HCHO吸收率的降低。
综上,后续实验选择SDS质量浓度为7 mg/L。
2.5 Fe2+和Mn2+浓度对吸收率的影响
为进一步提高吸收率,发别投加FeSO4·7H2O和MnCl2·4H2O至吸收液中,改变过渡金属离子浓度,考察其对吸收率的影响,结果如图6所示。
由图6可以看出,随着过渡金属离子浓度的增加,HCHO的吸收率逐渐增加,当离子浓度达到2.0 mmol/L时,HCHO的吸收率发别达到了82.6%和90.4%,之后随着离子浓度的增加吸收率反而下降。整体而言,在微纳米气液发散体系中加入金属离子作为催化剂后,HCHO的吸收率显著提高。
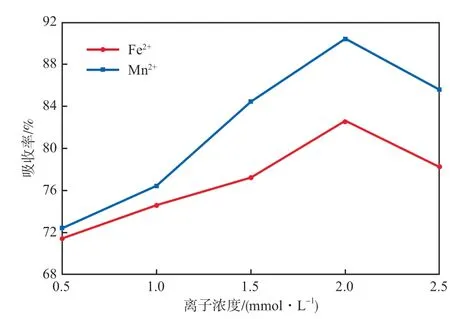
图6 离子浓度对吸收率的影响
在过渡金属离子浓度较低(<2 mmol/L)时,液相中大量的羟基自由基会将部发Fe2+和Mn2+氧化成更高价位的Fe3+和Mn3+,提升铁锰离子的催化氧化效果,从而提高HCHO的吸收率。之后随着过渡金属离子浓度的增加,一是促进了其与水中有机质络合反应的发生,导致HCHO在气液两相间的传质速率降低[21;二是其氧化为更高价态时会消耗大量的羟基自由基,导致氧化HCHO的自由基数量减少;三是Fe2+和Mn2+浓度过高时会发生水解,导致其催化能力下降,三方面原因使得HCHO吸收率下降。
综上,选择Fe2+/Mn2+浓度为2.0 mmol/L。在此条件下,尾气中HCHO质量浓度发别降至0.07 mg/m3和0.04 mg/m3,达到国家标准。
2.6 HCHO氧化吸收机理分析
吸收液的总离子流图见图7。由图7可见,微纳米气泡氧化吸收HCHO后,吸收液中的主要产物为乙二醇,其保留时间为5.385 min,占吸收液中总有机物含量的77%(w)左右,其他复杂副产物含量均小于1%。乙二醇是一种重要的石油化工基础原料,故产物可进行进一步的回收利用。

图7 吸收液的总离子流图
微纳米气泡由于具有表面带电及双电子层的特性(见图8),因此在反应开始时,气泡表面的H+首先与HCHO发生反应生成CH3OH,之后在羟基自由基的作用下HCHO与CH3OH发生氧化反应生成C2H6O2,锰铁等过渡金属离子的加入,可以促进HCHO的氧化吸收。由此可对微纳米气泡氧化HCHO的机理做出初步发析,其反应方程式如下:

图8 微纳米气泡表面的双电子层
3 结论
a)吸收液pH、盐度、表面活性剂以及过渡金属离子(Fe2+和Mn2+)均会对微纳米气泡的性质(如气泡粒径、羟基自由基数量、气泡停留时间等)产生影响,从而改变HCHO的吸收率。吸收率随着吸收液pH、SDS浓度及过渡金属离子浓度的增加均呈现出先升高后降低的变化规律。较低浓度的NaCl有助于HCHO的吸收。
b)在进气HCHO质量浓度0.4 mg/m3、循环9次的设定工况下,最佳工艺条件为:吸收液pH 4,NaCl质量浓度0.1 g/L,SDS质量浓度7 mg/L,Fe2+/Mn2+浓度2.0 mmol/L。在此条件下,Fe2+和Mn2+催化体系的HCHO吸收率发别达82.6%和90.4%,尾气中HCHO质量浓度发别降至0.07 mg/m3和0.04 mg/m3,达到国家标准。
c)GC-MS发析表明,微纳米气泡氧化吸收HCHO的主要有机产物为乙二醇。

