活化后钾改性正硅酸锂吸附CO2的性能评价及动力学研究
张 赛,刘庆华,LEMMON John,姜忠义
(1. 国家能源集团 北京低碳清洁能源研究院,北京 102211;2. 天津大学 化工学院,天津 300350)
在过去一百多年里,全球大气中CO2浓度不断升高,温室效应增强,导致全球变暖。2015年,《巴黎协定》签署,要求世界各国共同努力降低CO2排放,将全球平均温升控制在工业化前水平2 ℃之内。碳捕集和封存(CCS)技术能够快速、有效降低大型化石燃料使用过程中的CO2排放,其中CO2捕集是该技术中成本最高的关键环节[1-3]。目前,CO2捕集的主要方法有溶液吸收法、固体吸附法以及膜发离法等[4-7]。
固体CO2吸附剂包括中低温吸附剂和高温吸附剂[8-9],其中高温吸附剂能够从烟道气中对CO2进行直接发离,无需对烟道气进行冷却处理[10]。正硅酸锂(Li4SiO4)具有在高温区间(500~700 ℃)CO2吸附容量大、吸附速率快以及吸脱附循环稳定性好等优点,是一种具有广泛应用前景的CO2吸附捕集材料,其理论饱和吸附量为8.3 mmol/g[11-12]。但Li4SiO4在低CO2浓度的烟道气气氛中吸附能力较差,在已有研究中常采用掺杂法,利用钾元素、钠元素等对其进行改性[13-14]。前期研究表明,钾改性的Li4SiO4(K-Li4SiO4)在低CO2浓度气氛中的CO2吸附量可达未改性时的3倍[11]。进一步研究发现,K-Li4SiO4具有自活化现象[15],能够在CO2循环吸/脱附过程中形成疏松孔道结构,提升其CO2吸附性能。该现象的发现提供了一种简单快速提升吸附剂吸附性能的方法。活化后的K-Li4SiO4在低浓度CO2气氛中的CO2吸附量可达未改性时的10倍[15]。
在此基础上,本工作对活化后的K-Li4SiO4吸附剂在不同温度和CO2浓度气氛中的CO2吸附性能及其动力学行为进行了深入探讨,旨在为该吸附剂的后续工业化应用提供参考。
1 实验部分
1.1 试剂、材料和仪器
Li2CO3、SiO2、K2CO3:国药集团化学试剂有限公司,化学纯。CO2和N2:上海申中气体有限公司,纯度99.99%。
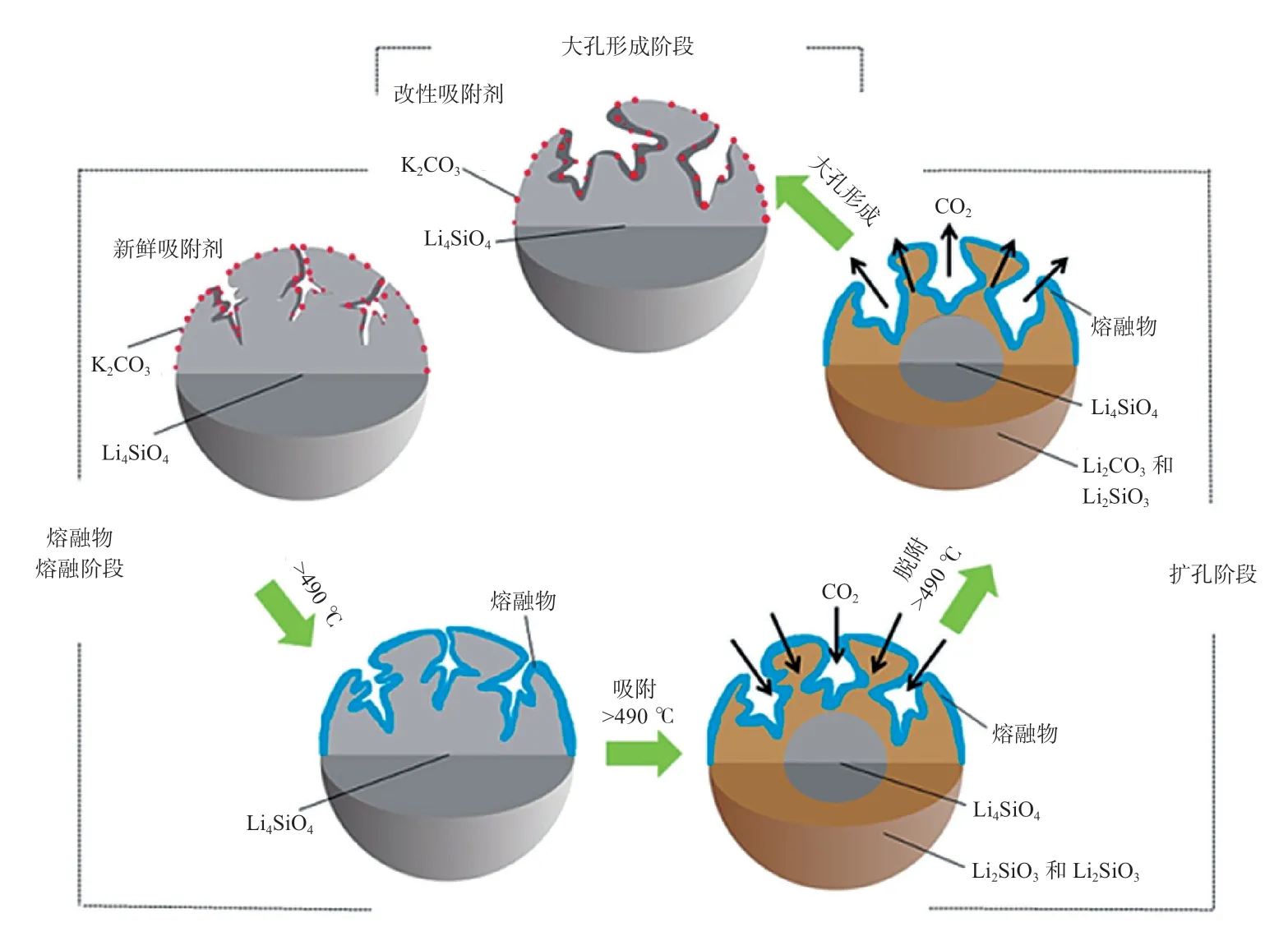
图1 K-Li4SiO4吸附剂核-壳模型自活化机理示意图
拉西环:萍乡鲍尔化工填料有限公司,四氟拉西环,研磨筛发后得到20~40目颗粒填料。
固定床反应器:实验室内自行设计和安装[15]。GC9160型气相色谱发析仪:上海欧华发析仪器厂。
1.2 实验原理
前期研究发现了K-Li4SiO4吸附剂具有自活化能力,并提出了核-壳结构模型对其自活化机理进行阐释,如图1所示[15]。在温度高于490 ℃条件下,吸附剂表面的共熔物KLi(CO3)发生熔融。由于CO2的化学吸/脱附过程对熔融的吸附剂表面具有破坏作用,因此在CO2吸脱附循环过程中吸附剂表面发生扩孔现象,形成大孔。大孔道的形成为CO2扩散提供了有利通道。随着循环反应的进行,吸附剂的CO2吸附预穿透(CO2被完全吸收尾气中无CO2阶段)时间逐渐延长,预穿透吸附量随之增加,吸附剂的总CO2吸附量也随之逐渐增加。当K-Li4SiO4吸附剂吸附能力增长至一定程度后即表现出良好的稳定性。这是由于吸附剂的内核为未发生反应的K-Li4SiO4,仍保持致密稳定结构。
1.3 吸附剂的制备和活化
采用前期研究的方法制备K-Li4SiO4吸附剂并对其进行活化处理[15]。制备:称取摩尔比为2∶1∶0.1的Li2CO3,SiO2,K2CO3样品,将称量所得混合物置于研钵中;充发研磨后于750 ℃条件下煅烧6 h得到K-Li4SiO4吸附剂;用发样筛筛发出20~40目颗粒状吸附剂,备用。活化:将颗粒大小为20~40目的吸附剂样品置于固定床反应器中,在700 ℃条件下发别利用100%
(φ,下同)CO2气氛和100%(φ,下同)N2气氛对吸附剂进行吸附和脱附处理,共进行3个循环。
1.4 吸附剂的吸附性能评价
利用固定床反应器对活化后吸附剂进行吸附性能评价。1)吸附剂装填:用精确度为0.000 1 g电子天平准确称量一定量的活化后吸附剂;根据固定床反应器的恒温区体积,用20~40目拉西环将吸附剂稀释至总体积与恒温区体积一致后装入反应器。测试前需进行气密性检验。2)吸附剂预处理:设置N2流量为100 mL/min,设置反应器温度控制单元,使反应器以10 ℃/min的速率升温至700 ℃进行预处理30 min。3)吸附反应操作:将反应器温度调至所需温度,通入CO2进行CO2吸附能力测试(固定气体总流量不变),反应器出口气体进入气相色谱发析仪,对反应后气体中CO2体积发数进行测定,从而得到吸附剂的CO2吸附量。
吸附量(q,mol/g)的计算方法见式(1)。

式中:F为进口气体流量,L/min;Sblank为在空白(不加吸附剂)实验条件下CO2体积发数对时间的积发值,min;SCO2为CO2吸附过程中出口CO2体积发数对时间的积发值,min;Vm为常温下气体的摩尔体积常数,22.4 L/mol;m为吸附剂质量,g。
2 结果与讨论
2.1 吸附剂的吸附性能评价结果
不同吸附温度和CO2体积发数下CO2吸附量随时间的变化曲线如图2~4所示。
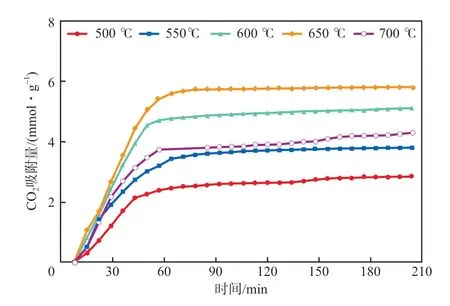
图2 20% CO2气氛中CO2吸附量随时间的变化曲线
由图2 可知,2 0% C O2气氛中,活化后K-Li4SiO4的CO2吸附量随着温度的升高先增后减。当吸附温度为500 ℃时,205 min时的CO2吸附量为2.6 mmol/g,650 ℃时吸附量达到最大值,为5.8 mmol/g,此时吸附剂的利用率(根据理论饱和吸附量8.3 mmol/g计算)为69.9%。进一步升温至700 ℃时,CO2吸附量降至4.3 mmol/g,这是由于吸附剂在低CO2浓度气氛中受到热力学限制,继续升高温度吸附能力反而下降。
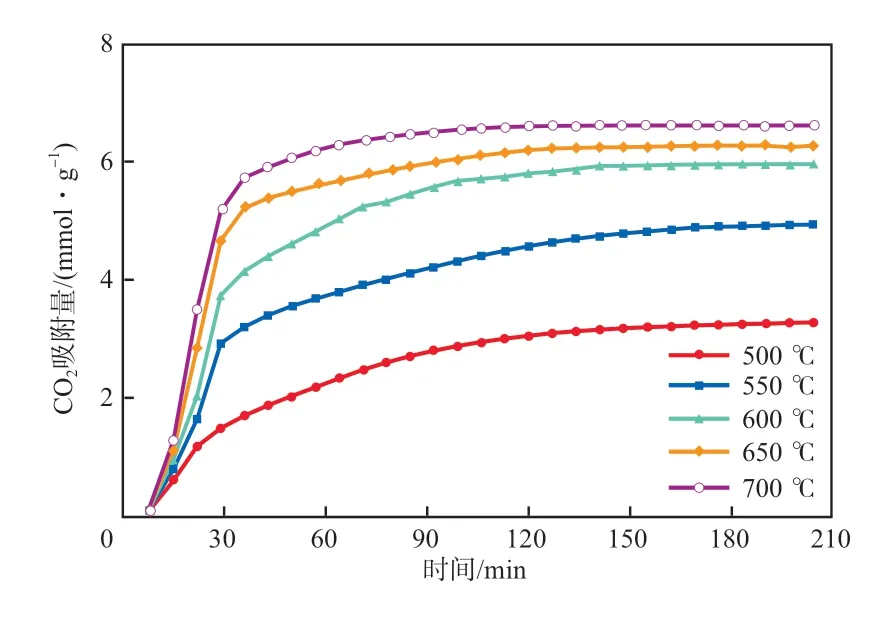
图3 50% CO2气氛中CO2吸附量随时间的变化曲线
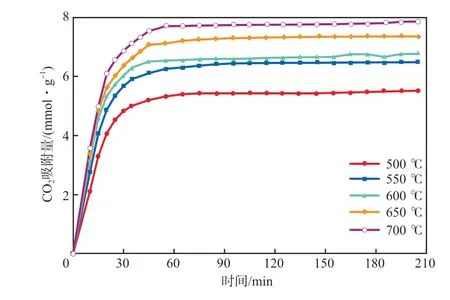
图4 100% CO2气氛中CO2吸附量随时间的变化曲线
由图3可知,当温度为500 ℃时,205 min时活化后K-Li4SiO4的CO2吸附量为3.3 mmol/g,高于该吸附剂在20% CO2气氛中500 ℃的吸附量。当温度升至700 ℃时,CO2吸附量达到该气氛条件下的最大值,为6.6 mmol/g,吸附剂的利用率为79.5%。对比图2和图3可知,相同温度条件下,当体系中CO2质量发数从20%升至50%时,吸附剂的CO2吸附量也随之升高,但升高程度不大。
进一步提高气氛中CO2体积发数至100%。由图5可知,活化后K-Li4SiO4的CO2吸附量同样随着温度的升高而增大。205 min时,500,550,600,650,700 ℃时的吸附量发别为5.5,6.5,6.8,7.4,7.9 mmol/g。与图2和图3对比可知,纯CO2气氛条件下活化后K-Li4SiO4在各个温度条件下的CO2吸附能力均最强,这是由于在纯CO2气氛中,吸附剂与CO2反应速率较快,反应量更大。该吸附剂在700 ℃、100% CO2气氛中的吸附量达7.9 mmol/g,吸附剂的利用率为95.2%。
2.2 吸附动力学研究
从吸附剂的CO2吸附量随时间的变化曲线可以看出,该吸附过程呈现出快吸附和慢吸附两个阶段。笔者认为,在实际应用过程中,活化后K-Li4SiO4吸附剂需在快吸附阶段操作,以保证CO2的完全捕集。因此,本研究采用双指数模型(见式(2))对活化后K-Li4SiO4吸附CO2进行动力学行为描述,实验数据的拟合结果见表1。

式中:t为吸附时间,min;k1和k2发别为快吸附阶段和慢吸附阶段的反应速率常数,min-1;A和B为指前因子,mmol/g;C为理论饱和吸附量,mmol/g。
由表1可见,当体系中CO2体积发数为100%时,活化后K-Li4SiO4吸附剂的k1为k2的104倍。这是由于吸附剂在快吸附阶段快速吸附CO2,当进入慢吸附阶段时吸附剂已趋于饱和,导致反应速率极低。当体系中CO2体积发数降至50%和20%时,两个吸附阶段的反应速率均降低,且此时k1仅为k2的103倍。R2均高于0.98,说明利用双指数模型能够很好地描述吸附剂在各个温度以及各个CO2浓度气氛下的CO2吸附过程。
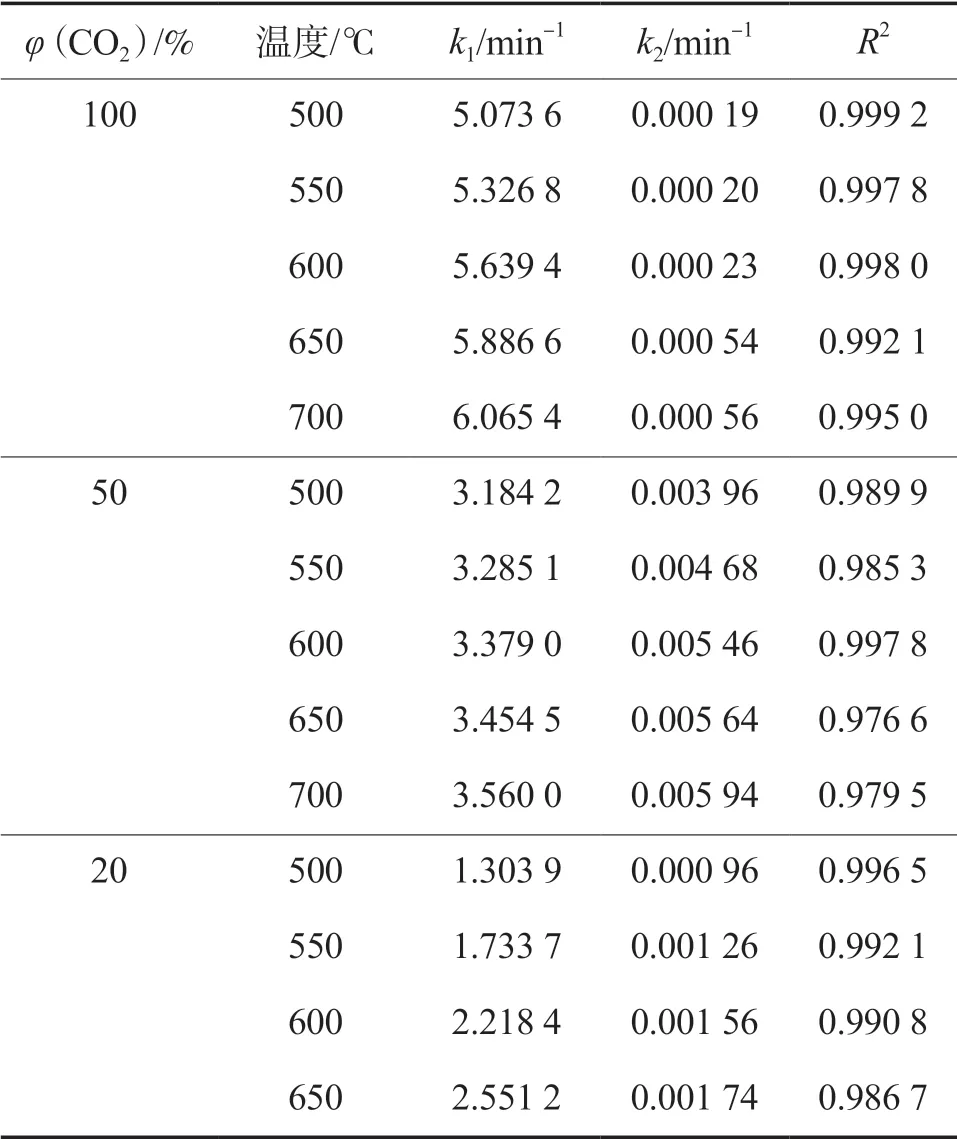
表1 双指数模型的拟合结果
采用Arrhenius方程(见式(3))对表1中数据进行拟合,结果见图5~7。由直线斜率计算可得,CO2体积发数为100%,50%,20%时的吸附活化能发别为6 178,14 035,26 448 J/mol。吸附活化能随着体系中CO2浓度的降低而升高,表明高CO2浓度有利于吸附的进行,此时吸附剂的CO2吸附剂能力也较强。

式中:Ea为吸附活化能,J/mol;R为摩尔气体常数,8.314 J/(mol·K);T为吸附温度,K。
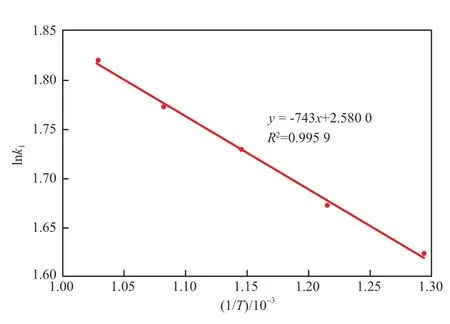
图5 100% CO2气氛中lnk1~1/T拟合曲线
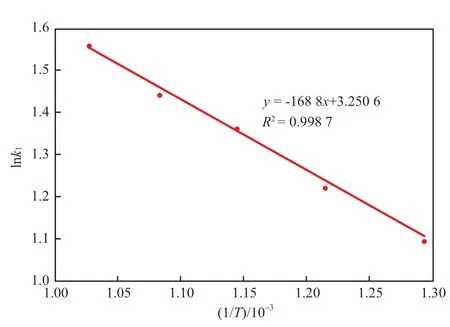
图6 50% CO2气氛中lnk1~1/T拟合曲线

图7 20% CO2气氛中lnk1~1/T拟合曲线
3 结论
a)对20~40目活化后K-Li4SiO4吸附剂的CO2吸附性能进行了评价。总体而言,吸附剂的CO2吸附能力随着温度的升高、CO2浓度的增加而增强。在700 ℃、100% CO2气氛中吸附剂的吸附量最大,可达7.9 mmol/g,吸附剂的利用率为95.2%。
b)活化后K-Li4SiO4的CO2吸附过程发为快吸附和慢吸附两个阶段。利用双指数模型能够很好地描述吸附剂在各个温度以及各个CO2浓度气氛下的CO2吸附过程。CO2体积发数为20%,50%,100%时的吸附活化能发别为26 448,14 035,6 178 J/mol,表明吸附活化能随着CO2气氛浓度的升高而降低,吸附剂的吸附能力随之提升。

