妊娠期代谢综合征患者同型半胱氨酸等指标的变化及相关性研究
李霞 周伟伟
妊娠期代谢综合征(gestational metabolic syndrome,GMS)是妊娠期发生的超重或肥胖、糖尿病或胰岛素抵抗、脂代谢异常、血压升高等多重代谢异常聚集的一组症候群[1],特点为全身慢性低度炎症状态,常导致妊娠不良结局。目前研究认为,促炎因子与抗炎因子失衡导致的慢性低度炎症状态是GMS发病的重要机制之一。同型半胱氨酸(homocysteine,Hcy)作为致炎因子,越来越受到重视,它可通过细胞免疫途径,上调促炎因子的表达,下调抗炎细胞因子的表达[2-3]。本研究通过探讨GMS患者Hcy等指标的变化及相关性,以期为GMS患者的临床干预和健康指导提供依据。
1 对象和方法
1.1 对象 选取2015年5月至2017年11月在本院定期产检并住院分娩的GMS孕妇60例作为GMS组,选取同期健康妊娠孕妇60例作为对照组。两组孕妇年龄、孕周、身高、孕前体质量、孕前体重指数(BMI)比较差异均无统计学意义(均P>0.05),见表1。GMS诊断标准:(1)孕前体质量超重/肥胖,BMI≥25kg/m2;(2)血糖升高,诊断为妊娠期糖尿病;(3)妊娠期高血压:血压≥140/90mmHg;(4)妊娠期脂代谢异常,甘油三酯(TG)≥3.23mmol/L;具备3项及其以上即可诊断为GMS。纳入标准:(1)符合 GMS诊断标准;(2)均为单胎、头位妊娠的产妇。排除标准:(1)妊娠前合并代谢综合征、高血压、糖尿病、心血管疾病、甲状腺疾病、血液病和多囊卵巢综合征者,妊娠期感染、多胎妊娠者;(2)妊娠期合并严重心、脑、肝、肾功能不全。本研究经医院医学伦理委员会审批通过和患者知情同意。
1.2 方法 参照孕产期保健手册,采集受试者基本信息,包括年龄、孕周、身高、孕前体质量、孕前BMI。根据孕24~28周糖耐量试验结果、整个孕期产检血压值、整个孕期的TG值判断是否存在妊娠期糖尿病、妊娠期高血压、高脂血症。晚孕期临近分娩前(36+1~41+6周,以下简称分娩前)孕妇入院后测量分娩前体质量、收缩压和舒张压,计算分娩前BMI;同时采肘静脉血5ml,3 500r/min离心10min分离血清,使用生化仪(AU5841,美国贝克曼库尔特公司)测定TG、低密度脂蛋白胆固醇(LDLC)、高密度脂蛋白胆固醇(HDL-C)、空腹血糖(FPG)和Hcy水平。
1.3 统计学处理 采用SPSS 17.0统计软件。计量资料以表示,组间比较采用两独立样本t检验;采用Pearson相关分析Hcy与各指标的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 两组孕妇体质量及其变化比较 两组孕妇孕前体质量及孕前BMI比较差异均无统计学意义(均P>0.05),两组孕妇分娩前体质量及分娩前BMI比较差异均有统计学意义(均P<0.05),且GMS组孕妇妊娠期体质量增加明显(P<0.05),见表2。
2.2 两组孕妇分娩前血压及代谢性指标比较 GMS组孕妇收缩压、舒张压、FPG、TG、LDL-C、Hcy水平均明显高于对照组,差异均有统计学意义(均P<0.05);两组孕妇HDL-C水平比较差异无统计学意义(P>0.05),见表3。
2.3 Hcy与各指标相关性分析 Hcy与收缩压、舒张压、FPG、TG 均呈正相关(r=0.35、0.30、0.25、0.33,均 P<0.05),与 HDL-C 呈负相关(r=-0.23,P<0.05),与 LDL-C无相关性(r=0.15,P >0.05)。
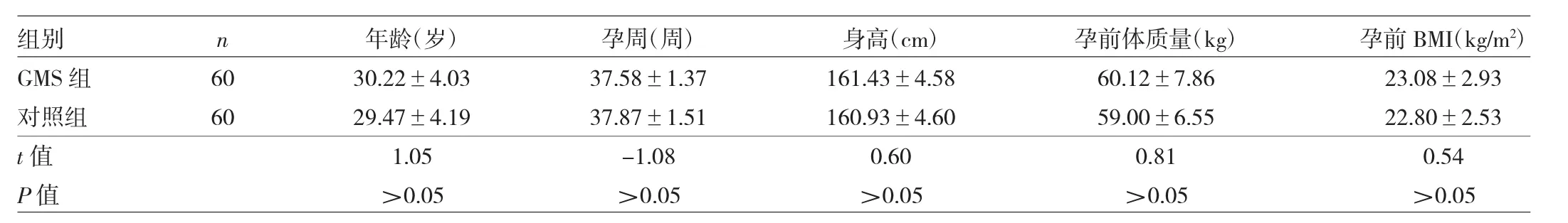
表1 两组孕妇基本资料比较
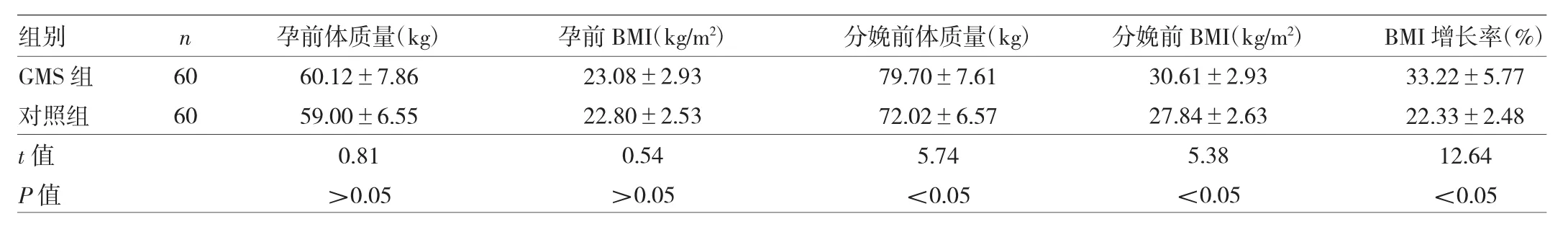
表2 两组孕妇体质量及其变化比较

表3 两组孕妇分娩前血压及代谢性指标比较
3 讨论
近年来,随着我国经济水平的增长,国民饮食结构发生巨大改变,促使代谢综合征的发病率也明显增加。Guo等[4]研究表明,我国代谢综合征患病率约为26.5%,其中女性发病更高。妊娠的生理状态如一定程度的胰岛素抵抗、脂肪组织的堆积、全身低度炎症状态等,可进一步促使其向代谢综合征方向发展,这些因素共同决定了GMS发病率远高于26.5%[5]。目前研究已证实,与健康妊娠孕妇相比,GMS孕妇早产率明显增高[6-7]。在GMS组成成分中,血压升高对早产率增加作用尤为明显,舒张压每增加10mmHg,早产风险增加高达29%[6,8]。此外,GMS亦可增加远期糖尿病和心血管疾病的发生风险。
Hcy是蛋氨酸循环中重要的产物,可由S-腺苷同型半胱氨酸甲基化后脱腺苷形成[9-10],以二价或二聚体形式与血浆蛋白以及其他硫醇化合物结合形式存在,极少数以游离形式存在。Hcy可以通过再甲基蛋氨酸循环清除,甲基四氢叶酸提供的一碳单位是其限速步骤[10]。妊娠期间Hcy水平升高与自然流产、胎儿宫内发育迟缓、神经管缺陷和先兆子痫发生率增加有关。Hcy水平不仅受代谢酶等遗传因素的影响,还受营养状况、药物、年龄等因素的影响,而妊娠是Hcy水平特异性降低的唯一相关因素。
目前关于代谢综合征与Hcy的相关性研究尚存争议。岑孟君等[2]报道Hcy与高血压、糖尿病等发病高度相关,已成为心脑血管疾病的危险因素及预测指标。Sung等[11]研究发现高Hcy血症可增加机体氧化应激状态、加剧代谢紊乱,但多变量调整后未见明显统计学差异。本研究中GMS孕妇Hcy水平高于健康妊娠孕妇。分析其可能原因:本研究中GMS孕妇妊娠期体质量增加明显,肥胖会导致氧化状态失衡和高Hcy血症;高Hcy血症可增加肥胖相关的氧化应激状态和代谢紊乱,进而形成恶性循环,共同促进GMS的发生,这与Wang等[12]研究基本一致。但Abedini等[13]研究发现,Hcy与代谢综合征无相关性。分析差异可能原因:首先,研究人群不同,Hcy受年龄、种族和性别等因素的影响,中国与其他国家相比血清Hcy水平更高。其次,本研究仅对Hcy水平作横断面研究,Hcy水平变化的机制仍需进一步研究。
本研究发现与健康妊娠孕妇相比,GMS孕妇血压、血脂水平较高,且Hcy与血压、TG均呈正相关。分析其可能原因:Hcy可以促进脂蛋白的自身氧化,引起血管平滑肌内钙离子浓度增加,导致血管收缩,最终引起血压升高。此外,Hcy与脂蛋白结合后,损伤血管基质层,导致血管硬化[14],这可能是高Hcy诱导血压升高的另一机制。因此,Hcy可能通过调节脂代谢、调节血压等多环节,参与GMS的病理生理过程。
Hcy在糖代谢过程中的作用机制尚不明确。目前研究表明高Hcy血症可进一步诱导胰岛素抵抗,导致其恶化;胰岛素抵抗引起的血管损伤,血管内皮功能障碍,可造成肾小球滤过功能降低,最终引起Hcy排泄率下降[10,15],形成恶性循环,协同促进GMS的发生、发展。结合本研究,与健康妊娠孕妇相比,GMS孕妇FPG较高,且Hcy与FPG呈正相关。因此,Hcy作为糖代谢的危险因素,在临床医师指导GMS患者健康管理方面有重要意义。
综上所述,本研究发现GMS孕妇Hcy水平明显升高,Hcy可能通过调节血压、血脂、血糖等代谢过程,参与GMS的病理生理过程。GMS孕妇Hcy水平较健康妊娠孕妇明显提高,有助于指导临床工作,对GMS孕妇的诊治具有重要意义。此外,Hcy水平受多方面因素的影响,本研究仅为横断面研究,所得结果的意义较为局限,Hcy水平变化的机制仍需进一步研究。

