不同密度胸腺囊肿CT表现差异及其病理基础
邱立艳,金中高,贾秀鹏,胡碧波,金银华,郑建军
(1.中国科学院大学宁波华美医院 宁波市第二医院 放射科,浙江 宁波 315010;2.宁波市第七医院 放射科,浙江 宁波 315010;3.宁波市临床病理诊断中心,浙江 宁波 315021)
胸腺囊肿占纵隔占位性病变的1%~3%,易误诊为胸腺肿瘤[1-2]。ACKMAN等[3]统计,在不必要胸腺切除术的高发生率及原因中,胸腺囊肿占24.3%(17/70)。本研究回顾性分析经手术病理证实的45例实性密度胸腺囊肿和23例液性密度胸腺囊肿,探讨其影像学表现差异及其病理改变,以提高对本病的认识。
1 资料和方法
1.1 一般资料 将2016年3月至2018年10月经中国科学院大学宁波华美医院手术病理证实的胸腺囊肿共68例纳入研究,其中男42例,女26例,年龄29~75(45.8±2.8)岁。35 例因呼吸系统症状咳 嗽、咳痰、胸痛等就诊时检查发现,33例为其他原因在我院住院诊治行胸部检查或体检期间行影像学检查发现并手术的胸腺偶发结节患者。患者均无重症肌无力症状。所有患者检查前均签署知情同意书。
1.2 检查方法 所有患者均行CT平扫+增强扫描。采用Philips Brilliance 16层螺旋CT或Siemens 64双源CT,使用非离子对比剂欧乃派克或碘帕醇,剂量1.5 mL/kg,先行平扫,扫描层厚5 mm,然后经肘静脉注入造影剂,注射流率2.6~3.0 mL/s,双期扫描时间窗分别为25~30 s、65~80 s,扫描层厚5 mm。将扫描原始数据传至工作站进行MPR重建(冠状位及矢状位)。取病灶横断中心层面,测量病灶内任意3 点CT值,取平均值视为病灶密度。CT值≤20 Hu设为液性密度组,CT值>20 Hu设为实性密度组。分析病灶大小、形状、平扫和增强后CT值变化、强化均匀度、边界、有无钙化、结节与胸腺轮廓边缘情况,并请高年资病理医师复习切片。
1.3 统计学处理方法 采用SPSS19.0统计学软件进行数据分析。计量资料以表示,计数资料比较采用χ2检验,如样本量过小,近似值无效时,用Fisher精确检验。P<0.05为差异有统计学意义。
2 结果
本组68例患者中,所有病例均位于前纵隔,单房,边界清晰,内容物无明显强化,囊壁薄或不可见,偶可见薄环状强化,环壁均匀连续。68 例中,仅有2例≤3 cm的实性密度囊肿边缘见少许斑点状钙化,≤3 cm囊肿占70.6%。在45例实性密度囊肿 中,≤3 cm囊肿43例(占95.6%),而在23例液性密度囊肿中,≤3 cm囊肿5例(占21.7%),胸腺囊肿密度与囊肿大小的分布有关(χ2=39.947,P<0.01)。本组实性密度囊肿形态多较规则(37/45),液性密度囊肿以不规则、沿大血管间隙塑形(16/23)多见,2组形态学差异有统计学意义(χ2=45.151,P<0.001);再行两两校正χ2检验,规则与不规则(或塑形)形态组间分布差异有统计学意义(P<0.01)。泪滴状及三角状在两者均可见,组间分布差异无统计学意义(P>0.05)。本组实性密度囊肿有93.3%(42/45)病灶未见膨隆于胸腺轮廓外,与胸腺边缘无接触,平直或出现直边征、尖角征等,45例中仅3例轻微膨隆;而液性密度囊肿则有17例膨隆于胸腺轮廓,差异有统计学意义(χ2=33.152,P<0.01)。68例中5例切片信息丢失,其中实性密度囊肿3例,液性密度囊肿2例。对63例胸腺囊肿病理分析示:实性密度囊肿共42例,多被覆假复层纤毛柱状上皮或复层纤毛上皮30例;液性密度囊肿共21例,多被覆单层上皮15例。见图1-2。
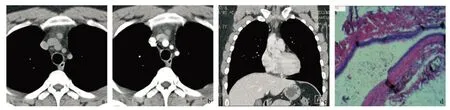
图1 实性密度囊肿CT及病理图像
3 讨论
GRAEBER等[4]将胸腺囊肿分为:①先天性胸腺囊肿,因胸腺导管或胸腺咽导管未闭合,导管上皮渗液或出血,逐渐扩张而成;②瘤性胸腺囊肿,由胸腺内哈氏小体退行性变或坏死而形成非感染性囊肿;③退行性胸腺囊肿,由胸骨正中切开、心脏手术及霍奇金病化疗后引起胸腺退行性变而形成。胸腺囊肿生长缓慢,无明显临床症状,多为体检发现。文献报道13%~40%的患者有症状[5-6]。其他症状如胸闷、胸痛、吞咽困难等多与囊肿内出血、炎症、局部压迫邻近脏器有关,无特异性。合并重症肌无力的胸腺囊肿极少,一般为0~3%[7]。本组无合并重症肌无力病例。
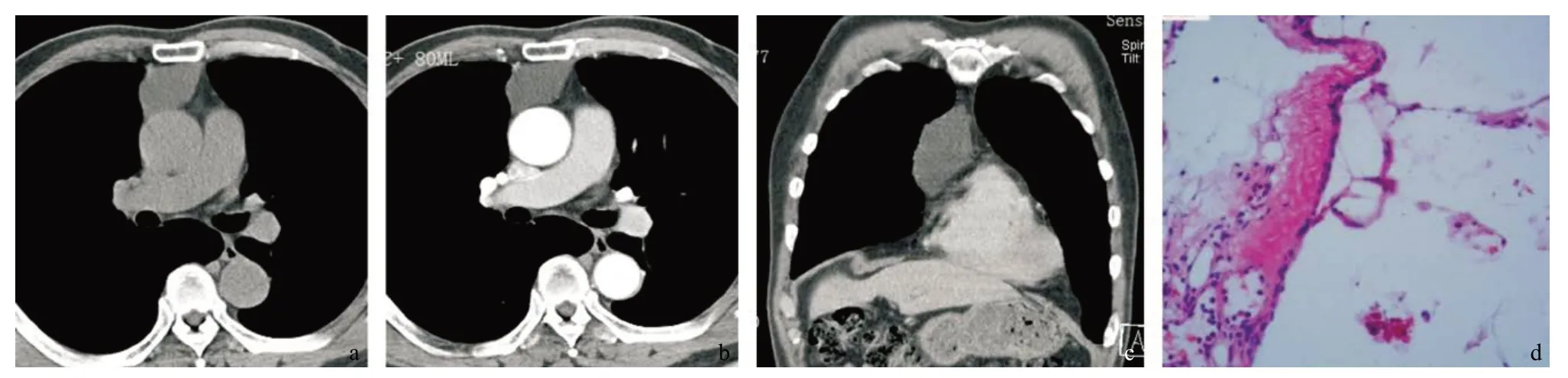
图2 液性密度囊肿CT及病理图像
以往有关胸腺囊肿的文献[8]提到,胸腺囊肿发生多位于前上纵隔,偶可见于心膈角区。形态多为圆形、类圆形、椭圆形、不规则分叶等。密度可为水样密度及软组织密度。单房多见,多房偶见,多房者多伴有感染,囊液胶冻状,囊壁周围可见多核巨细胞及炎症细胞浸润。单房胸腺囊肿可能与自身免疫性疾病无关,多房胸腺囊肿偶尔为自身免疫性疾病受累表现,包括干燥综合征、类风湿关节炎和重症肌无力,被认为是与自身免疫性疾病相关的胸腺局灶病变[9-11]。
病理上,≤3 cm胸腺囊肿形态多规则,可发生溃疡、出血、炎性反应,而从胸腺囊肿的起因来看,先天性胸腺囊肿和瘤性胸腺囊肿的囊内容物多浑浊或胶冻样。本研究中63例病理切片,多数实性密度囊肿囊壁被覆上皮为有分泌功能的假复层纤毛柱状上皮或纤毛柱状上皮,细胞排列较密,基层相对较厚,而液性密度囊肿壁为单层柱状或扁平上皮,上皮细胞排列较疏松,基层薄;其中有1例大小为 19 mm×22 mm×43 mm囊肿,CT值为38~45 Hu,囊壁上皮可见单层-假复层上皮移行延伸排列,故笔者推测:随着囊肿增大,假复层纤毛上皮或纤毛柱状上皮逐渐退变成无分泌功能的单层扁平上皮或柱状上皮,排列稀疏甚至缺失,基层薄弱,囊液变淡黄色、较清亮,同时由于囊液体积增大、囊壁变得更为纤薄,其形态也发生了改变,由圆形或椭圆形变得更易塑形生长。另外,笔者复习气道黏膜上皮细胞类型发现,随着气道分支变细,假复层纤毛柱状上皮逐渐减少,至呼吸性细支气管,其起始部为单层柱状纤毛上皮,而后即由无纤毛的立方上皮细胞及部分有纤毛的立方上皮细胞构成。到了肺泡管处,被覆上皮为单层扁平或立方上皮。可见,气道上皮病理类型的演变过程也为本文胸腺囊肿衬覆上皮退变过程的推测提供了依据。
对2组不同密度的囊肿在大小、形态及是否膨隆于胸腺轮廓方面的分布差异进行了研究。依据统计学分析,实性密度结节往往≤3 cm,其内囊液较浑浊,CT值>20 Hu,形态以规则的圆形或椭圆形居多,病灶边缘平直或出现尖角征,或与胸腺边缘未接触;而液性密度结节以3 cm以上居多,其内囊液清亮,CT值≤20 Hu,形态不规则或塑形生长,边缘常膨隆于胸腺轮廓外。在影像表现上,除了本研究提及的一些征象,有学者认为不同时期CT扫描囊肿形态改变为其特征,顾文江等[12]对5例胸腺囊肿(均>3 cm)进行CT增强扫描,多期扫描时其外形均有不同程度改变,认为胸腺囊肿随深呼吸时纵隔形态的改变而变形一致[8,12]。该征象需要扫描前呼吸训练和扫描过程中良好的呼吸运动配合,对≤3 cm 的囊肿可能存在不足,待深入验证。
JIN等[13]对MSCT在<3 cm的高密度胸腺囊肿和胸腺瘤的表现进行研究发现,纵隔肿块呈三角形或泪滴形、纵隔-肺边界呈直线,更容易诊断为胸腺囊肿,而结节-肺边界凸出者更容易诊断为胸腺瘤。MRI扫描检查是胸腺囊肿CT诊断很好的补充手段。本研究中有2 例同时行MRI增强扫描检查,表现为T2WI序列上高亮的异常信号,T1WI序列上信号视囊液成分而定,囊液清亮,则T1WI序列呈低于肌肉组织的低信号改变,如伴有出血、感染等,囊液则变浑浊,信号混杂,高低不等,增强后无强化。
胸腺囊肿常易误诊为胸腺瘤,导致患者接受不必要的外科治疗[14]。误诊的原因主要是胸腺囊肿的密度大于囊肿,测量>20 Hu,这是一个传统的固体密度的定义,导致术前误诊为胸腺瘤[15]。不同CT值的胸腺囊肿影像学表现有差异,是基于两者病理基础的差异。认识两者的差异,有助于提高对本病的诊断水平。

