亚毒性浓度HNPG体外对X线照射人骨肉瘤Saos-2细胞 增殖抑制的增敏作用及机制
赵学正,高伟,唐保永,郑思化,李利军
(杭州市西溪医院 骨科,浙江 杭州 310023)
放疗是骨肉瘤综合治疗重要辅助治疗之一,术后和术前放疗的临床应用极大改善了骨肉瘤患者预后,然而目前使用的放疗增敏剂多是化疗药物,其发挥放疗的增敏作用的同时也表现出同化疗一样的不良反应,因此开发增敏作用强、不良反应小的新型放疗增敏剂便成为临床的研究热点之一[1]。 研究报道金雀异黄素(genstein,GEN)对放疗具有增敏效果,可显著提高放疗对肿瘤的治疗作用,而5-羟基-4’-硝基-7-丙酰氧基金雀异黄素(5-hydroxy-4’-nitro-7-propionyloxy-genistein,HNPG)是GEN的一种新型衍生物,在体外具有更强的抗肿瘤、抗氧化等作用[2-3],然而其对放疗是否有增敏作用尚未见报道。本研究通过检测亚毒性浓度HNPG对亚毒性剂量的X线照射骨肉瘤Saos-2细胞的增敏作用,并进一步探究其可能的分子生物学机制,为HNPG对骨肉瘤的临床治疗提供实验依据和理论基础。
1 材料和方法
1.1 细胞培养和实验试剂 人骨肉瘤Saos-2细胞购自中国科学院上海生科馆细胞资源中心,用含10%胎牛血清的DMEM培养基在37 ℃含5% CO2的饱和湿度的培养箱中进行培养。HNPG由第二军医大学生化实验室金永生教授合成赠送,分子式:C18H13O7N,相对分子质量:355,浅黄色粉末,纯度98%。所有照射均在室温下进行,采用医用直线加速器(Elekta Synergy,Elekta CompactTM,瑞典)照射,X线能量6 mV,剂量率6 Gy/min,源皮距SSD 100 cm,照射野10 cm×10 cm,于细胞上方加培养基至厚度为1.5 cm,使剂量建成在细胞层上,垂直照射。一抗bcl-2(A00040-1)、bax(A00183)、cyt-c(BA0774)、cleaved-caspase-3(BM3937)和GAPDH(A00227-1)购自美国BOSTER生物技术有限公司。超氧化物歧化酶(superoxide dismutase,SOD,A001-3)、过氧化氢酶(catalase,CAT,A007-1-1)、谷胱甘肽(glutathione,GSH,A006-1)、ROS(E004-1-1)和丙二醛(malondialdehyde,MDA,A003-4)测定试剂盒购自南京建成生物研究所。Annexin V-FITC细胞凋亡检测试剂盒(C0162)和线粒体膜电位检测试剂盒(C2006)购自上海碧云天生物公司。
1.2 MTT法检测亚毒性浓度HNPG对X线照射Saos-2细胞增殖抑制的增敏作用 取对数期生长的Saos-2细胞,以5 000/孔的密度种植在96孔培养板上,培养24 h待细胞完全贴壁后,每孔添加不同浓度的HNPG(0.5、1、2、4、8、16、32 μmol/L)作用骨肉瘤Saos-2细胞24 h,检测其对Saos-2细胞的增殖抑制作用,获取其亚毒性生物活性浓度并用于后续实 验。同样取另一组Saos-2细胞,每孔添加不同强度的X线(0.5、1、2、4、8、16、32 Gy)照射骨肉瘤Saos-2细胞24 h,检测其对Saos-2细胞的增殖抑制作用,获取其24 h亚毒性抑制强度并用于后续实验。取亚毒性浓度2 μmol/L HNPG、亚毒性放射剂量1 Gy X线、2 μmol/L HNPG+1 Gy X线分别作用Saos-2细胞24 h,然后移除培养液,添加5 mg/L MTT继续培养 4 h,移除MTT混悬液,添加100 μL DMSO,570 nm检测光密度(型号:ELX-800 type)。细胞增殖抑制率(IR)=(1-实验组A均值/空白对照组A均值)×100%。以上实验重复3次。分别记为HNPG组,X线组,HNPG+ X线组。以0.9%氯化钠溶液作用为对照(NS组)。
1.3 AV/PI染色流式细胞术(flow cytometry,FCM) 检测亚毒性浓度HNPG对X线照射Saos-2细胞凋亡的增敏作用 取对数期生长的Saos-2细胞,培养24 h后完全贴壁后,更换培养基,用2 μmol/L HNPG、 1 Gy X线、2 μmol/L HNPG+1 Gy X线分别作用Saos-2细胞24 h,弃去培养基,用PBS清洗2遍,用0.25%的胰酶消化细胞并吹打成单个细胞悬液,以2 000 r/min离心5 min,弃上清液保留细胞沉淀,分别使用1 mL的50 mmol AV和PI溶液混悬细胞,于37 ℃避光孵育30 min,再用无血清的DMEM溶液洗涤细胞3次,用流式细胞仪进行检测AV-PI荧光强度,激发波488 nm和发射波530 nm。实验重复3次,取平均值进行统计分析。
1.4 Rh123染色FCM法检测亚毒性浓度HNPG对X线照射Saos-2细胞线粒体膜电位调控的增敏作用 取对数期生长的Saos-2 细胞,培养24 h后完全贴壁后,更换培养基,用2 μmol/L HNPG、1 Gy X线、 2 μmol/L HNPG+1 Gy X线分别作用Saos-2细胞24 h, 弃去培养基,用PBS清洗2遍,用0.25%的胰酶消化细胞并吹打成单个细胞悬液,以2 000 r/min离心5 min,弃上清液保留细胞沉淀,用500 μL Rh123溶液(终浓度为5 μg/mL)混悬细胞,于37 ℃避光孵育30 min,再用无血清的DMEM溶液洗涤细胞3次,再用PBS洗涤细胞2次,用40 μm的滤网过滤细胞。用流式细胞仪进行检测Rh123 荧光强度,激发波 475 nm和发射波525 nm。实验重复3次,取平均值进行统计分析。
1.5 DCFH-DA染色FCM法检测亚毒性浓度HNPG对X线照射Saos-2细胞活性氧调节的增敏作用 取对数期生长的Saos-2细胞,培养24 h后完全贴壁后,更换培养基,用2 μmol/L HNPG、1 Gy X线、2 μmol/L HNPG+1 Gy X线分别作用Saos-2细胞24 h,弃去培养基,用PBS清洗2遍,用0.25%的胰酶消化细胞并吹打成单个细胞悬液,以2 000 r/min离心5 min,弃上清液保留细胞沉淀,用1 mL的50 mmol DCFHDA溶液混悬细胞,于37 ℃避光孵育30 min,再用无血清的DMEM溶液洗涤细胞3次,除去未进入细胞内的DCFH-DA,用40 μm的滤网过滤细胞。用流式细胞仪进行检测DCFH-DA荧光强度,激发波488 nm和发射波530 nm。实验重复3次,取平均值进行统计分析。
1.6 ELISA法检测亚毒性浓度HNPG对X线照射Saos-2 细胞SOD、CAT、GSH和MDA调节的增敏作用
取对数期生长的Saos-2细胞,培养24 h后完全贴壁后,更换培养基,用2 μmol/L HNPG、1 Gy X线、2 μmol/L HNPG+1 Gy X线分别作用Saos-2细胞24 h, 用0.25%的胰酶消化细胞并吹打成单个细胞悬液,以800 r/min离心5 min,弃上清液保留细胞沉淀,用冰PBS混悬细胞,再以800 r/min离心5 min,弃上清液保留细胞沉淀,加入细胞裂解液,冰上裂解 30 min,12 000 r/min、4 ℃离心10 min,取上清液,采用BCA蛋白定量试剂盒进行蛋白密度测定。按照SOD、CAT、GSH和MDA试剂盒说明书分别在550 nm、405 nm、420 nm和532 nm处对SOD和CAT活力进行测试,对GSH和MDA含量进行测试。实验重复3次,取平均值进行统计分析。
1.7 Western blot法检测亚毒性浓度HNPG对X线照射Saos-2细胞凋亡相关蛋白调节的增敏作用 取对数期生长的Saos-2细胞,培养24 h后完全贴壁后,更换培养基,用HNPG 2 μmol/L、X线1 Gy、HNPG 2 μmol/L+X线1 Gy分别作用Saos-2细胞24 h,用冰PBS洗3次,加入细胞裂解液提取蛋白,用BCA蛋白定量试剂盒测定蛋白浓度,取30 μg样品用SDSPAGE电泳分离,然后将蛋白转移至PVDF膜上,再用5%脱脂牛奶-TBST室温摇床封闭2 h,一抗于37 ℃温育3 h,二抗于37 ℃温育1 h,ECL发光剂激发荧光,压片显影定影。结果用灰度扫描仪处理分析。
1.8 统计学处理方法 采用SPSS18.0软件对实验数据分析。正态分布的计量资料以表示,2组比较采用t检验,多组比较用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 亚毒性浓度HNPG对X线照射Saos-2细胞增殖抑制的增敏作用 取不同浓度的HNPG(0.5、1、2、4、 8、16、32 μmol/L)作用骨肉瘤Saos-2细胞24 h,发现HNPG对细胞的增殖抑制呈浓度依赖性,其中在2 μmol/L浓度以下,HNPG对细胞的作用处于亚毒性范围之内,抑制率均小于15%,见图1A。取不同照射强度X线(0.5、1、2、4、8、16、32 Gy)的X线,发现X线对细胞的毒性呈强度依赖性,其中在1 Gy强度下,细胞呈亚毒性,细胞的抑制率均小于15%,见图1B。取2 μmol/L HNPG联合1 Gy X线,发现细胞的增殖抑制率显著提高,分别与HNPG组或X线组比较,差异有统计学意义(P<0.05),而HNPG组和X线组比较,组间差异无统计学意义(P>0.05)。见图1C。
2.2 亚毒性浓度HNPG对X线照射Saos-2细胞凋亡的增敏作用 取对数期生长的Saos-2 细胞,分别予以2 μmol/L HNPG、1 Gy X线和2 μmol/L HNPG+ 1 Gy X线持续培养24 h后,用FCM检测发现Saos-2细胞出现不同程度的凋亡,凋亡率分别为10.60%± 0.87%、9.49%±0.69%、50.37%±4.13%,较NS组(0.1%±0.01%)显著升高,差异有统计学意义(P<0.05)。HNPG+X线组与HNPG组和X线组比,凋亡率显著升高,差异有统计学意义(P<0.05)。HNPG组和X线组凋亡率差异无统计学意义(P>0.05)。提示HNPG对X线照射Saos-2细胞有显著的增敏作用,见图2。
2.3 亚毒性浓度HNPG对X线照射Saos-2细胞活性氧调控的增敏作用 取对数期生长的Saos-2细胞,分别予以2 μmol/L HNPG、1 Gy X线和2 μmol/L HNPG+1 Gy X线持续培养24 h后,用FCM检测发现Saos-2细胞DCFH-DA荧光强度出现不同程度的增强,荧光强度分别为1.51±0.11、1.28±0.10、8.12± 0.64,较NS组(0.78±0.06)显著升高,差异有统计学意义(P<0.05)。HNPG+X线组荧光强度与HNPG组和X线组比显著升高,差异有统计学意义(P<0.05);HNPG组与X线组细胞荧光强度相当,组间差异无统计学意义(P>0.05)。见图3。
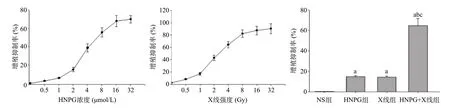
图1 亚毒性浓度HNPG对X线照射骨肉瘤Saos-2细胞增殖抑制的增敏作用

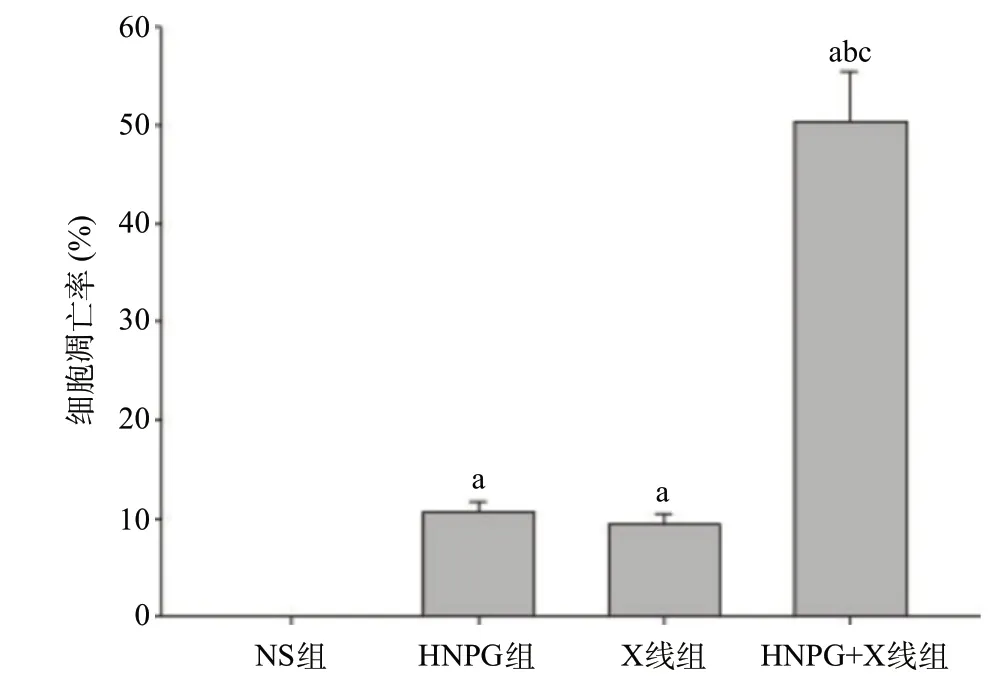
图2 亚毒性浓度HNPG对X线照射骨肉瘤Saos-2细胞诱导凋亡的增敏作用
2.4 亚毒性HNPG对X线照射Saos-2细胞线粒体膜电位调控的增敏作用 取对数期生长的Saos-2细胞,分别予以2 μmol/L HNPG、1 Gy X线和2 μmol/L HNPG+1 Gy X线持续培养24 h后,用FCM检测发现Saos-2细胞平均Rh123荧光强度分别为6.16±0.42、6.67±0.48、1.18±0.08,与NS组(7.25±0.56)比显著降低,差异有统计学意义(P<0.05)。HNPG+X线组荧光强度与HNPG组和X线组比显著降低,差异有统计学意义(P<0.05)。HNPG组和X线组平均Rh123荧光强度比较,差异无统计学意义(P>0.05),见图4。
2.5 亚毒性HNPG对X线照射Saos-2细胞调节SOD、CAT、GSH和MDA表达的增敏作用 取对数期生长的Saos-2细胞,分别予以2 μmol/L HNPG、1 Gy X线和2 μmol/L HNPG+1 Gy X线持续培养24 h后,分别用SOD、CAT、GSH和MDA试剂盒检测发现Saos-2细胞SOD和CAT活力出现不同程度的下降,GSH含量出现不同程度的降低,而MDA含量却出现不同程度的升高,与NS组比较差异有统计学意义(P<0.05)。HNPG+X线组与HNPG组和X线组比差异有统计学意义(P<0.05)。HNPG组和X线组SOD和CAT活力、GSH和MDA含量相当,差异无统计学意义(P>0.05)。见表1。
2.6 亚毒性浓度HNPG对X线照射Saos-2细胞调节线粒体凋亡途径相关蛋白的增敏作用 取对数期生长的Saos-2细胞,分别予以2 μmol/L HNPG、1 Gy X线和2 μmol/L HNPG+1 Gy X线持续培养24 h后,提取细胞蛋白并检测蛋白印迹平均相对灰度值,发现Saos-2细胞bcl-2蛋白表达呈浓度依赖性下调,与NS组间比较差异有统计学意义(P<0.05);而bax、cyt-c和cleaved-caspase-3蛋白表达却呈浓度依赖性上调,与NS组比较差异有统计学意义(P<0.05);HNPG+X线组与HNPG组和X线组比,差异均有统计学意义(P<0.05)。见图5。

图3 亚毒性浓度HNPG对X线照射骨肉瘤Saos-2细胞活性氧调节的增敏作用
3 讨论
目前针对骨肉瘤的治疗模式是以手术为主,化疗和放疗为辅,然而随着放疗技术的不断发展,尤其是新型放疗模式的变革,放疗效果显著提高,在很大程度上改善患者的生存质量和预后,这使放疗成为骨肉瘤最为重要的治疗方式之一[4]。临床上为了使放疗达到最佳的治疗效果,通常在放疗的基础上采用放疗增敏剂;增敏剂的应用,提高了放疗的治疗效果,减少了放疗剂量,减少了放疗的不良反应。但是,目前放疗增敏剂多系化疗药物,其依旧存在化疗的不良反应,并产生耐药性,严重限制了它们的临床应用,为此开发不良反应小,增敏效果强的新型放疗增敏剂,便成了临床研究的工作热点之一[5]。本研究检测亚毒性浓度HNPG对X线照射骨肉瘤Saos-2细胞增殖抑制的增敏作用,并进一步探讨其可能的分子生物学机制。
细胞内抗氧化酶系统包括SOD、CAT、GSH等,抗氧化酶系的存在对维持细胞内环境稳态起着至关重要的作用[6]。SOD在细胞内以超氧负离子自由基为底物,催化其发生歧化反应并生成无毒的氧或过氧化氢,直接对抗氧自由基和活性氧的抗氧化酶[7]; 而CAT能有效催化过氧化氢为无毒物质氧[8];GSH可以有效催化过氧化氢为无毒物质氧和水[9];SOD、CAT、GSH等共同构成了细胞内抗氧化的酶系统,因此测定SOD、CAT、GSH含量,可以间接体现机体对氧自由基和活性氧的清除能力[10]。细胞内的氧自由基或活性氧,可以攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化作用,并形成MDA等脂质过氧化物,因而测试MDA的量常常可反映机体内脂质过氧化的程度,间接地反映出细胞损伤的程度[11]。本研究发现,亚毒性浓度的HNPG和亚毒性剂量的X线联合处理Saos-2细胞后,细胞增殖抑制显著加强,凋亡现象明显增加,细胞内ROS累积增多,伴随着SOD和CAT生物活性降低,GSH含量降低,而MDA含量增高,提示亚毒性浓度的HNPG可以增敏X线对Saos-2细胞的放疗效果,其机制可能与其下调SOD、CAT、GSH表达,导致细胞内ROS不能被清除,进而引起线粒体磷脂膜受损密切相关。这与ARAVINDAN等[12]研究GEN增强放疗抑制乳腺癌细胞的效果和机制相似,提示GEN和它的新型衍生物HNPG均可增强肿瘤细胞放疗效果。
在线粒体的双层磷脂酶上有bcl-2和bax蛋白,它们共同构成的线粒体器膜转化孔,调节并保持线粒体内外电解质的平衡,并维持着线粒体膜内外存在一定的膜电压[13-14];一旦线粒体细胞器膜受损,引起bcl-2和bax蛋白表达失调,就会导致线粒体膜内外电解质调节障碍,引起线粒体膜电位下降,同时线粒体内物质外泄,而这些线粒体内的物质,诸如cyt-c等,一旦进入细胞质中,就会激活细胞质中半胱氨酸蛋白酶家族(caspase家族),最终激活凋亡效应蛋白cleaved-caspase-3产生并诱导细胞凋 亡[15-16]。本研究发现亚毒性浓度的HNPG和亚毒性剂量的X线联合处理Saos-2细胞后,细胞增殖抑制显著,凋亡现象明显,线粒体膜电位MMP降低,伴随着bcl-2 表达降低,而bax、cyt-c和cleaved- caspase-3蛋白表达增加,提示亚毒性浓度的HNPG在体外可增敏X线对Saos-2细胞增殖抑制作用,其机制可能与其诱发细胞内线粒体凋亡途径相关。这与SAHIN等[17]研究GEN增强放射治疗前列腺癌细胞的效果和机制相似,提示GEN和它的新型衍生物HNPG在体外均可增强肿瘤细胞放疗效果。
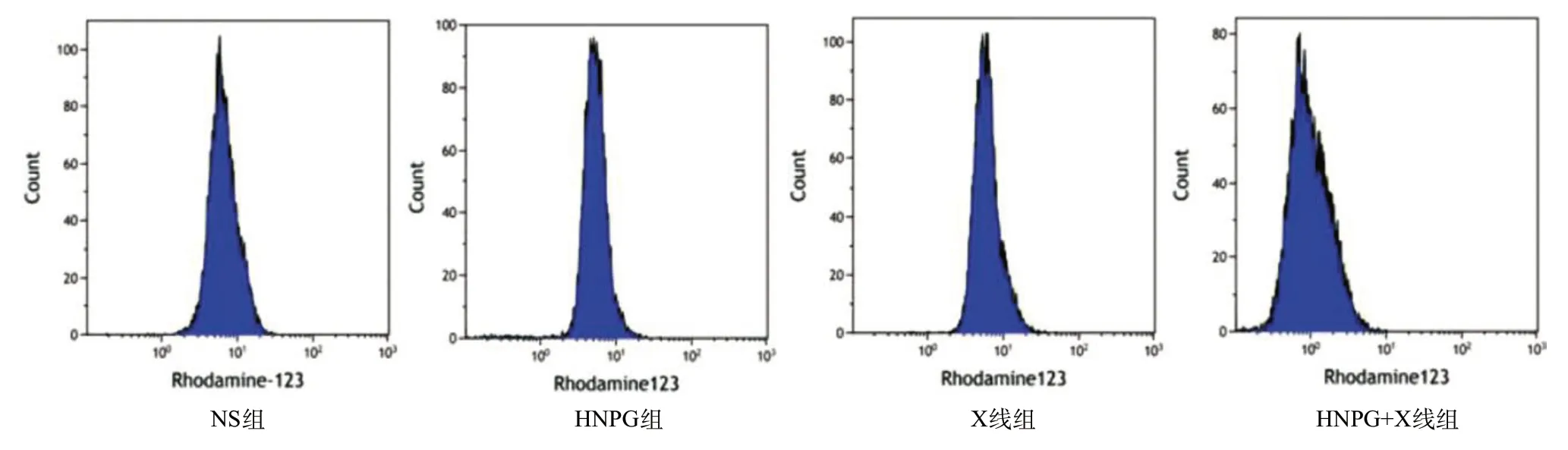
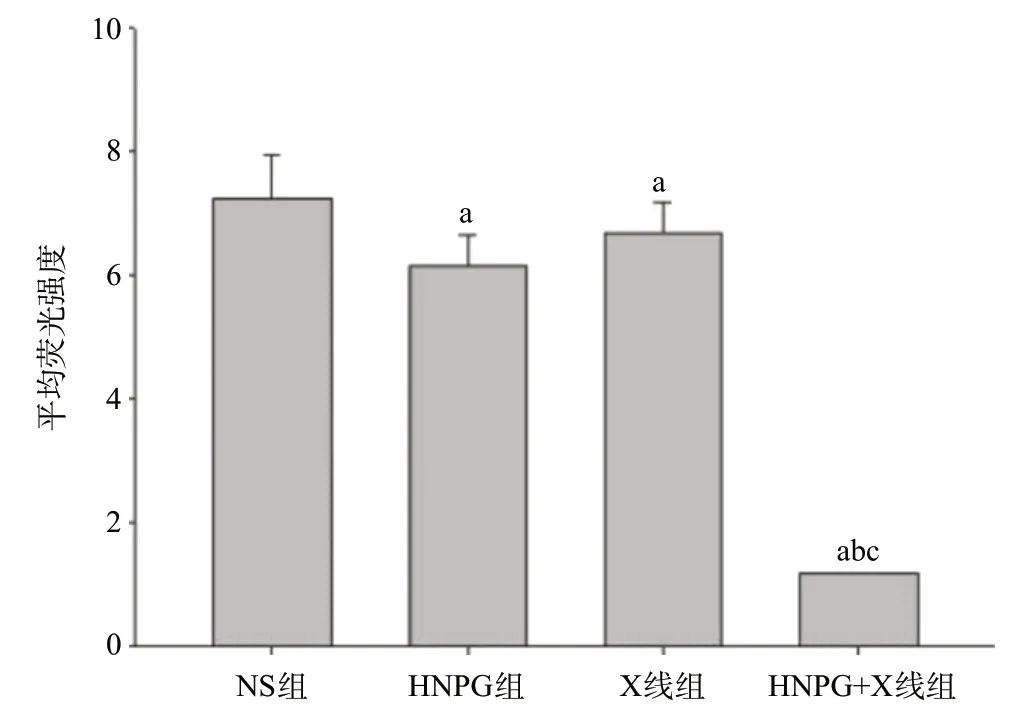
图4 亚毒性浓度HNPG对X线照射骨肉瘤Saos-2细胞线粒体膜电位调节的增敏作用
表1 亚毒性浓度HNPG对X线照射Saos-2细胞调节SOD、CAT、GSH和MDA表达的增敏作用(每组n=3,
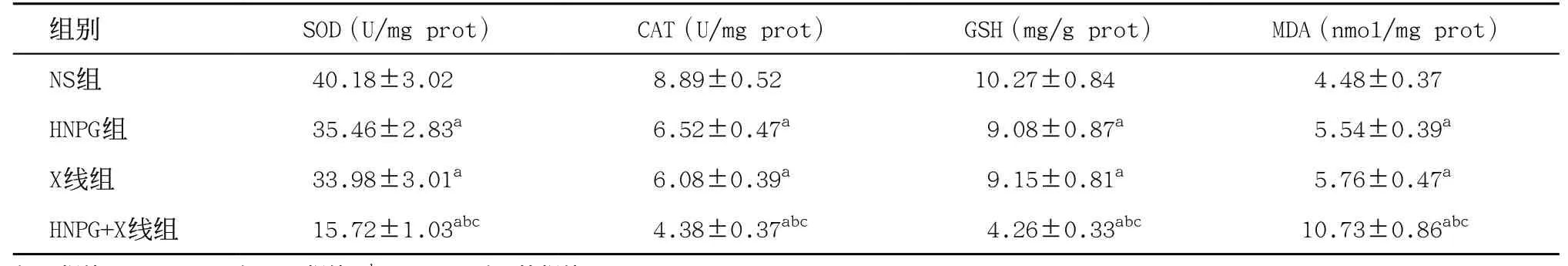
表1 亚毒性浓度HNPG对X线照射Saos-2细胞调节SOD、CAT、GSH和MDA表达的增敏作用(每组n=3,
与NS组比:aP<0.05;与HNPG组比:bP<0.05;与X线组比:cP<0.05
组别 SOD(U/mg prot) CAT(U/mg prot) GSH(mg/g prot) MDA(nmol/mg prot)NS组 40.18±3.02 8.89±0.52 10.27±0.84 4.48±0.37 HNPG组 35.46±2.83a 6.52±0.47a 9.08±0.87a 5.54±0.39a X线组 33.98±3.01a 6.08±0.39a 9.15±0.81a 5.76±0.47a HNPG+X线组 15.72±1.03abc 4.38±0.37abc 4.26±0.33abc 10.73±0.86abc
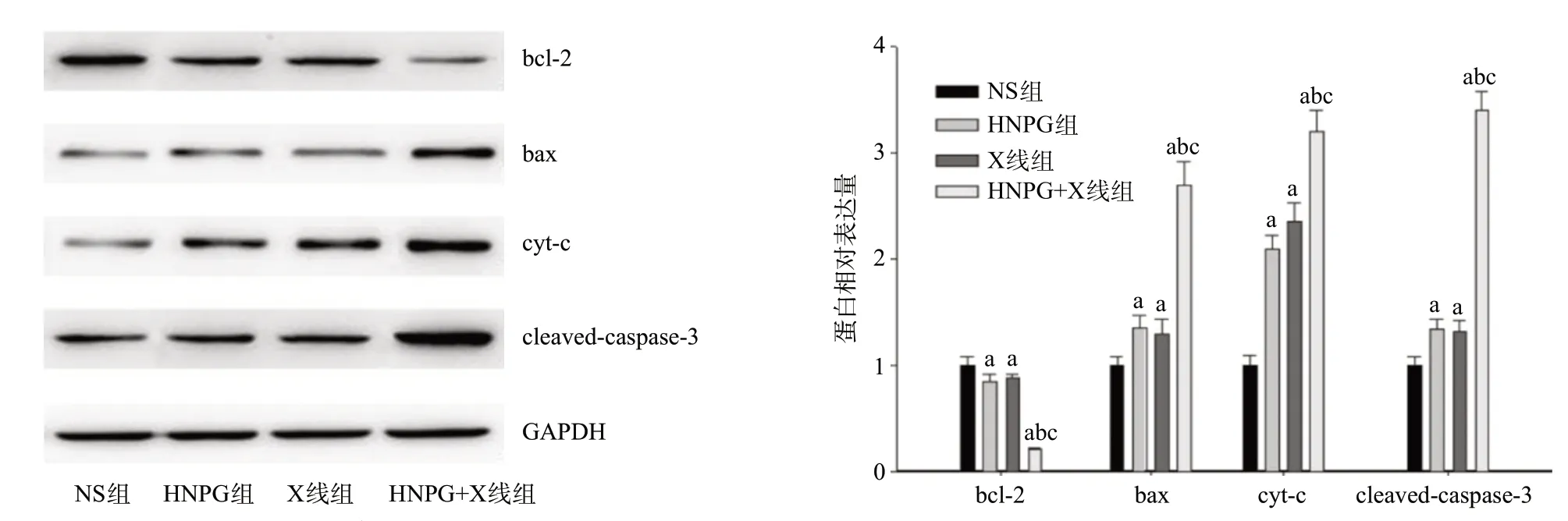
图5 亚毒性浓度HNPG对X线照射骨肉瘤Saos-2细胞调节凋亡相关蛋白表达的增敏作用
综上所述,亚毒性浓度的HNPG和亚毒性X线放射治疗剂量联合使用在体外对骨肉瘤Saos-2细胞展示的显著的细胞毒性,抑制细胞增殖和诱导其凋亡的作用显著提升,其分子生物学机制可能是与亚毒性浓度的HNPG促进X线下调细胞内SOD、CAT、GSH抗氧化的酶表达,降低其在肿瘤细胞内清除ROS的活性,导致细胞内ROS累积,进而损伤肿瘤细胞线粒体磷脂膜,降低细胞膜电位,引起线粒体功能紊乱,使cyt-c等诱发细胞凋亡的酶进入细胞质内,激活caspase酶链式反应,引起细胞凋亡所致。

