miR-144对甲状腺乳头状癌细胞增殖及细胞周期的影响
余明军,赵娜,王海明
(杭州市第三人民医院 普外科,浙江 杭州 310009)
甲状腺癌是最常见的内分泌恶性肿瘤,其中有约80%为甲状腺乳头状癌(papillary thyroid carcinoma,PTC)[1]。近年来,甲状腺癌的发病率仍在迅速增长,PTC的增长速度尤为可观,占所有女性肿瘤榜首,而在男性肿瘤中居第2位[2]。大部分PTC在手术切除结合碘131及甲状腺素治疗后可达到临床治愈,但仍存在5%的5年复发率[3]。目前PTC的发病机制仍不明确,寻找治疗和诊断PTC的小分子标志物对于提高其诊断率和治疗效果都具有重要意义。
miRNA是一类长为21~25个核苷酸片段的小分子非编码RNA,在癌症的发生发展中扮演着重要角色。研究表明,miR-144在肺癌、鼻咽癌、肝癌、肾 癌、胰腺癌、结直肠癌和胃癌等癌症中发挥抑癌基因的作用[4-6]。JAHANBANI等[7]检测了113例甲状腺组织(其中包含81例PTC)中84种miRNA的表达情况,证实miR-144在PTC组织中低表达。另一项细胞水平的研究证实,miR-144可以通过抑制肿瘤细胞自噬,提高甲状腺未分化癌对铂类的化疗敏感性[4]。目前尚未见有研究涉及miR-144对PTC细胞增殖能力及细胞周期的影响。本研究检测了PTC细胞及正常甲状腺细胞中miR-144的表达水平,研究miR-144对PTC细胞增殖能力、单克隆形成能力及细胞周期的影响,可以为PTC早期诊断、预测复发以及找寻新的治疗靶点提供新思路。
1 材料和方法
1.1 材料 人PTC细胞K1、TPC-1 和人甲状腺细胞Nthy-ori 3-1 均购自中国科学院上海细胞库。qPCR试剂盒购自上海欣百诺生物工程有限公司;RPMI1640 培养基和DMEM培养基、胎牛血清购自美国Gibco公司;miR-144 mimics、miR-144 inhibitor、NC mimics、NC inhibitor购自上海吉玛制药技术有限公司;脂质体LipofectamineTM2000购自美国Invitrogen公司;MTT溶液、DMSO溶液购自美国Sigma公司;流式周期检测试剂盒购自美国Sigma公司;兔抗人Anti-Cyclin D1购自美国Abcam公司,鼠抗人β-actin购自美国Epitomics公司;其他试剂均是国产分析纯。
1.2 方法
1.2.1 细胞培养:从液氮罐中取出人PTC细胞K1、TPC-1和人甲状腺细胞Nthy-ori 3-1,放置于37 ℃水浴锅中,快速晃动至冻存液完全融化,加入预热的完全培养基(含青霉素100 U/mL、链霉素100 μg/mL、 10% FBS的培养基,K1 细胞用DMEM培养,TPC-1和Nthy-ori 3-1细胞用RPMI1640培养),1 000 r/min离心5 min,弃上清液,加入完全培养基,置于培养箱(37 ℃,5% CO2,饱和湿度)中培养,次日更换培养液。定时观察细胞状态,当细胞融合至70%~90%时传代,加入胰蛋白酶(0.25%胰酶+0.02% EDTA)消化细胞2 min,小心吸去胰酶,加入新鲜完全培养基,用吸管吹打细胞成单细胞悬液,按1:3~1:2传代接种于培养瓶继续培养。
1.2.2 qPCR检测细胞中miR-144表达:取对数生长期的K1、TPC-1和Nthy-ori 3-1细胞,加入适量TRIozl细胞裂解液,反复抽吸吹打均匀,用无RNAase枪头将各孔液体分别转移到对应的1.5 mL无RNAase的EP 管中,静置5 min。加入100 μL氯仿,剧烈震荡15 s,室温静置5 min。4 ℃,12 000 r/min离心15 min。吸取水相层至新的EP管中,加入250 μL异丙醇,轻轻颠倒混匀,室温静置10 min。4 ℃,12 000 r/min 离心10 min沉淀RNA。弃上清液,加入500 μL预冷无水乙醇,震荡混匀。4 ℃,7 500 r/min离心 5 min,弃上清液。根据所用细胞数目,用30~50 μL DEPC水溶解沉淀。-80 ℃保存。用紫外分光光度计检测RNA的浓度及纯度,定量后用DEPC水将RNA稀释至500 ng/μL。按照反转录试剂盒说明书合成各组细胞miR-144的cDNA。按照RT-PCR试剂盒操作说明书扩增miR-144的cDNA。分析各组细胞中miR-144的表达水平。miR-144引物为:5’-CGGCGGTACAGTATAGA TGATG-3’;内参采用β-U6,引物为:正向:5’-CTCGC TTCGGCAGCACA-3’,反向:5’-AACGCTTCACGAATTTGCG T-3’。相对定量用2-△△CT法计算。
1.2.3 细胞转染:取对数生长期的K1细胞,消化收集细胞,接种于6孔细胞培养板中,调整初始细胞数为1.2×105,轻拍使细胞均匀分散,置于培养箱中培养。铺板24 h内,培养至细胞单层密度达到50%~60%时,按照LipofectamineTM2000脂质体转染试剂说明书提供的方法进行转染。实验分组为:阴性对照组(NC)、miR-144 mimics组和miR-144 inhibitor组。
1.2.4 MTT实验检测细胞增殖能力:转染NC、miR-144 mimics和miR-144 inhibitor 24 h后,收集各组细胞,接种于96 孔细胞培养板中,初始细胞数为1 500/孔,每组设置4 个复孔。设置24、48、72、96、120 h 5个时间点,分别进行检测。避光条件下,每孔加入MTT 溶液20 μL(5 mg/mL),孵育 4 h;终止培养,避光条件下,负压吸引器小心吸去上清,每孔加入150 μL DMSO溶液,摇床上低速震荡10 min,使结晶充分溶解。使用多功能酶联免疫检测仪检测各孔在490 nm波长的吸光度(OD值),计算平均值,绘制细胞增殖曲线。
1.2.5 克隆形成实验检测细胞单克隆形成能力:各组转染24 h后收集细胞,各组细胞按500个/孔接种于6孔板中,每组设置3个复孔,轻轻晃动6孔板使细胞分散均匀。每孔补足完全培养基至1.5 mL,在37 ℃、5% CO2细胞培养箱中培养7~10 d,每2~3 d更换新鲜培养基。当6孔板中出现肉眼可见的细胞克隆时终止培养。弃去培养液,用PBS小心冲洗2次。用95%乙醇固定10 min,通风处风干。0.1%结晶紫溶液染色20 min,自来水小心冲洗。风干后拍照。
1.2.6 流式细胞术检测细胞周期:各组转染48 h后,用0.25%无EDTA的胰酶消化收集各组细胞,用PBS重悬细胞置于10 mL流式离心管中,室温2 000 r/min 离心5 min。弃去上清液,每管加2 mL PBS混匀,再次室温2 000 r/min离心5 min。弃去上清液,回流约50 μL残留PBS,轻弹离心管使细胞重悬,每管加入预冷的75%乙醇,轻弹混匀,4 ℃固定过夜。每管加入400 μL 0.05 g/L PI(碘化丙啶),室温避光孵育30 min,混匀,流式细胞仪上机检测。
1.2.7 Western blot检测细胞周期蛋白Cyclin D1的表达:各组转染48 h后倒掉培养基,各孔用1 mL预冷PBS冲洗3 次,PBS弃净后将培养板放在冰上。每孔加入80~100 μL裂解液,震荡混匀,冰上裂解30 min。用干净的刮棒将细胞刮下,将细胞碎片和裂解液移至1.5 mL EP管中,12 000 r/min,4 ℃,离心30 min,上清液转移至新的EP管中。经蛋白定量后,按体积加入一定量5×loading buffer, 100 ℃沸水水浴15 min使蛋白质变性,标记名称日期,-80 ℃保存。按照比例配制10%分离胶5%浓缩胶,各组蛋白上样,80 V电泳,待蛋白marker分开后调整为120 V,至溴酚蓝染料前沿到达凝胶末端,停止电泳。取出蛋白凝胶置于转膜液中平衡 15 min,200 mA转膜1 h。NC膜蛋白面向上放入5%脱脂牛奶封闭液中,室温于摇床低速摇动,封闭1 h。 封闭液稀释一抗:Cyclin D1:1/5 000,β-actin:1/1 000,一抗杂交,4 ℃摇床避光孵育过夜。PBST洗涤NC膜3次,每次10 min,加二抗室温避光孵育 2 h。PBST洗膜3次,NC膜蛋白面朝下上机扫描,应用Odyssey蛋白质分析成像系统显像,通过获取目的条带的灰度值作为表达强度。
1.3 统计学处理方法 应用SPSS22.0统计软件对数据进行分析,Graphpad Prism 6.0软件绘图。实验数据去除异常值,计量资料采用表示,所有试验均重复检测3次。多组比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞中miR-144的表达检测 人PTC细胞K1、TPC-1和人甲状腺细胞Nthy-ori 3-1培养至对数生长期,经RNA提取,反转录合成cDNA后,qPCR检测细胞中miR-144的相对表达量。K1细胞中miR-144相对表达量为1.114±0.097,TPC-1细胞中miR-144相对表达量为1.555±0.110,甲状腺细胞Nthy-ori 3-1中miR-144的相对表达量为2.706±0.135。PTC细胞K1、TPC-1中的miR-144的相对表达量与甲状腺细胞相比,差异有统计学意义(P<0.01)。2种PTC细胞中K1细胞的miR-144表达量较TPC-1细胞低(P< 0.01)。
2.2 miR-144 对细胞增殖能力的影响 转染NC、miR-144 mimics和miR-144 inhibitor的K1细胞经MTT和DMSO处理,酶标仪检测转染后24、48、72、96、120 h的OD值。结果显示转染后24 h内,NC组、miR-144 mimics组和miR-144 inhibitor组的OD值差异无统计学意义(P>0.05)。从转染后48 h 开始,3组细胞增殖能力开始出现差异,在转染后120 h差异显著:与NC组比,miR-144 mimics组细胞增殖明显受到抑制,而miR-144 inhibitor组细胞增殖活跃(P<0.01),见图1。证明高表达miR-144可以明显抑制K1细胞的增殖能力,而低表达miR-144促进K1细胞增殖。

图1 MTT法检测miR-144对K1细胞增殖能力的影响
2.3 miR-144对细胞单克隆形成能力的影响 转染NC、miR-144 mimics和miR-144 inhibitor的K1细胞接种于6孔板,经过7~10 d培养,用0.1%结晶紫染色,拍照比较各组克隆形成情况。miR-144 mimics 组细胞克隆形成明显少于NC组,且其单个克隆大小也较NC组小;而miR-144 inhibitor组细胞克隆形成明显多于NC组,且其单个克隆大小也较NC组大。本研究结果证明过表达miR-144能够抑制K1细胞的单个细胞克隆形成能力,而抑制其表达则K1细胞的单个细胞克隆形成能力明显受促进。本研究结果进一步证实了高表达miR-144能抑制PTC细胞的增殖能力。见图2。
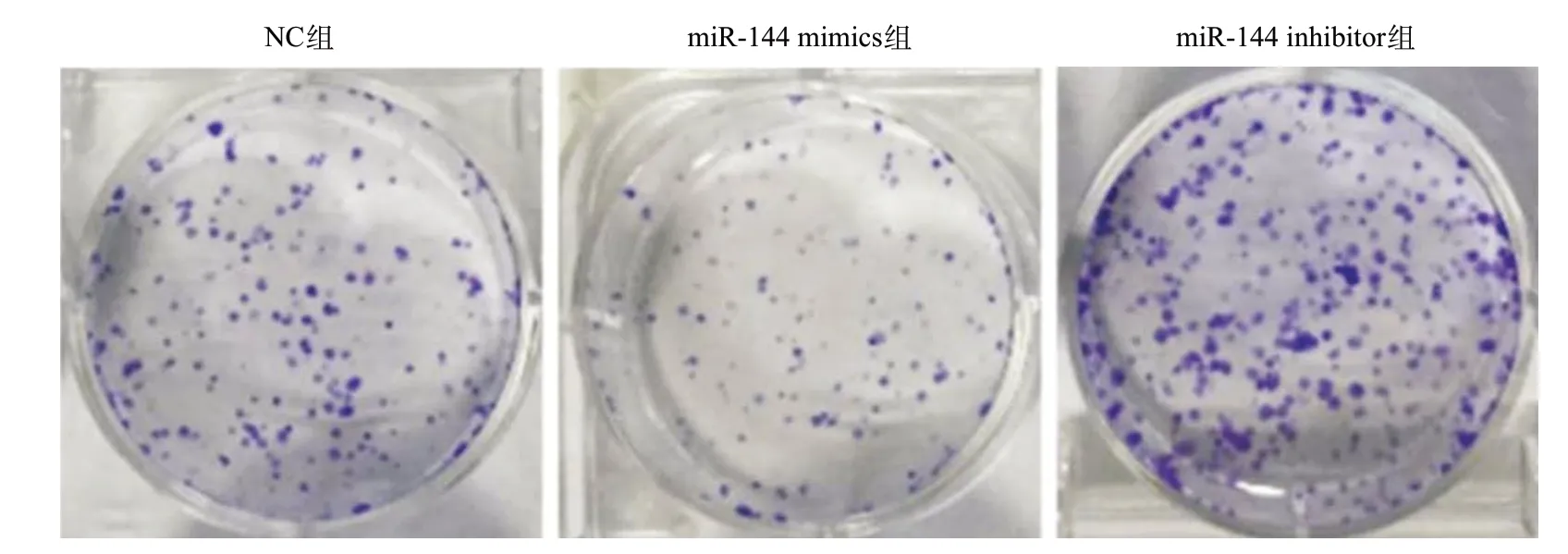
图2 miR-144对K1细胞单克隆形成能力的影响
2.4 miR-144对细胞周期的影响 PTC细胞株K1各组细胞转染后48 h,收集细胞进行流式细胞周期分析。如图3 所示,与NC组比,miR-144 mimics组G0/G1 期细胞占比明显增加,S、G2/M期细胞占比明显减少,差异有统计学意义(P<0.01);与NC组比,miR-144 inhibitors组G0/G1期细胞占比明显减少,S、G2/M 期细胞占比明显增加,差异有统计学意义(P<0.01); 提示miR-144对K1细胞周期的影响主要表现在G0/G1 期阻滞。见表1。调控G1期-S期进程的细胞周期蛋白为Cyclin D1,为了进一步验证miR-144阻断K1细胞的G1期-S期进程,引起G0/G1期阻滞,本研究通过Western blot实验检测miR-144 mimics、miR-144 inhibitor及NC组转染K1细胞后Cyclin D1蛋白表达水平的变化情况。与NC组比,miR-144 mimics组Cyclin D1蛋白表达量明显下降,而miR-144 inhibitor组Cyclin D1蛋白表达量明显升高,差异有统计学意义(P<0.01)。见图4。
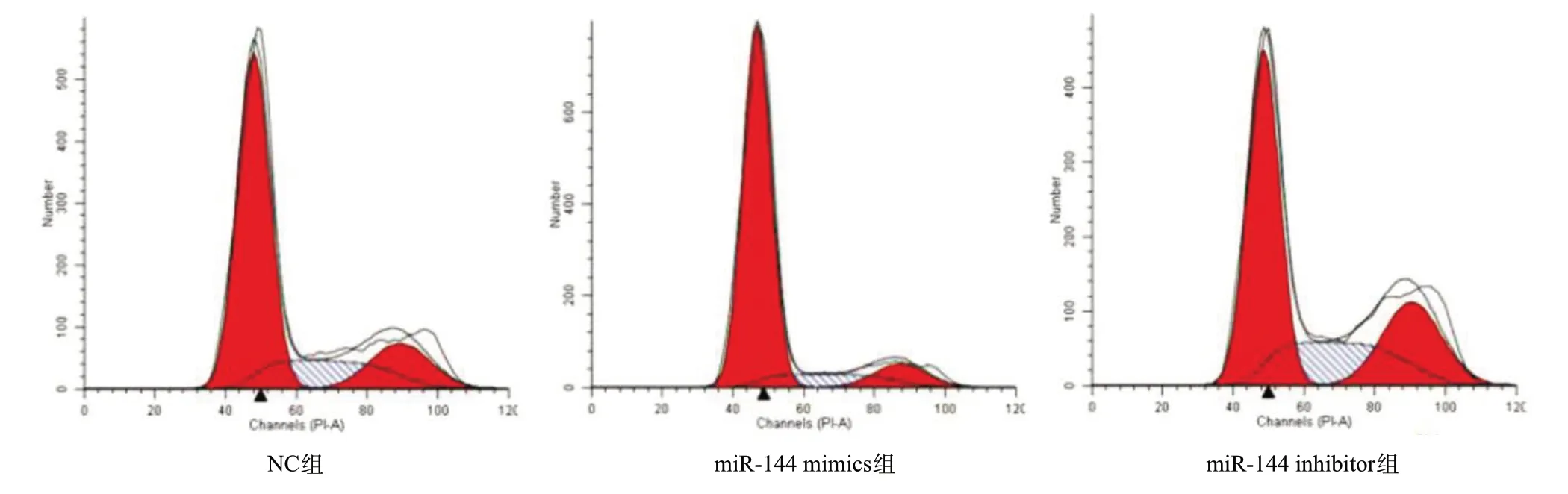
图3 流式细胞技术检测miR-144对K1细胞周期的影响

表1 miR-144对K1细胞周期的影响(%)
3 讨论
甲状腺癌发病率占内分泌肿瘤的95%,在头颈部肿瘤中居首位。由于甲状腺癌早期临床症状不明显,使其早期诊断较为困难。恶性肿瘤细胞的迅速增殖、侵袭转移是癌症患者死亡的主要原因[8]。因此,研究其增殖、侵袭的分子机制至关重要。在PTC的发生发展中,miRNA起着极其重要的作用。一些研究已经证实PTC组织中存在很多miRNA的差异表达,并且发挥着促癌基因或抑癌基因的作用[4,7,9-10]。 目前甲状腺癌主要依靠临床症状、体征及多普勒彩色超声、头颈部CT、ECT等来进行诊断和鉴别诊 断[1],甲状腺肿瘤miRNA表达谱的改变,可作为特殊的生物学标志用于早期诊断。修复或抑制miRNA在PTC细胞中的表达,有可能为开发抗肿瘤药物提供新思路。
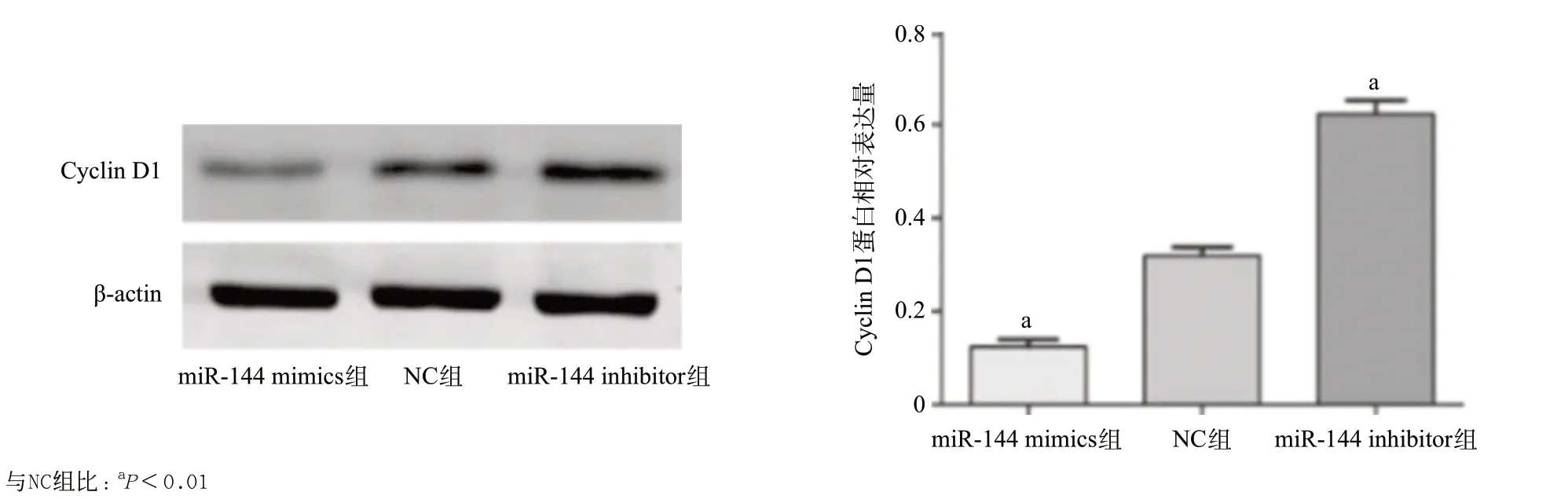
图4 miR-144对K1细胞Cyclin D1蛋白表达的影响
有研究表明,miR-144 在包括甲状腺癌在内的多种癌症中表达下调[4-7],在PTC细胞K1中下调miR-144可以增强癌细胞的侵袭能力,这一作用通过靶向ZEB1和ZEB2基因实现[10]。本研究通过实验证实miR-144在人PTC细胞表达显著降低,在生物学功能方面,miR-144通过抑制Cyclin D1的表达实现抑制细胞的有丝分裂,进而抑制细胞增殖,具体表现为miR-144高表达的细胞单克隆形成能力下降、细胞增殖率下降。由以上实验结果和文献资料我们推断,miR-144在甲状腺癌中发挥抑癌基因的作用,并且从细胞增殖、细胞周期及细胞侵袭等多方面阻断癌细胞的存活和扩散,但其能否作为新的治疗靶点投入到临床中还需要进一步深入研究。
综上所述,我们发现miR-144在PTC细胞中呈低表达,提高miR-144表达可以有效抑制PTC细胞的增殖能力,并且通过抑制Cyclin D1将细胞阻滞在G0/G1期。

