铂配合物对4-硝基甲苯的高效荧光检测
郑 宇,戴光阔,于潇贺,徐 强,邢 杨,狄 玲
(辽宁石油化工大学化学化工与环境学部,辽宁抚顺113001)
荧光为非平衡辐射且无需加热的能量输出形式,属于“冷光”。当荧光材料受到外部干扰或刺激时(如外电场、射线、电子束等),其电子由基态跃迁至激发态,随后荧光材料的激发态能量大部分以发光的辐射形式释放[1]。荧光材料广泛应用在储能、环境监测、光信息处理、军事、生物医学等研究领域,其性能研究已经成为材料化学领域的研究热点之一[2]。
目前,多金属氧酸盐[3-4]和过渡金属氧化物[5]等无机荧光材料的研究报道较多。由于无机荧光材料的种类较少、量子效率低、发光性能不易调节、使用条件苛刻等因素,无机荧光材料的应用受到了一定程度的制约。与无机荧光材料相比,金属有机荧光材料具有更高的量子效率和更宽的发光区间。在结构角度上,金属有机荧光材料通常具有共轭体系,在外界激发下更易吸收能量形成激发态。过渡金属配合物作为金属有机荧光材料具备金属原子的旋轨耦合效应,易形成激发态并发射荧光[6-9]。
硝基化合物作为重要的化工原料被广泛应用于农业、化工及制药工业。大部分硝基化合物化学性质稳定,难降解,易造成环境污染,而多数硝基化合物属于易制爆类物质,具有潜在的爆炸性,对公共安全构成严重威胁。因此,对硝基化合物的检测是环境污染控制及公共安全领域的研究热点。目前,针对硝基化合物的检测手段主要包括嗅探犬[10]、离子迁移率光谱法(IMS)[11]、等离子体解吸质谱分析法(PDMS)[12]、表面增强拉曼光谱法(SERS)[13]、能量色散X射线衍射(EDXRD)[14]以及成像技术等[15]。上述检测手段具有可靠的灵敏度和准确性,但所使用的仪器设备便携性不佳,检测成本高。荧光探针检测技术利用材料的发光性质实现对硝基化合物的检测,具有高效、经济、快捷的优势[16-18]。以铂配合物为代表的发光过渡金属配合物具有性质稳定、易提纯、荧光量子效率高、Stokes位移大等优点,是目前最具应用前景的一类发光配合物[19-24]。近年来,铂配合物在硝基化合物检测研究领域得到了广泛的应用,并展现出优异的检测效果[25-27]。
本文以发光铂配合物[Pt(ppy)(CH3CN)2]ClO4(见图1)作为荧光探针,用于检测硝基化合物4-硝基甲苯(4-NT)。通过密度泛函理论(DFT)计算[Pt(ppy)(CH3CN)2]ClO4及4-NT前线分子轨道能级;计算检测效率及最低检测限并研究检测机理。

图1 铂配合物[Pt(ppy)(CH3CN)2]ClO4的分子结构
1 实验部分
1.1 试剂和仪器
试剂:2-苯基吡啶(ppy)、氯亚铂酸钾(K2PtCl4)、高氯酸银(AgClO4),分析纯,阿拉丁试剂(上海)有限公司;乙二醇乙醚、乙腈,分析纯,西陇化工股份有限公司。
仪器:ME104电子分析天平(0.1 mg)、ME55电子分析天平(0.01 mg),瑞士梅特勒托利多精细仪器及衡器有限公司;RCT basic磁力搅拌器、RV 8v旋转蒸发仪,德国IKA科研仪器有限公司;SHZ-D(III)型循环水真空泵、DLSB-5/10低温冷却液循环泵,巩义市予华仪器有限公司;F7000荧光光谱仪,灵敏度S/N>800(RMS),日本日立有限公司。
1.2 DFT计算
通过高性能计算化学服务器(配置:双路XEON E5-2686 v4,36核,内存 128 GB,4 TB企业级硬盘)进行DFT计算。分子构型绘制及波函数分析软件:GaussView 6、Multiwfn 3.6、VMD 1.9.3;理论计算软件:Gaussian 16 A03;泛函:B3LYP;基组:对 C、H、N、O、Cl原子采用 6-31G*基组,对 Pt原子采用LanL2DZ赝势基组。
1.3 铂配合物的制备
准确称取185 mg(1.2 mmol)ppy并加入15 mL乙二醇乙醚,室温下搅拌30 min。随后向上述乙二醇乙醚溶液中加入500 mg(1.2 mmol)K2PtCl4及15 mL去离子水,在氮气气氛下80°C反应48 h。将反应液冷却至室温,用去离子水洗涤并抽滤,得到黄绿色固体(ppy)2Pt2Cl2。将(ppy)2Pt2Cl2固体及274 mg(1.2 mmol)AgClO4溶于乙腈中,在室温及氮气气氛下反应7 d。反应结束后,使用乙醇洗涤并抽滤得到黄绿色铂配合物[Pt(ppy)(CH3CN)2]ClO4,收率为78.2%。
1.4 4-硝基甲苯的检测方法
将铂配合物[Pt(ppy)(CH3CN)2]ClO4于313 K下真空干燥30 min去除溶剂分子,随后将上述经预处理的铂配合物于室温下配制成浓度为1.0×10-3mol/L的乙腈溶液,并在298 K下测定铂配合物的初始荧光强度(I0),使用微量进样器向铂配合物溶液中加入微量待测物的乙腈溶液,并测定荧光强度(I)。光谱测试的激发波长为360 nm,扫描范围为400~700 nm,激发及发射的狭缝宽度分别为10、5 nm。
荧光淬灭效率(η)使用式(1)进行计算;通过Stern-Volmer方程(式(2))拟合并计算铂配合物对4-NT的检测效率,[Q]为4-NT的浓度(mmol/L),KSV为检测效率(L/mmol);最低检测限(LOD,mol/L)通过式(3)进行计算,S/N为信噪比。

2 结果与讨论
2.1 铂配合物的结构表征
通过X-射线粉末衍射实验对所制备的铂配合物[Pt(ppy)(CH3CN)2]ClO4进行晶相表征,结果见图2。
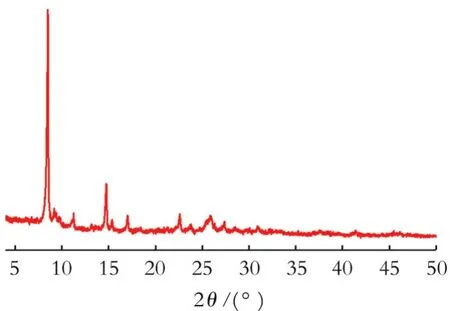
图2 铂配合物[Pt(ppy)(CH3CN)2]ClO4的XRD图谱
从图2可以看出,出峰峰形尖锐,说明其具有较高的纯度和优异的结晶性质。
通过红外光谱对铂配合物进行官能团结构表征,结果见图3。从图3可以看出,3 457 cm-1处为C-H的伸缩振动峰;2 323 cm-1处为Pt-N的伸缩振动峰;2 011 cm-1处为C≡N的伸缩振动峰;1 619 cm-1处为C=N 的伸缩振动峰;1 480、1 422、1 369 cm-1处为ppy的框架振动峰;1 088 cm-1处为C-N及C-C的伸缩振动峰;746、623 cm-1处为ppy的变形振动峰。

图3 铂配合物[Pt(ppy)(CH3CN)2]ClO4的红外光谱
2.2 铂配合物对4-硝基甲苯的检测
研究了铂配合物[Pt(ppy)(CH3CN)2]ClO4对多种芳香化合物的荧光检测效果,所涉及的芳香化合物分为两类:一类为不含硝基的芳香化合物,包括甲苯、苯乙烯、溴苯、苯、苯甲醛、苯乙酮及苯胺;另一类为硝基芳香化合物4-NT。图4为铂配合物[Pt(ppy)(CH3CN)2]ClO4对多种芳香化合物的荧光响应。

图4 铂配合物[Pt(ppy)(CH3CN)2]ClO4对多种芳香化合物的荧光响应
从图4可以看出,当不含硝基的芳香化合物(甲苯、苯乙烯、溴苯、苯、苯甲醛、苯乙酮及苯胺)存在时,铂配合物的荧光强度变化不明显;当溶液中存在硝基芳香化合物4-NT时,铂配合物的荧光发射强度明显降低。在4-NT作用下,铂配合物[Pt(ppy)(CH3CN)2]ClO4的荧光强度降低80%以上。因此,铂配合物[Pt(ppy)(CH3CN)2]ClO4在乙腈中对含硝基的芳香化合物4-NT具有优异的荧光检测效果。
图5为滴加不同浓度4-NT时铂配合物[Pt(ppy)(CH3CN)2]ClO4的发射光谱。从图5可以看出,未加4-NT时,铂配合物[Pt(ppy)(CH3CN)2]ClO4具有强烈的荧光发射,荧光曲线呈现精细振动结构,强度最大的两个荧光发射峰位于482 nm及516 nm,发射强度分别为2 313及2 063。向铂配合物[Pt(ppy)(CH3CN)2]ClO4中加入4-NT并逐渐提高加入浓度,[Pt(ppy)(CH3CN)2]ClO4呈现高效而快速的荧光响应,其荧光强度逐渐降低直至完全淬灭。加入1.0 mmol/L 4-NT可使[Pt(ppy)(CH3CN)2]ClO4的荧光强度降低14.8%;加入25.0 mmol/L 4-NT可使[Pt(ppy)(CH3CN)2]ClO4的荧光强度降低97.2%。当[Pt(ppy)(CH3CN)2]ClO4的荧光强度淬灭至原始强度的10.0%,加入4-NT的浓度小于25.0 mmol/L。
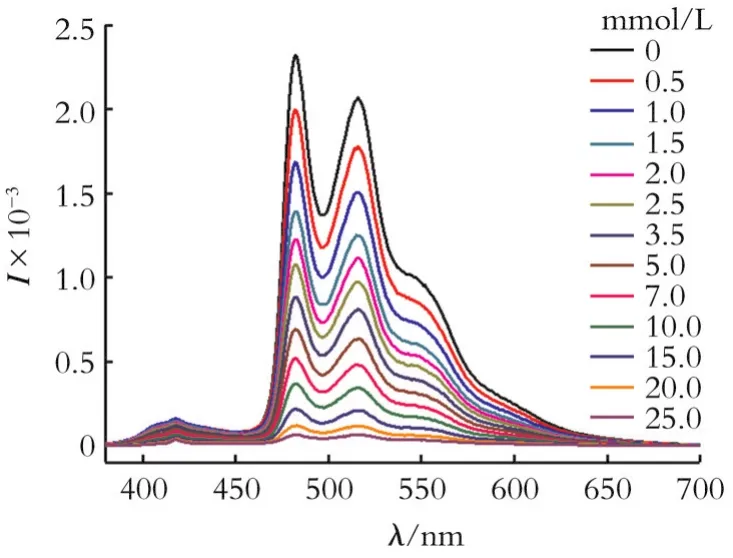
图5 滴加不同浓度4-NT时铂配合物[Pt(ppy)(CH3CN)2]ClO4的发射光谱
图6 为滴加4-NT后铂配合物[Pt(ppy)(CH3CN)2]ClO4的发光强度变化。从图6可以看出,当加入4-NT的浓度小于3.5 mmol/L时,482 nm处的荧光强度下降较为迅速;当加入4-NT的浓度大于3.5 mmol/L时,荧光强度下降较缓慢。516 nm处的荧光强度变化规律与482 nm处相同。

图6 滴加4-NT后铂配合物[Pt(ppy)(CH3CN)2]ClO4的发光强度变化
图7 为铂配合物[Pt(ppy)(CH3CN)2]ClO4对4-NT的荧光淬灭效率(η)曲线。根据Stern-Volmer方程(见式(2)),拟合得到铂配合物[Pt(ppy)(CH3CN)2]ClO4对4-NT的检测效率KSV为40.2 L/mmol,最低检测限LOD为1.83×10-6mol/L。

图7 铂配合物[Pt(ppy)(CH3CN)2]ClO4检测4-NT的荧光淬灭效率曲线
硝基化合物的紫外吸收光谱带与发光过渡金属配合物的荧光发射光谱带发生重叠,发光过渡金属配合物的激发态能量会利用荧光共振能量转移机理传递至硝基化合物并发生荧光淬灭[28-29]。如图8所示,[Pt(ppy)(CH3CN)2]ClO4的荧光发射光谱与4-NT的紫外吸收光谱重叠,因此[Pt(ppy)(CH3CN)2]ClO4与4-NT之间存在能量转移。

图8 铂配合物[Pt(ppy)(CH3CN)2]ClO4与4-NT的紫外吸收光谱重叠
电子转移是发光过渡金属配合物实现对硝基化合物检测的重要机理。富电子的发光过渡金属配合物对硝基化合物的荧光响应可用氧化还原电子转移机理进行解释。受到光照激发,发光过渡金属配合物的电子从基态跃迁到激发态,激发态电子通过光诱导作用转移至缺电子硝基化合物的LUMO轨道上并返回基态,造成荧光淬灭。如图9所示,铂配合物[Pt(ppy)(CH3CN)2]ClO4的LUMO能级为-2.51 eV,HOMO能级为-6.15 eV,能隙E00为 3.64 eV;4-NT的LUMO能级为-2.52 eV,HOMO能级为-7.44 eV,能隙E00为4.92 eV。4-NT的LUMO能级接近[Pt(ppy)(CH3CN)2]ClO4的LUMO能级,因此4-NT可接受[Pt(ppy)2(CH3CN)2]ClO4的激发态电子,发生电子转移。综上,Pt(ppy)(CH3CN)2]ClO4对4-NT的检测机理为能量传递机理及电子转移机理的协同作用。
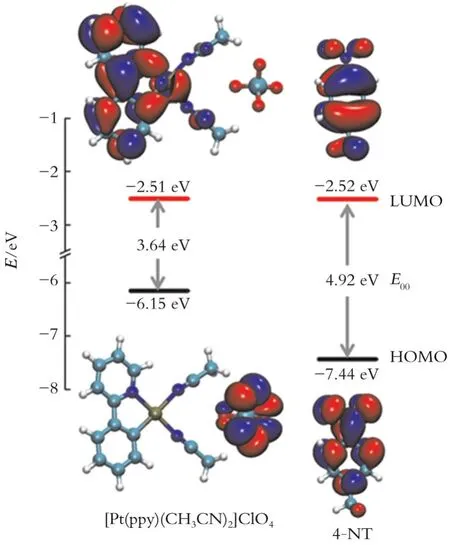
图9 [Pt(ppy)(CH3CN)2]ClO4及4-NT的前线分子轨道能级及等值面分布
3 结 论
(1)以发光铂配合物[Pt(ppy)(CH3CN)2]ClO4作为荧光探针检测硝基化合物4-NT,检测效率KSV可达40.2 L/mmol,最低检测限达1.83×10-6mol/L。
(2)铂配合物的配体ppy可与4-NT形成的π-π堆积相互作用,使铂配合物的激发态电子易转移至4-NT的LUMO轨道上,从而导致铂配合物的荧光淬灭。
(3)铂配合物分子中含大量π电子,属于富电子结构,因此很容易与缺电子的硝基化合物发生相互作用,促使电子转移,进一步提高荧光淬灭效率。
(4)铂配合物[Pt(ppy)(CH3CN)2]ClO4与4-NT可通过荧光共振能量转移作用发生能量传递。本研究为实现硝基化合物的快速检测提供实验参考和技术支持。

