基于网络药理学的“蒲公英-夏枯草”药对治疗乳腺癌作用机制研究Δ
唐吉伟,郑 叁,曹学帅,张柏银,顾 晖,郭亦杰
(1.湖南省第二人民医院麻醉手术科,湖南 长沙410011; 2.湖南中医药大学药学院,湖南 长沙 410208)
近年来,乳腺癌在我国的发病率逐渐升高,每年以3%的速率增长,成为女性人群中发病率增长最快的恶性肿瘤;同时,发病人群也越来越年轻化,给患者带来了极大的心理负担,让患者家庭承受了重大的经济和生活压力,降低了人们生活的幸福水平[1]。目前,乳腺癌的治疗方法主要是综合手术、化疗及放疗手段,但上述方法仍然面临着巨大的挑战,在治疗乳腺疾病的同时也影响了其他系统的健康,容易发生手术创口大恢复慢、体型发生较大改变、肝肾损伤、影响机体代谢和严重脱发等并发症,给患者的身心带了极大的伤害[2-3]。因此,亟待找到一种不良反应小、适用范围广的治疗方法,中医药治疗以其不良反应小、疗效好的特点带来了新的治疗思路。
蒲公英为菊科植物蒲公英TaraxacummongolicumHand.-Mazz.、碱地蒲公英TaraxacumborealisinenseKitam.或同属数种植物的干燥全草,《新修本草》记载其“妇人乳痈肿,水煮汁饮之,立消”,可治疗瘰疬、疔毒疮肿及急性乳腺炎等症;夏枯草为唇形科植物夏枯草PrunellavulgarisL.的干燥果穗,《神农本草经》记载其“味苦、辛,寒,主治寒热,瘰疬,鼠瘘,头疮,破癥,散瘿结气,脚肿湿痹”,可治疗乳痈、乳癖及乳腺增生等症。现代药理学研究结果表明,上述2味中药有强大的抗肿瘤活性[4]。两者相须配对在临床上应用广泛,主治肝胆热毒、湿热郁结之黄疸、胁助疼痛;肝经实火、热毒内蕴所致咽喉肿痛、目赤肿胀,火热邪毒郁结所致疔疮癕肿、瘰疬痰核及乳痈初起等症[5]。尚勇[6]发现,“蒲公英-夏枯草”药对与其他中药配伍还能改善乳腺增生症。《本草汇言》记载,“治乳痈初起:蒲公英、夏枯草各等分,酒煎服”。
新兴生物信息技术网络药理学集合各类中药、有效成分、蛋白及基因等信息,以“多靶点、多通路、多途径”的手段分析和构建“药物-靶点-疾病”网络预测模型,挖掘传统药物的作用机制[7]。其能从系统水平发现中药活性成分,并提示中药作用靶点及机制。“蒲公英-夏枯草”药对在临床上治疗乳腺癌有疗效[8-10],但其机制尚不明确。本研究将基于网络药理学方法,筛选“蒲公英-夏枯草”药对的有效成分,构建有效成分-抗恶性肿瘤靶点网络,初步探讨该药对的抗恶性肿瘤机制。
1 资料与方法
1.1 “夏枯草-蒲公英”药对成分虚拟筛选
整合中药系统药理学数据库和分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)(http://ibts.hkbu.edu.hk/LSP/tcmsp.php)、中药分子机制生物信息学分析工具(bio-informatics analysis tool for molecular mechanism of traditional Chinese medicine,BATMAN -TCM)(http://bionet.ncpsb.org/batman-tcm),结合中国天然产物化学成分库的数据分析,全面检索夏枯草、蒲公英的全部化学成分。
1.2 阈值筛选及靶点预测
整理数据库中夏枯草、蒲公英所有化学成分数据,并以化合物口服生物利用度(oral bioavailability,OB)≥30%、类药性(drug-likeness,DL)≥0.18为阈值进行筛选,最终得出优选化合物。通过TCMSP平台,将筛选出的成分在其对应的靶点数据库中进行靶点的收集以获得成分的靶点。
1.3 “成分-靶点”蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络构建
将搜集得到的成分及靶点整理后导入Cytoscape 3.4.0软件(http://www.Cytoscape.org/),生成“蒲公英-夏枯草”药对的“活性成分-靶点”PPI网络,使“蒲公英-夏枯草”药对的药理学作用机制可视化。
1.4 “疾病-靶点”PPI网络构建
利用比较毒理基因组学数据库(comparative toxicogenomics database,CTD)(http://ctd.mdibl.org/),以关键词“乳腺癌“及“breast cancer”进行搜集,得到98 252个靶点,根据“Inference score”,取数据库中前500个靶点。
1.5 网络合并
为了直观地得到靶蛋白之间的相互联系与作用,将收集得到的乳腺癌靶点导入STRING 10.0数据库(https://string-db.org/),构建乳腺癌相关靶标蛋白的PPI网络;再将其导入Cytoscape 3.6.1软件,与“成分-靶点”PPI网络进行相交合并,得到“蒲公英-夏枯草”药对作用于乳腺癌的靶标蛋白;最终在靶标蛋白导入STRING 10.0数据库中得到“蒲公英-夏枯草”药对作用于乳腺癌靶标蛋白的PPI网络后,将网络导入Cytoscape软件进行拓扑学性质的观察与分析。
1.6 富集分析
将上述分析得到核心靶点导入DAVID数据库(https://david.ncifcrf.gov/)进行基因本体(gene ontology,GO)功能分析,以了解“蒲公英-夏枯草”药对的主要成分对于乳腺癌的GO功能;再利用Reactome数据库(https://reactome.org)对上述分析得到的核心靶点进行京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,以了解“蒲公英-夏枯草”药对主要成分的靶标蛋白在信号通路中的作用,直观地得到“蒲公英-夏枯草”药对作用于乳腺癌发挥作用的途径;最后利用Omicshare软件(http://www.omicshare.com/tools/index.php/)可视化处理富集分析的结果。
1.7 动物实验验证
1.7.1 实验动物:本实验研究的小鼠均来自长沙斯莱克景达实验动物中心,将30只体质量18~22 g雌性SPF级BABL/c小鼠(6~8周,健康状态良好;许可证编号:SCXK(湘)2018-0005)圈养在无特定病原体设施中(湖南中医药大学SFP级动物实验中心),并在整个研究期间维持室温在23~25 ℃,提供高压灭菌的食物和蒸馏水。
1.7.2 实验建模:建立对照组、模型组与治疗组,将30只BABL/c小鼠随机平均分配至对照组、模型组和治疗组,每组10只。适应性饲养所有BABL/c小鼠7 d,将 4T1细胞200 μl(1.0×105个细胞)皮下注射于模型组、治疗组小鼠的右侧腋下,以此构建乳腺癌小鼠模型[11]。
1.7.3 实验方法:建模成功后,给予三组小鼠连续灌胃25 d,每日早晚各1次。对照组、模型组小鼠每次给予0.9%氯化钠注射液2.5 ml灌胃,治疗组小鼠每次给予夏枯草、蒲公英按生药4 g/kg溶于0.9%氯化钠注射液2.5 ml灌胃。处死小鼠前采取眼眶静脉血,采用双抗体夹心酶联免疫吸附测定法(enzyme-linked immuno sorbent assay,ELISA),将血清以1 000 r/min的转速离心10 min以去除沉淀和细胞碎片。根据说明书,用ELISA试剂盒进行平衡、标记、混合、冲洗滴加基质试剂并于室温下避光放置15 min等操作,以测定白细胞介素6(IL-6)含量。断颈处死小鼠后,摘取接种皮下肿瘤组织,进行苏木精-伊红(hematoxylin-eosin,HE)染色、TUNEL染色,以完成有关病理学检测及原位细胞凋亡检查。
2 结果
2.1 “夏枯草-蒲公英”药对化学成分虚拟筛选
共检索出“夏枯草-蒲公英”药对中74种化学成分,其中夏枯草有60种,蒲公英有14种;以OB≥30%、DL≥0.18为阈值共筛选出16种优选化合物,其中夏枯草有11种,蒲公英有5种。
2.2 优选化合物靶点预测
通过对TCMSP、BATMAN-TCM数据库数据的整理归纳,共检索出靶点蛋白594个(夏枯草377个,蒲公英217个),并通过Uniprot数据库(http://www.uniprot.org/)将预测出的靶点蛋白名称转换为基因名称。
2.3 “蒲公英-夏枯草”药对“成分-靶点”PPI网络构建
通过收集查找TCMSP数据库中“蒲公英-夏枯草”药对主要化合物的对应靶点,将结果导入Cytoscape 3.6.1构建“主要化合物-靶点”网络,得到了383个节点(包含17个活性成分节点、366个预测靶标节点)和594条相互作用关系,见图1;图中,深色节点代表药对的主要化合物,浅色节点代表化合物对应的靶点。
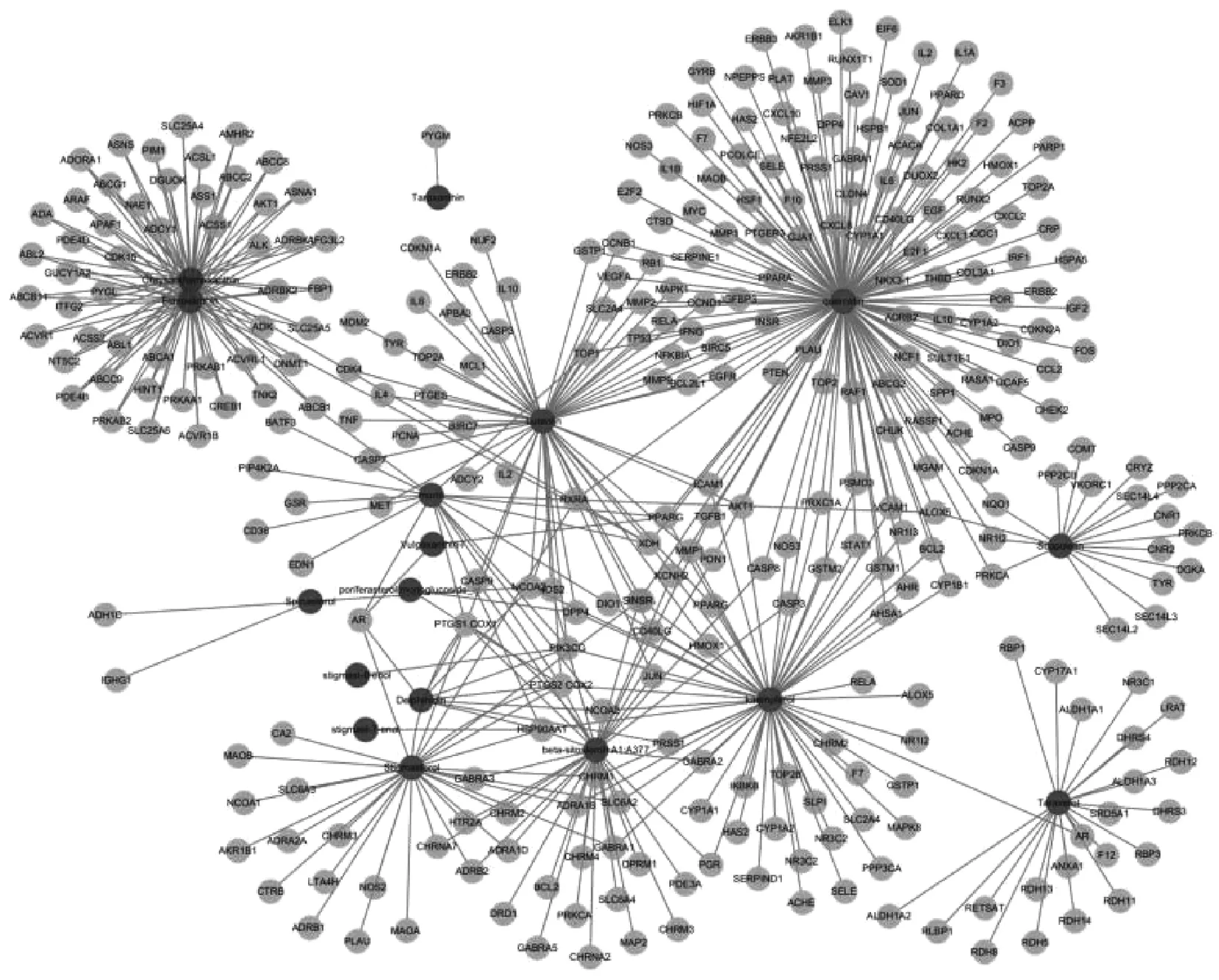
图1 “蒲公英-夏枯草”药对“成分-靶点”网络Fig 1 “Composition-Target” network of the herbal pair of “dandelion-selfheal”
2.4 乳腺癌“疾病-靶点”PPI网络构建
将CTD数据库中检索得到的前500个乳腺癌相关基因输入 Cytoscape 3.6.1 软件,使用DAVID数据库检索PPI,并将该相互作用关系导入cytoscape,制作乳腺癌“疾病-靶点”PPI网络,见图2。

图3 “蒲公英-夏枯草”药对治疗乳腺癌的“成分-核心靶点”网络Fig 3 “Composition-Core target” network of the herbal pair of “dandelion-selfheal”
2.5 网络合并
利用Cytoscape 3.6.1软件的Merge功能,将“蒲公英-夏枯草”药对“成分-靶点”PPI网络和乳腺癌“疾病-靶点”PPI网络进行有效合并,构建“成分-靶点-疾病”网络。按照度值排列,得到61个核心靶点组成的核心网络,见图3。61个核心靶点包括TP53、JUN、ESR1、IL6、AKT1、CCND1、HSP90AA1、FOS、AR、EGF及PTEN等。
2.6 GO功能富集分析
利用DAVID平台对“蒲公英-夏枯草”药对作用于乳腺癌的PPI网络中涉及的61个核心靶点进行GO功能富集分析。以校正后P为标准升序选取前25条,分别为对脂质的反应、生物过程的积极调节、细胞过程的积极调节、对有机环状化合物的反应、对含氧化合物的反应、对有机物的反应、细胞对化学刺激的反应、对化学品的反应、细胞对刺激的反应、代谢过程的积极调节、细胞代谢过程的积极调节、对刺激的反应、细胞死亡、细胞增殖、细胞对有机物的反应、调节代谢过程、细胞凋亡过程、程序性细胞死亡、调节细胞代谢过程、生物调节、单一细胞过程、细胞通讯、细胞对有机环状化合物的反应、调节细胞死亡和发展过程,均属于GO功能中的生物学过程,见表1。
2.7 KEGG通路富集分析
利用Reactome数据库对“蒲公英-夏枯草”药对作用于乳腺癌的PPI网络中的核心靶点蛋白进行KEGG通路富集分析,以P<0.01、错误发现率<0.05对结果进行筛选,选取前20条通路导入Omicshare平台进行可视化处理,见表2、图4。
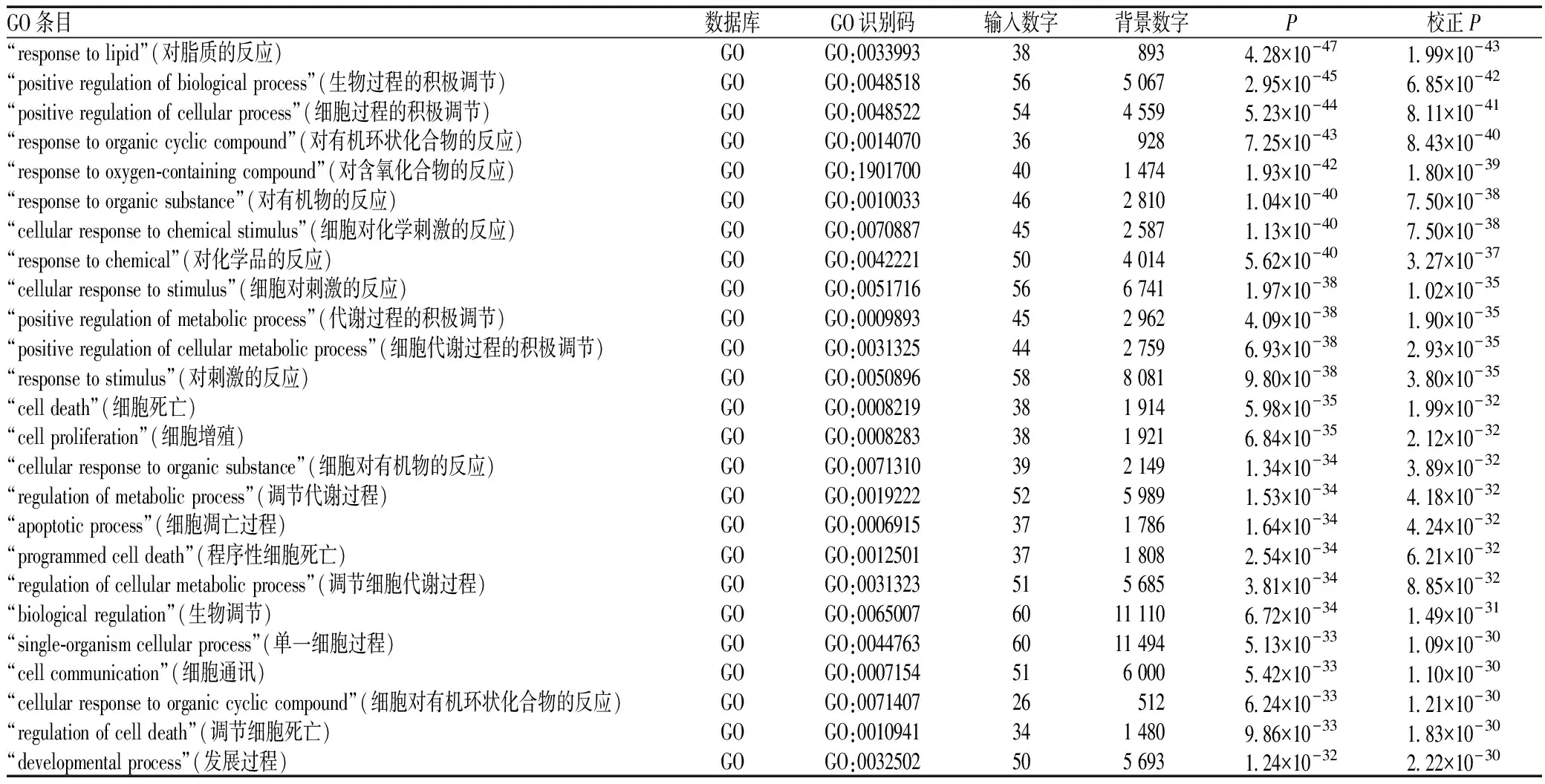
表1 GO功能富集分析Tab 1 Enrichment analysis of Go function

表2 “蒲公英-夏枯草”药对治疗乳腺癌靶点的KEGG富集通路Tab 2 KEGG enrichment pathway of the herbal pair of “dandelion-selfheal” in treatment of breast cancer
通过Reactome数据库对核心通路进行注释,见图5。由图4可见,“蒲公英-夏枯草”药对作用于乳腺癌的PPI网络中的核心靶点主要参与的通路有免疫系统中的细胞因子信号、免疫系统、白细胞介素4(IL-4)和白细胞介素13(IL-13)途径、雌激素受体(ESR)介导信号途径、非基因组雌激素信号传导、核受体的信号传导、细胞衰老、ESR-膜信号传导下游的雌激素依赖性核事件、细胞应激反应、白细胞介素10(IL-10)途径、癌基因诱导的细胞衰老、泛素化E3连接酶靶蛋白、雌激素依赖性基因表达、类泛素化、人C型凝集素域7家族成员A/炎症通路、细胞对外界刺激的反应、PIP3激活AKT信号传导、衰老相关分泌表型和TP53的调控表达,提示了“蒲公英-夏枯草”药对可通过多种途径对乳腺癌进行多方面的干预。由图5可见,“蒲公英-夏枯草”药对作用于乳腺癌的PPI网络中的核心靶点主要涉及白细胞介素途径、雌激素信号途径、细胞衰老及基因转录等多个方面。图4—5中最右方的颜色带表示主要的富集通路,而P随颜色的加深而逐渐增大,提示“蒲公英-夏枯草”药对对于乳腺癌的干预涉及多个复杂的生物过程。
2.8 动物实验结果
2.8.1 蒲公英配伍夏枯草对小鼠血清IL-6含量的影响:对照组、模型组和治疗组小鼠平均血清IL-6含量分别为(0.26±0.03)、(1.02±0.04)和(1.78±0.03)ng/ml;与对照组比较,模型组、治疗组小鼠血清IL-6含量均明显升高,且治疗组升高更明显,差异均有统计学意义(P<0.05),表明蒲公英配伍夏枯草能促进乳腺癌小鼠血清免疫因子的释放。

图4 KEGG富集通路可视化Fig 4 Visualization of KEGG enrichment pathway
2.8.2 蒲公英配伍夏枯草对小鼠肿瘤组织病理学结构的影响:为了解肿瘤组织病理学改变,本实验采用HE染色进行观察。结果显示,治疗组乳腺细胞排列整齐;模型组肿瘤细胞分布密集、排列紧凑且呈现细胞异型性,内部肿瘤细胞表现旺盛生长;与模型组比较,治疗组肿瘤组织松散,肿瘤细胞排列稀疏,可见坏死区域、部分细胞坏死以及炎性细胞浸润,说明蒲公英配伍夏枯草能够抑制肿瘤增殖,具有显著的抗肿瘤作用,见图6。
2.8.3 蒲公英配伍夏枯草对小鼠原位肿瘤细胞凋亡的影响:为了解原位肿瘤细胞凋亡情况,本实验采用TUNEL染色进行检测[12-13]。结果显示,空白组仅见极少数TUNEL阳性细胞;模型组可见少量散在分布的TUNEL阳性细胞;与模型组比较,治疗组可见大量的TUNEL阳性细胞,整个细胞着色较深,细胞核内有较强的棕色颗粒,见图7。对照组、模型组和治疗组小鼠肿瘤组织细胞凋亡指数(TUNEL阳性率)分别为(1.2±0.3)%、(4.2±0.5)%和(8.6±0.6)%;与对照组比较,模型组、治疗组小鼠肿瘤组织细胞凋亡指数均明显升高,且治疗组升高更明显,差异均有统计学意义(P<0.05),表明蒲公英配伍夏枯草具有显著的抗肿瘤活性,可促进乳腺癌细胞凋亡。
3 讨论
乳腺癌在中医学中属于“乳岩”“乳核”及“石痈”等范畴,其病名首见于宋代陈自名的《妇人大全良方》,其中记载:“若初起,内结小核,或如鳖棋子,不赤不痛,积之岁月渐大,峥岩崩破如熟石榴,或内溃深洞……名曰乳岩”。乳岩的病因多与肝胃相关,《疡医大全》曾记载“乳头属肝,乳房属胃”,肝失疏泄、气机郁滞,脾胃纳运失调、升降失常,导致气血化生不足、痰浊内阻甚至气滞血瘀,气、痰和瘀交阻于乳房,久而不散则形成乳岩。此外,乳腺癌还与正气不足、情志不畅和冲任失调等其他因素密切相关。乳腺癌的临床表现主要为乳房可触及明显肿块、质硬且痛,并伴有皮肤橘皮样改变等。“蒲公英-夏枯草”药对出自《本草汇言》,具有清热解毒、清肝泻火和消肿散结之功,主治乳痈初期、目赤肿痛,现被广泛用于瘰疬、痰核即各种恶性肿瘤等疾病的治疗,但具体作用机制仍不清楚。本研究为探索“蒲公英-夏枯草”药对治疗乳腺癌的作用靶点及作用机制,运用网络药理学、生物信息学技术进行了更深入的分析。

图5 富集通路注释Fig 5 Annotation of enrichment pathway
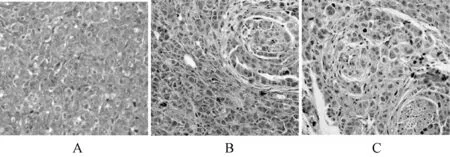
A.空白组;B.模型组;C.治疗组A.blank group; B.model group; C.treatment group图6 蒲公英配伍夏枯草对小鼠肿瘤组织病理学结构的影响Fig 6 Effect of dandelion compatible with selfheal on the pathological structure of tumor tissue of mice

A.空白组;B.模型组;C.治疗组A.blank group; B.model group; C.treatment group图7 蒲公英配伍夏枯草对小鼠肿瘤组织细胞凋亡的影响Fig 7 Effect of dandelion compatible with selfheal on the cell apoptosis of tumor tissue of mice
本研究中,将得到的61个核心靶点通过GO功能富集分析发现,“蒲公英-夏枯草”药对治疗乳腺癌的主要生物学过程涉及细胞过程、代谢过程、细胞代谢过程、细胞通讯及细胞凋亡过程的调节等方面;分子功能涉及对脂质、有机物、有机环状化合物、含氧化合物及刺激的反应、细胞对有机物、有机环状化合物及刺激的反应等方面。通过KEGG通路富集分析发现,“蒲公英-夏枯草”药对治疗乳腺癌主要通过影响免疫系统中的IL-4、IL-10和IL-13等细胞因子信号途径,ESR介导的信号途径,非基因组雌激素与核受体的信号传导,泛素化E3连接酶靶蛋白,人C型凝集素域7家族成员A/炎症通路,PIP3激活AKT信号传导,TP53的调控表达,细胞应激反应以及细胞衰老等方面。
近年来,对蒲公英和夏枯草抗肿瘤作用的相关研究结果提示,蒲公英有抑制肿瘤细胞增殖、改善肿瘤细胞微环境以及减轻抗肿瘤药不良反应的作用[14];夏枯草含有众多抗肿瘤活性成分,其抗肿瘤作用是通过多种机制协同实现的,有实验结果证明促进肿瘤细胞凋亡是夏枯草抗肿瘤的主要机制[15-16]。然而,鲜见将夏枯草、蒲公英组成药对运用网络药理学方法研究其抗肿瘤机制的研究。本研究结果显示,“蒲公英-夏枯草”药对主要是通过免疫系统、性激素代谢和肿瘤细胞的增殖与凋亡等3个方面发挥抗乳腺癌作用。(1)免疫系统方面:“蒲公英-夏枯草”药对治疗乳腺癌主要是促进细胞因子IL-6的释放。IL-6是吞噬细胞活化后释放的细胞因子,在机体免疫和炎症反应中起到非常重要的作用,还能激活JAK/STAT信号通路,将免疫信号传递到免疫细胞,介导与免疫和炎症相关的免疫应答[17]。蒲公英配伍夏枯草可以增强小鼠的免疫系统,通过自身免疫系统延缓肿瘤的发展过程,平衡机体内免疫微环境,从根本上改变肿瘤细胞的生长与生存环境,初步阐释了该药对发挥抗乳腺癌优效性的机制。(2)性激素代谢方面:“蒲公英-夏枯草”药对治疗乳腺癌主要通过影响ESR和雌激素的表达。ESR可分为许多类,其中EGR3的编码基因定位于人染色体8p21—23,编码蛋白包含387个氨基酸,而EGR3是ESRα的下游效应基因,故在雌激素的诱导下,EGR3可在与乳腺癌相关的信号通路上发挥重要作用[18]。Suzuki等[18]针对190例乳腺癌患者进行研究,发现99例患者有EGR3免疫反应性;进一步分析结果表明,这种免疫反应性的强弱与乳腺癌的淋巴结转移、远处转移、ESRα或同一患者非同步复发等有关,还与患者预后不良有关。以上结果表明,EGR3在雌激素介导的乳腺癌侵袭和转移中具有重要作用,并可作为乳腺癌患者预后的一个独立预测因子。(3)肿瘤细胞的增殖与凋亡:“蒲公英-夏枯草”药对治疗乳腺癌主要通过抑制肿瘤细胞增殖、促进肿瘤细胞凋亡。细胞凋亡对维持组织器官的正常形态和功能以及在机体生长发育和生殖衰老等生理过程中都有重要作用,肿瘤的发生发展与细胞恶性增殖或者细胞凋亡显著减少也密不可分,诱导肿瘤细胞凋亡是预防或者治疗肿瘤的重要手段[19-20]。
综上所述。本研究通过网络药理学探究“蒲公英-夏枯草”药对的主要活性成分作用于乳腺癌的靶点和作用通路,再经小鼠模型实验证实,“蒲公英-夏枯草”药对可对乳腺癌的生长起到明显的抑制作用,其作用机制主要涉及白细胞介素途径、雌激素信号途径、细胞衰老及基因转录等方面,为临床指导用药提供了理论依据。中药成分复杂,作用靶点多,途径丰富,相关研究方向可能不明确。通过网络药理学平台对中药作用靶点及机制进行探讨,可使“药物-靶点-疾病”网络可视化,也为未来的研究指明了方向,在临床研究中具有重大意义。本研究为后续研究“蒲公英-夏枯草”药对治疗乳腺癌的作用机制提供了理论依据,也为未来探讨中医中药的科学性提供了研究方法。

