脓毒血症患者炎性因子及免疫指标与疾病严重程度的相关性研究
肖勇 夏正新 方玉明
脓毒血症是指由感染引起的全身炎症反应,是严重感染、创伤、烧伤、休克、大手术后常见的并发症,死亡率约为30%~70%,是ICU患者死亡的主要原因[1,2]。其中炎性反应 、免疫及感染等因素均参与脓毒血症的发病机制,近年研究提示机体促炎-抗促炎反应平衡稳态的失调在其中发挥重要作用[3,4]。越来越多的证据表明,免疫抑制和功能受损在脓毒血症的发生、发展过程中起作用[5]。相比炎性反应的早期,超过80%的脓毒症患者死于免疫状态低下的感染[6]。以上研究均提示免疫抑制状态是脓毒症患者预后不良的重要因素之一。临床医师以患者病情程度作为治疗脓毒血症的基础,所以需根据急性生理和慢性健康评分系统(acute physiologyand chronic health evaluation-II,APACHE-II)判断患者的病情程度,但APACHE-II需要一定时间,无法实时评价脓毒血症患者的病情[7]。本项目通过检测脓毒血症患者血液中炎性指标(PCT、CRP、 IL-6、IL-10、WBC、NE-UT)及免疫指标(CD4+、CD8+、CD4+/CD8+)的变化,旨在阐明上述指标对患者病情程度的预测价值。
对象与方法
1 对象 根据2003年国际脓毒血症诊断标准招募患者[8],挑选2015年9月~2017年2月本院重症监护病房住院的脓毒血症患者54例为研究对象。入组标准:排除肿瘤、严重营养不良、糖尿病等影响免疫功能的疾病及过敏体质者;年龄为18~80岁。其中女24例,男30例;年龄44~75岁,平均(51.6±4.7)岁;其中包括重症肺炎29例,其他类型感染25例。根据分级标准[9],按照入院时病情将全部脓毒血症患者分为脓毒性休克组(n=17)、严重脓毒血症组(n=19)、脓毒血症组(n=18)。各组的年龄及性别等一般资料经统计学分析,差异无统计学意义(P>0.05),具有可比性。
2 方法
2.1 主要仪器与试剂:人淋巴细胞分离液购自达科为生物工程有限公司。ELISA 试剂盒(IL-6、IL-10)均购自美国美国R&D 公司,荧光素FITC 标记抗人CD4 /CD8抗体购自eBioscience 公司。
2.2 收集标本及指标检测:患者入院第1天7∶00~8∶00,抗凝管留取空腹静脉血5 mL,首先取3 mL血样于离心管,放于离心机,调转速 3 000 r/min,离心10 min,收集上层血清,-20℃保存以备后续实验。收集余下的2 mL血样,加入荧光素FITC标记抗人CD4/CD8抗体,采用流式细胞仪检测患者外周血CD4+、CD8+、CD4+/CD8+比例的变化。其余血标本送往院检验科。采用电化学发光法对血PCT进行检测,由罗氏公司和德国柏林B.R.A.H.M.S Diagnostica公司提供试剂盒和仪器。采用全自动生化分析仪(雅培Aeroset)检测CRP水平,试剂盒由宁波德赛生物科技有限公司提供。采用希斯美康血细胞分析仪检测NEUT水平,原装配套试剂,校准液,质控液。所有参入者均签署知情同意书。患者入院24 h内进行APACHE-II评分,包括年龄、急性生理学及慢性健康评分,分数为0~71分,分数高低表示患者病情程度,分数越高越严重。
2.3 检测外周血清细胞因子采用酶联免疫吸附法(ELISA) 检测:上述收集的血清样本,按照试剂盒说明书,分别将50 μL样本及标准品依次加入已包被反应孔中,然后将50 μL酶联亲和物依次加入每孔,37℃温育1 h,弃去孔内液体; 用洗涤液反复冲洗5次,加入底物液显色,37℃下避光反应10~30 min,加入终止液50 μL,酶标仪在450 nm处以空白对照孔调零后测定吸光度( A) 值。通过标准曲线计算出IL-6和IL-10的水平。
3 统计学处理 应用SPSS 19.0统计,计量资料用±s表示,组间比较采用t检验;计数资料用率表示,组间比较采用χ2检验,细胞及炎症因子与NIHSS得分的相关性采用Spearman 相关分析。检验水准α=0.05,P<0.05表示差异有统计学意义。
结 果
1 各亚组APACHE-Ⅱ评分比较 患者入院24 h 内进行APACHE-Ⅱ评分,脓毒血症组评分为(13.87±1.82),严重脓毒血症组评分为(21.82±1.78),脓毒性休克组评分为(28.33±2.05)分,组间差异有统计学意义(F=88.29,P<0.000 1)。见图1。
2 各亚组脓毒血症患者炎性指标水平 患者入院第1天,将各亚组血液中炎性指标NEUT、CRP、PCT、IL-6、IL-10、WBC表达水平进行比较,结果显示脓毒血症组、严重脓毒血症组、脓毒性休克组表达水平依次升高,组间差异有统计学意义(P<0.05)。见图2。
3 各亚组脓毒血症患者细胞免疫功能比较 采用流式细胞仪,检测各亚组患者CD3+CD4+、CD3+CD8+细胞及CD4+/CD8+比例,结果提示脓毒血症组、严重脓毒血症组、脓毒性休克组T细胞亚群依次下调,比较差异有统计学意义(P<0.05),见图3。
4 脓毒血症患者APACHE-Ⅱ评分与体内炎性指标及免疫功能的相关性分析 Spearman 相关分析结果显示,脓毒血症患者体内炎症指标(CRP 、PCT、IL-6、IL-10、WBC)与APACHE-Ⅱ评分呈正相关(r=0.778,0.654,0.685,0.541,0.532,P<0.05),而免疫功能CD4+、CD8+、CD4+/CD8+与APACHE-Ⅱ评分呈负相关(r=-0.676,-0.517,-0.612,P<0.05)。见表1。
讨 论
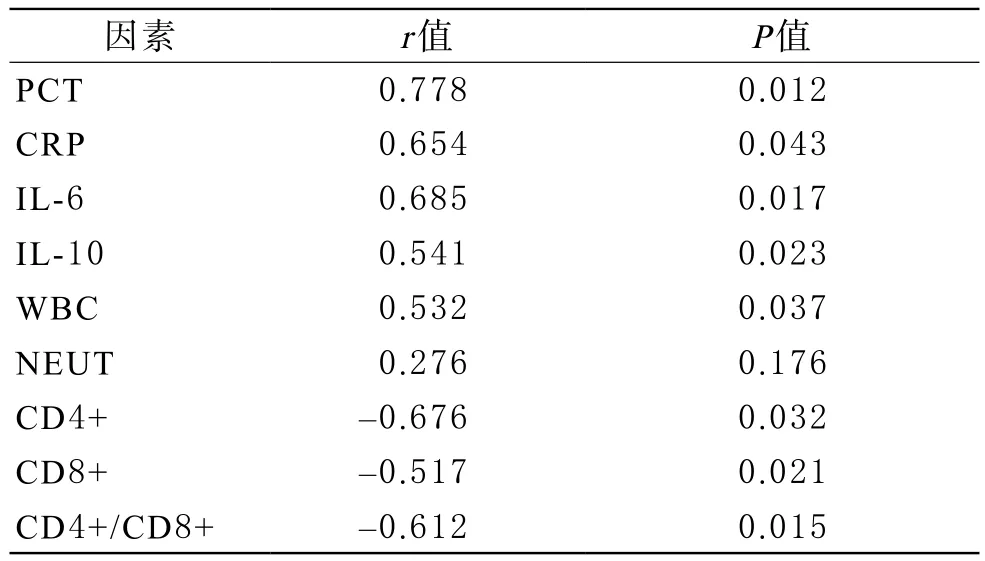
表1 脓液血症患者血液中炎性指标及免疫功能与APACHE-Ⅱ评分的相关性分析
目前对脓毒血症的研究已取得了很大的进展,但发病机制尚未明确,近几年的研究发现,细胞因子的表达水平在脓毒血症的发病及发展中发挥重要作用,尤其是炎症介质可能导致患者体内炎性反应长时间处于高水平状态。研究者Bone等[10]最先提出假说-代偿性抗炎反应综合征,提示脓毒血症患者机体发生了促炎与抗炎机制失调。而机体免疫功能变化在脓毒症发生、发展过程中发挥重要作用,免疫调理治疗可能是脓毒症及脓毒症休克患者的重要治疗方法[11]。目前脓毒症休克仍然具有较高的病死率,是临床面临的重大挑战之一。随着现代生物技术及分子生物学的不断发展,发现多种生物标志物在脓毒症的病情和预后及疗效评估等方面发挥重要作用[12,13]。因单独检测一种生物标志物可能存在敏感性及特异性不高等缺点,可能需要联合检测多种标志物来提高对脓毒症患者病情及预后的预测价值[14]。本研究通过检测脓毒血症患者血液中炎性指标(PCT、CRP、IL-6、IL-10、WBC、NEUT)及免疫指标(CD4+、CD8+、CD4+/CD8+)的变化,旨在明确上述指标对对患者病情的预测价值。
脓毒血症发病不同阶段,炎症介质种类及表达水平有所不同,在脓毒血症早期机体呈现以白介素-6(IL-6)为代表的促炎症介质表达水平的增加,作为对抗保护机制,机体随后启动抗炎反应,以白介素-10(IL-10)为代表,对抗促炎症介质的作用,从而降低失控性爆发性炎性反应,以此来减少对组织的损伤[15]。这是机体自我保护,但过度的抗炎反应也可导致免疫功能低下,从而减弱对病原菌的清除,甚至诱导机体呈现“免疫麻痹”状态,由此极大增加患者二次感染的风险[16,17],现已明确脓毒症患者存在T淋巴细胞免疫反应低下[18]。C 反应蛋白CRP是肝细胞在IL-6 作用下产生的急性时相蛋白,健康人血清CRP浓度很低(<5 mg /L),但组织损伤、细菌感染或应激时其水平明显升高,且在炎症早期即显著升高,是早期反映细菌感染较敏感的指标。PCT 是一种能够反映感染程度的特异性蛋白质,健康人血清浓度一般低于0.1 μg/L,PCT并不直接诱发脓毒血症的发生,但能够导致病理生理的加重[19,20]。本研究发现随着脓毒血症患者病情加重,血液中CRP 、PCT、IL-6、IL-10、WBC、NEUT 炎症指标水平依次升高(P<0.05),而CD3+CD4+、CD3+CD8+细胞及CD4+/CD8+水平依次降低。其中炎症指标PCT、CRP、IL-6、IL-10、WBC与APACHE-Ⅱ评分呈正相关(r=0.778,0.654,0.685,0.541,0.532,P<0.05),而免疫功能CD4+、CD8+、CD4+/CD8+与APACHE-Ⅱ评分呈负相关(r=-0.676,-0.517,-0.612,P<0.05)。提示上述炎性指标水平越高,患者病情越严重;并且随着病情的加重,患者存在严重的免疫功能抑制,随之导致免疫麻痹状态。
综上所述,脓毒血症患者存在促炎/抗炎平衡及免疫功能抑制,随着病情的加重,患者血液中PCT、CRP、IL-6、IL-10、WBC水平呈高表达,而免疫功能CD4+、CD8+、CD4+/CD8+呈低表达,故在脓毒血症的临床诊治过程中,临床医师应加强对炎性介质及免疫功能联合动态监测,这样将有助于指导患者的临床治疗和评判预后。