TLR-3激动剂联合TLR-9激动剂对树突状细胞细胞形态及免疫表型的影响*
沈季敏 刘欣 王兴兵
急性髓系白血病(Acute myeloid leukemia,AML)起源于骨髓细胞,是一种进展迅速的造血系统恶性肿瘤[1]。近年来研究表明,白血病干细胞(leukemia stem cell,LSC)可能是造成白血病发生和发展、耐药和复发的根本原因[2,3]。本实验选用CD34+白血病细胞作为靶细胞。基于树突状细胞(Dendritic Cells,DCs)的免疫治疗是目前清除AML微小残留(Minimal Residual Disease,MRD)很有前景的一种治疗手段[4]。尤其不能做异基因造血干细胞移植的有高危复发风险的患者能从中获益。DCs是目前已知的功能最强的抗原递呈细胞,能够加工、处理并将抗原信息传递给T淋巴细胞,显著刺激初始型T细胞增殖,引发一系列特异性抗肿瘤免疫应答。目前,AML的免疫细胞治疗已有一定的实验室和临床研究[5]。利用DC递呈肿瘤相关抗原,启动特异性抗肿瘤免疫受到广泛关注,但由于肿瘤细胞可通过分泌某些可溶性细胞因子抑制DC的成熟和功能,所以人们尝试利用免疫佐剂或通过体外培养方法制备DC疫苗,用于促进DC的成熟,增强机体的免疫反应[6]。Toll样受体(Toll-like receptors,TLRs)是新近发现的天然免疫受体,表达于多种细胞,尤其是参与机体第一道防线的细胞,如DC、巨噬细胞和内皮细胞等,它们分别识别不同的外源性配体和/或内源性配体[7]。TLR 结合配体后,能通过一系列蛋白质级联反应激活转录因子NF-κB和Jun/Fos,引起 IL-1、IL-6、IL-12、IL-8、TNF-α及IFN-γ等细胞因子的释放,同时上调DC表面MHCⅠ、Ⅱ类分子和CD80、CD86等协同刺激分子的表达,促进DC成熟[8]。本研究拟通过TLR3激动剂poly(I∶C)联合TLR9激动剂(CpG ODN)促进负载凋亡CD34+白血病细胞的DC成熟,研究TLR激动剂对负载CD34+白血病细胞的DC的细胞形态及免疫表型的影响,从而优化免疫佐剂的选择和DC疫苗制备方案。
材料与方法
1 主要试剂 胎牛血清购自杭州四季青公司,人淋巴细胞分离液购自北京索来宝 (solarbio) 公司,CD14磁珠、CD34磁珠购自德国美天旎公司,CD11c-APC、CD14-PE、CD86-PE购自 eBioscience公司;细胞因子GM-CSF、IL-4、TNF-α均购自PeprTech 公司;RPMI1640 培养基购自 Hyclone 公司;poly I:C、CpG ODN 购自上海生工生物公司。
2 实验方法
2.1 DC的培养:抽取完全缓解期AML患者的新鲜外周血,肝素抗凝,分离PBMC,磁珠分选出CD14+单核细胞。用含10% FBS的RPMI 1640培养液分选的单核细胞的浓度调整为2×106/mL,置于6孔培养板中,加入GM-CSF 1000 U/mL、IL-4 500 U/mL,每48 h半量换液及添加细胞因子,48 h后同时加入TNF-α50 U/mL,将细胞培养板放入37℃含5% CO2的孵箱中继续培养,倒置显微镜观察每日细胞形态,第5天收集细胞。
2.2 CD34+白血病细胞的分选:采集初治的AML患者骨髓血,密度梯度离心法分离单个核细胞,磁珠分选出CD34+白血病细胞,无血清培养基中培养,1h后加入去甲氧柔红霉素(15 ng/mL)和蛋白酶体抑制剂(bortezomib,0.25 μM),18小时后,收集细胞。洗涤2次后,与DC按1∶2混合培养2 h。
2.3 TLR激动剂刺激培养DC:将负载凋亡CD34+白血病细胞的DC稀释成1×106/mL,实验分为四组:A对照组:仅加入培养介质;B组:加入TLR3激动剂(poly I∶C,50 μg/mL);C组:TLR9激动剂(CpG DNA,1 μmol/L);D组:加入TLR3激动剂(poly I∶C,50 μg/mL)联合TLR9激动剂(CpG DNA,1 μmol/L),72 h后收集细胞。
2.4 流式细胞仪检测DC细胞表型变化:收集各组细胞,离心(400 g,5 min,20℃)弃去上清,同超净台中取总细胞数约1×105置于流式管中,离心(400 g,5 min,20℃)弃上清,用PBS-E溶液漂洗2次,然后取分别加入5μL抗人CD11c、CD86,于37℃避光标记30 min,用PBS-E液洗涤细胞2次,最后用0.5 mL的PBS-E溶液悬浮细胞,流式细胞仪测定DC细胞表面CD11c、CD86的表达情况。
3 统计学分析 应用SPSS软件进行数据处理,结果以均数±标准差表示,多组均数比较在方差齐性时采用方差分析,两两均数比较采用t检验,应用FlowJo软件分析流式结果、Graphpad prism 5软件作图,P<0.05表示差异有统计学意义。
结 果
1 倒置显微镜40倍镜下观察 分离得到的CD14+单核细胞体积小,形态呈圆形,表面无突起,第3天,细胞体积增大,部分细胞悬浮,同时有小的突起;培养至第5天,可见大量细胞悬浮,细胞表面可见多个突起,同时实验组第8天生长状态明显较对照组好,且D组DC胞体体积更大,细胞膜表面有更明显的分枝状突起,呈集落分布,提示DC成熟度更高。图1为DC培养形态变化过程。
2 CD14+PBMC细胞纯度检测 因患者依从性,及最终经药物化疗可达到完全缓解且可顺利收集到标本等各种因素,最终纳入本研究的临床初发急性髓系白血病例数为3例,从PBMC中分选的CD14+细胞经流式细胞仪检测纯度为(97.62±1.32)%(见图2);待细胞成熟后再次检测DC表面CD14表达情况,其阳性表达为(3.74±1.35)%,而CD11c阳性表达为(76.36±1.52)%(见图3)。
3 DC表面CD11c检测结果 四组试剂组间CD11c经方差分析比较P值为0.006,差异有统计学意义(P<0.05),其中B、C、D三个亚组DC成熟后其表面CD11c表达分别是(95.86±1.57)%、(93.80±3.37)%、(98.83±1.56)%均高于A组(86.70±4.05)%,A、B两组均数t检验P值为0.04,差异有统计学意义(P<0.05),但A、C两组P值为0.13,差异无统计学意义(P>0.05);B、C两组均数t检验P值为0.13,差别无统计学意义(P>0.05);B与D两组均数比较、C与D两组均数比较,差异无统计学意义(P>0.05);A与D两组均数比较,P值为0.02,差异有统计学意义(P<0.05),见图4。
4 DC表面CD86检测结果 四组试剂组间CD86比较P值为0.001,差异有统计学意义(P<0.05),其中B、C、D三个亚组DC成熟后其表面CD86表达分别是(88.73±3.27)%、(87.17±3.07)%、(97.94±0.90)%均比A组(74.97±5.17)%高,A与B、A与C两组均数t检验P值为分别为0.02、0.04,差异皆有统计学意义(P<0.05);B、C两组均数t检验P值为0.65,差别无统计学意义(P>0.05);B、D两组均数t检验P值分别为0.003,C、D两组均数t检验P值为0.009,差异皆有统计学意义(P<0.05),见表1、图5。
讨 论
癌症免疫治疗是近几年尤为热门的治疗方式,肿瘤免疫治疗的主要策略是探索肿瘤特异性抗体的治疗潜力和细胞免疫效应机制。针对白血病患者的免疫治疗,旨在产生抗白血病T细胞反应,可为消除AML中微小残留(MRD)细胞提供一种新的治疗方法。白血病细胞有几种逃避免疫系统的途径,包括MHCⅡ类表达缺失,低水平表达的共刺激分子以及细胞抑制因子。目前临床上已开发出几种用于癌症免疫治疗的方法,包括树突状细胞的治疗性免疫接种。本课题组成员近年来在AML的免疫逃逸机制方面做了一定的研究,发现AML患者免疫功能受损可能与AML细胞分泌的可溶性因子直接抑制CD4+和CD8+T细胞的增殖,从而促进CD8+T细胞的凋亡有关[9]。
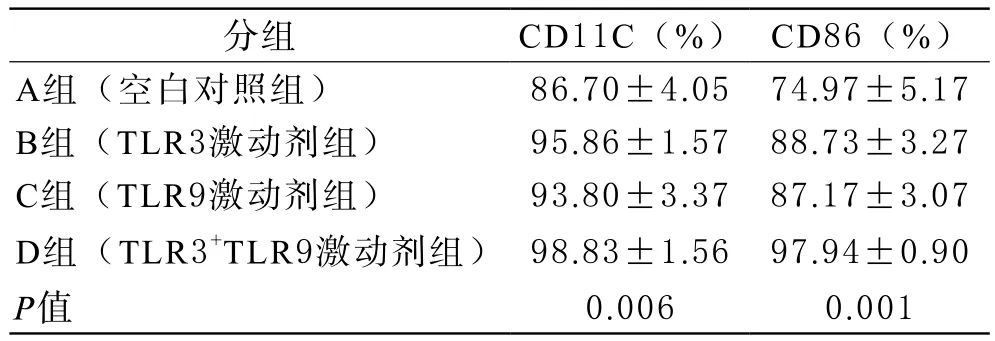
表1 不同方法刺激诱导DC成熟后表面标志物的表达(n=3)
树突状细胞有未成熟与成熟两种状态,未成熟DC起到抗原吞噬作用,而成熟DC起到抗原呈递作用,在肿瘤免疫应答中占有核心地位。DC的来源有骨髓血、脐血和外周血,本研究采用的DC前体细胞是Ficoll-Hypaque梯度离心法获得PBMC,再经MACS磁珠分选出CD14+外周单个核细胞,使用GM-CSF、IL-4 两种细胞因子促进CD14+PBMC向DC的分化,并培养未成熟的DC。未成熟DC可在TNF刺激下发展为高表达 MHC-II类分子、CD83、CD86、CD80的成熟的DC[10],CD14主要在单核细胞表面表达,但不在DC表面表达,本实验结果发现,经磁珠分选的方法获得的DC前体细胞CD14+PBMC纯度很高,经流式检测其纯度可达到95%以上,而后诱导培养的DC数量多,相对于传统的贴壁培养法,此法可更快速制备DC,可以为后续实验提供大量DC。CD11c是DC表面上的特征蛋白,它在未成熟和成熟的DC表面上高度表达。CD11c是用于实验研究中确定所研究CD11c是否为DC的重要鉴定标志,本研究中诱导的细胞中CD14阳性表达降为(3.74±1.35)%,但CD11c的阳性表达率可高达90%(图2),提示诱导得到的细胞绝大多数为DC。本实验中,poly(I∶C)单药诱导、CpG ODN单药诱导、两者联合诱导培养的DC成熟后其表面CD11c表达均比空白组高,这进一步说明随着DC由不成熟向成熟状态发展,其CD11c的表达会进一步升高。
佐剂和抗原共同递送到DC是启动免疫反应的关键。Poly(I∶C)是TLR3激动剂,TLR3主要由RNA病毒复制过程中产生的双链RNA(dsRNA)所触发,从而诱导Ⅰ型干扰素和细胞因子的产生,以及树突状细胞的成熟[11]。CpG ODN属于TLR9受体激动剂,能够刺激浆细胞样树突状细胞成熟和分泌IFN-α,诱导自然杀伤细胞产生IFN-γ并诱导单核细胞分化成树突状细胞。Zheng及其同事[12]发现CpG与poly(I∶C)的佐剂效应是在他们的小鼠肿瘤模型中获得显著肿瘤消退所必需的。在一项Ⅰ期实验中[13],29例患者接受CpG-28(TRL9激动剂)治疗,用于研究TRL9激动剂的临床安全性,原发性癌症为恶性胶质瘤、肺癌、乳腺癌、黑色素瘤或黑色素细胞瘤、室管膜瘤和结直肠癌,结果显示了良好的临床耐受性。
最初的一项研究[14]提示白血病转化的靶点是白血病原始细胞—白血病干细胞,通过对股骨移植的NSG小鼠更大样本量的仔细检测,证实了原始研究的基本结论:几乎在所有的样本中,LSC都存在于CD34+CD38-这一细胞群中,尽管如此,仍有近一半的样本中(>100个实验样本),LSCs至少还在一个其他亚群中被发现(通常是CD34+CD38+细胞群)[15]。人们还发现了LSC其他的表面抗原表达特征,如CD123+[16]、CD47-[17]、CD33+、CD133、CD96+[18]、IREM-1+和CLL-1+[19]等,这表明LSC的抗原表达是不确定的、多样的。故本实验选用CD34+白血病细胞作为靶细胞。
本研究应用TLR3激动剂联合TLR9激动剂刺激培养负载CD34+白血病细胞的DC成熟,CD11c、CD86的表型较刺激前表达显著增高,同时四组之间均数比较差异有统计学意义,这些结果表明,DC逐渐向成熟状态转化,TLR3与TLR9激动剂对DC的成熟有促进作用;同时本实验中结果显示,TLR9激动剂单药诱导组较空白对照组与较TLR3与TLR9激动剂联合刺激组的DC表面CD11c阳性表达相比差异均无统计学意义,TLR3激动剂单药诱导组TLR3与TLR9激动剂联合刺激组的DC表面CD11c阳性表达相比差异无统计学意义,TLR3激动剂单药诱导组与TLR9激动剂单药诱导组的DC表面的CD11c、CD86阳性表达相比差异也无统计学意义,这可能与样本数较少有关,但CD11c的表达是明显增高的,空白对照组与TLR3与TLR9激动剂联合刺激组的DC表面CD11c阳性表达差异有统计学意义,空白对照组与TLR3与TLR9激动剂联合刺激组的DC表面CD86阳性表达差异也有统计学意义;且TLR3激动剂单药诱导组较空白对照组与TLR3与TLR9激动剂联合刺激组的DC表面CD86阳性表达相比差异均存在统计学意义,联合刺激组CD11c、CD86的表型较单药刺激组表达显著增高。
综合以上结果,说明poly(I∶C)与CpG ODN联合应用可以激活TLR信号通路,促进DC的成熟,提示TLR3激动剂与TLR9激动剂在促DC成熟时可能具有协同作用;TLR3激动剂及TLR9激动剂作为DC佐剂,具有临床应用前景。本课题将进一步研究其诱导CD8+CTL生成,增强CTL细胞对肿瘤细胞的杀伤功能。