双波长可见吸收光谱法测定糕点及碳酸饮料中的苯甲酸
江虹, 庞向东, 曾晓莎
(长江师范学院 化学化工学院,重庆, 408100)
苯甲酸和山梨酸作为常用食品添加剂,具有保持食品营养、防止食品腐败变质,提高食品质量的作用。但当过量使用时,则具有一定的毒性,对食用者的健康会造成一定的危害。为此,世界各国对食品中某些添加剂的使用量和残留量均作了严格规定。我国食品安全国家标准食品添加剂使用标准GB 2760—2014中,对各种食品中苯甲酸的最大使用量有严格规定。鉴于此,对食品中的防腐剂含量进行研究有着重要意义。近年,国内外对食品中苯甲酸的检测方法主要有:高效液相色谱法[1-9],气相色谱法[10-11], 电化学法[12-13]、气-质联用法[14-16]、液-质联用法[17-21]和紫外分光光度法[22-24]等。高效液相色谱法、气相色谱法、气-质联用、液-质联用等方法的前处理较为麻烦,日常运行费用较高,电化学法条件要求较苛刻,已报道的紫外分光光度法线性范围窄、灵敏度不高。因此,研究更为简便、快速和灵敏的方法有着重要意义。本实验发现,在一定的Tris-HCl 介质中,苯甲酸能与乙基紫反应(在可见光区产生较强的负吸收信号),而食品中可能共存的山梨酸(sorbic acid,SBA)在相同条件下与乙基紫反应则基本无吸收。基于这一点,建立了不需分离山梨酸即可测定苯甲酸的双波长可见吸收光谱法,方法用于糕点及碳酸饮料中苯甲酸的测定,结果满意。
1 材料与方法
1.1 材料与试剂
苯甲酸(benzoic acid,BZA)(≥99%),成都化夏化学试剂有限公司;山梨酸(sorbic acid,SBA):(99.8%),上海迈瑞尔化学技术有限公司;乙基紫(ethyl violet,ETV):(AR级),上海迈瑞尔化学技术有限公司;三羟甲基氨基甲烷(Tris):(AR级),山东西亚化学工业有限公司;HCl:(AR级),重庆川东(化工)集团有限公司;样品,市售碳酸饮料(简写为1 # 和2#)、蛋糕(简写为3#)和面包(简写为4#)。
BZA 标准溶液:准确称取适量纯度≥99% 的BZA(精确至±0.000 1 g),用少许无水乙醇溶解后,用水定容,配成1.00×10-3mol/L贮备液,操作液为1.00×10-4mol/L。SBA 标准溶液:准确称取纯度为99.8% 的SBA 适量(精确至±0.000 1 g),用少许无水乙醇溶解,用水定容,配成1.00×10-3mol/L贮备液,操作液为1.00×10-4mol/L;ETV 溶液:1.00×10-3mol/L;Tris 溶液:0.20 mol/L;HCl 溶液:0.10 mol/L。Tris-HCl 溶液:pH 3.0~9.8(用pH 计测定)。
1.2 仪器与设备
U-3010型紫外-可见分光光度计,日本日立公司;EL104型电子天平,上海精密仪器仪表有限公司;pHS-3C 精密酸度计,上海虹益仪器仪表有限公司;TD5A-WS 型离心机,湖南湘仪离心机仪器有限公司;KQ-200VDE 超声波清洗机,昆山市超声仪器有限公司。
1.3 样品处理
准确移取1# 和2# 碳酸饮料10 mL 于小烧杯中,40 ℃水浴超声20~30 min,除去CO2后冷至室温,用水定容于100 mL容量瓶中,摇匀,即为碳酸饮料待测液。
准确称取已粉碎混匀的糕点样品3# 和4# 各2~3 g(精确至±0.000 1 g)于50 mL 烧杯中,加适量水,40℃ 超声提取20~30 min 后,移入离心管中,以4 000 r/min 离心分离10 min,清液转入100 mL 容量瓶中,用水定容。
1.4 实验方法
准确移取pH 8.54 Tris-HCl 溶液1.00 mL、ETV 溶液2.00 mL于10 mL 比色管中,摇匀后加入0~1.00 mL 1.00×10-4mol/L BZA 标准操作溶液,摇匀,用水定容至刻度。静置10 min 后,以试剂空白作参比,扫描吸收光谱,在497 nm 和628 nm 处,用双波长法测定溶液的吸光强度A。
2 结果与分析
2.1 BZA及SBA与ETV的吸收光谱特征比较
图1和表1是苯甲酸体系的吸收光谱特征及可能共存物山梨酸体系的吸收光谱特征比较。由图1和表1可知,单独的BZA 和SBA 在可见光区几乎无吸收,在紫外区有较强吸收(曲线1 和2)。ETV 的弱碱性溶液有强吸收(曲线3),最大吸收波长位于594 nm。在ETV 的弱碱性(pH 8.54)溶液中加入SBA 溶液后,SBA 体系溶液在可见光区几乎无吸收,在紫外区有较强吸收(曲线4)。当在与SBA 体系相同条件的ETV 弱碱性溶液中加入与SBA 同浓度的BZA 溶液后,ETV 体系溶液在可见光区产生2 个较强的负吸收峰,最大负吸收峰位于497 nm(蓝移97 nm);次大负吸收峰位于628 nm,(红移34 nm)(曲线5),并使溶液发生褪色现象。由图2可知,BZA 体系在497 nm 和628 nm 处,BZA 的浓度与吸光度的绝对值(│A│)有线性关系,并服从朗伯-比尔定律。由上可见,在pH 8.54 的Tris-HCl 介质中,山梨酸-乙基紫体系在可见光区几乎无吸收,而同条件下的苯甲酸-乙基紫体系在可见光区不仅有较强的负吸收,而且遵从朗伯-比尔定律,可用于苯甲酸的定量分析。故当山梨酸与苯甲酸共存时,可以不经分离直接测定苯甲酸。为了提高方法的灵敏度,本工作采用497 nm 和628 nm 处的双波长(DWO-VIS)法(吸光度具有加和性)来定量测定苯甲酸,其灵敏度约为单波长法的2倍。

1-1.00×10-5 mol/L 山梨酸, 水作参比; 2-1.00×10-5 mol/L苯甲酸, 水作参比; 3-2.00×10-5 mol/L 乙基紫, 水作参比;4-1.00×10-5 mol/L 山梨酸-2.00×10-4 mol/L 乙基紫,试剂空白作参比;5-1.00×10-5 mol/L 苯甲酸 - 2.00×10-4 mol/L乙基紫, 试剂空白作参比; pH 8.54

1~5-0.20、0.40、0.60、0.80、1.00 mL 1.00×10-5 mol/L苯甲酸-2.00×10-4 mol/L 乙基紫, 试剂空白作参比; pH 8.54
2.2 反应的适宜条件
2.2.1 溶液pH 的选择
考察了BZA-ETV体系及可能共存物SBA-ETV体系在其他条件相同的情况下,不同pH的Tris-HCl溶液对各体系吸光度绝对值(│A│)的影响(497 nm和628 nm处),见图3。由图3可知,BZA-ETV体系受酸度影响较大,当方法的灵敏度相对最大时,在497 nm和628 nm处的最佳酸度为pH 8.54,此条件下BZA与ETV能反应完全。当pH大于或小于8.54时,由于体系碱性偏大或酸性偏强(未达理想酸度)均不能使BZA与ETV间的反应完全(即只能部分反应),因而│A│有所降低。而SBA-ETV体系在碱性范围内,│A│(很低)基本不受酸度的影响,而在酸性条件下对│A│有一定影响。酸度对BZA体系与SBA体系所产生的不同影响,是由于BZA与SBA结构差异所致。由此可见,只要控制好溶液的酸度(控制在碱性范围内),即可实现不分离山梨酸(可能的共存物)便可直接测定苯甲酸的目的。为了提高方法的灵敏度,采用DWO-VIS法定量测定苯甲酸。
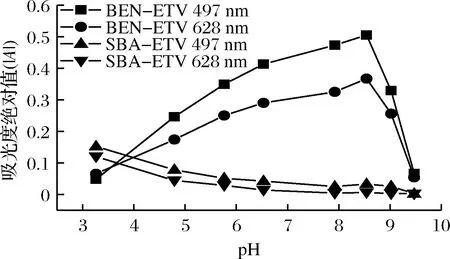
图3 pH对│A│的影响

表1 苯甲酸-乙基紫体系与山梨酸-乙基紫体系吸收光谱特征
注:—表示基本无吸收。
2.2.2 pH 8.54 Tris-HCl 溶液用量的选择
考察了室温下497 nm 和628 nm 处,pH 8.54 Tris-HCl 溶液的用量对BZA-ETV 体系│A│ 的影响,见图4。由图4可知,pH 8.54 Tris-HCl 溶液用量为1.00 mL 时,体系│A│ 相对最大,即灵敏度最高。当pH 8.54 Tris-HCl 溶液用量大于或小于1.00 mL 时,因用量过多或过少(即条件不合适)而使反应不发生或部分发生,从而使│A│ 降低;故实验用1.00 mL pH 8.54 Tris-HCl 溶液。
2.2.3 ETV溶液浓度的选择
考察了室温下497 nm和628 nm处,ETV溶液浓度(取ETV溶液0.50、1.00、1.50、2.00、2.50、3.00、3.50、4.00 mL)对BZA-ETV 体系│A│的影响,见图5。由图5可知,灵敏度最大时,ETV溶液的浓度为2.00×10-4mol/L。当ETV 溶液浓度小于2.00×10-4mol/L时,因ETV用量不够使反应不能完全,从而导致│A│有所降低;当ETV溶液浓度大于2.00×10-4mol/L 时,因ETV用量过多使自身聚集作用增强,从而使BZA 和ETV 的反应不能完全,导致│A│降低。故实验取1.00×10-3mol/L乙基紫溶液2.00 mL。
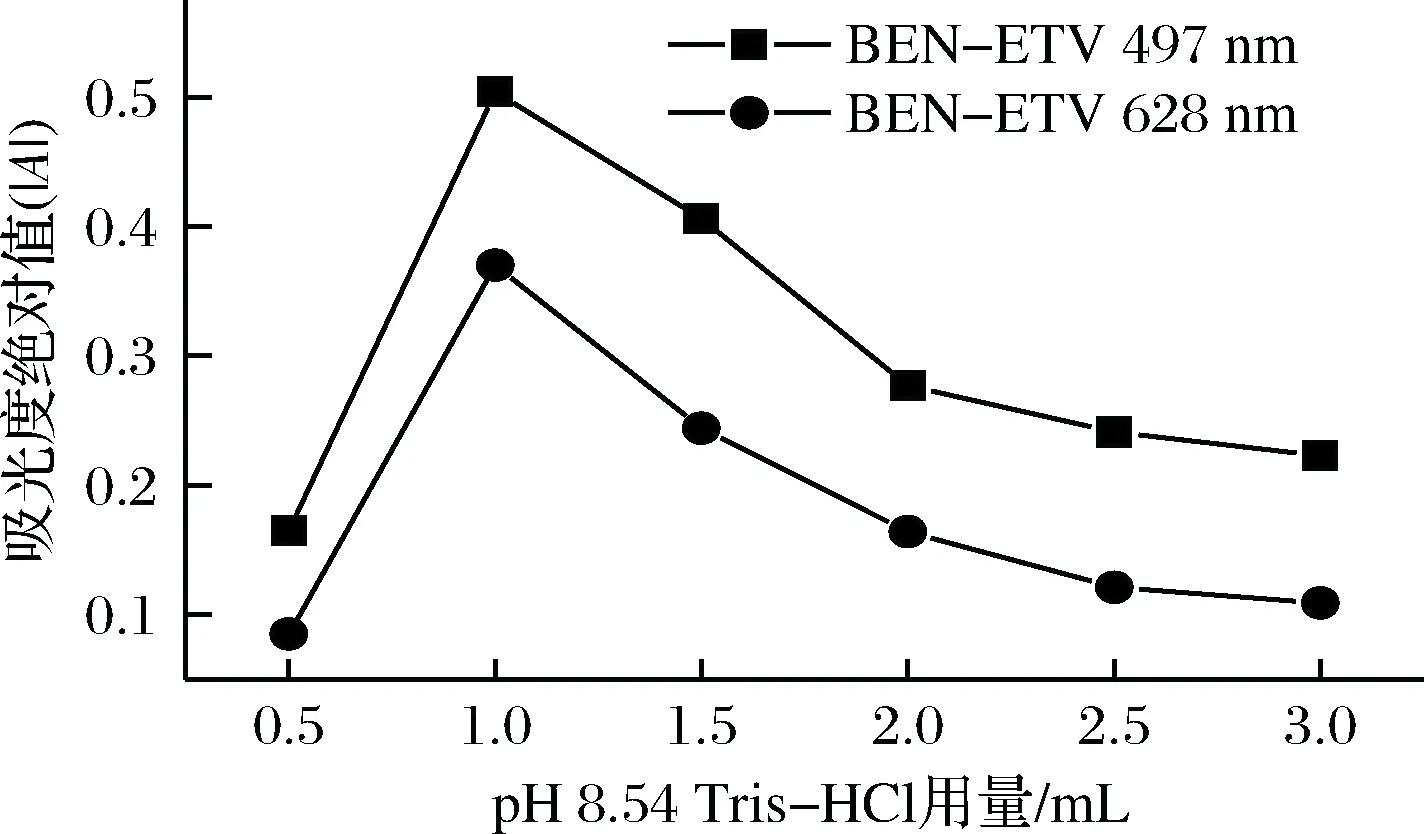
图4 pH 8.54 Tris-HCl 用量对│A│的影响

图5 乙基紫溶液浓度对│A│的影响
2.2.4 试剂加入顺序的选择
考察了室温下497 nm 和628 nm 处,1.00 mL BZA标准溶液、2.00 mL ETV 溶液及1.00 mL pH 8.54 Tris-HCl 溶液为不同加入顺序时对BZA-ETV 体系│A│ 的影响。结果表明,试剂加入的先后顺序对BZA 与ETV 的反应完全程度有一定影响。当灵敏度相对最大时的加入顺序是:Tris-HCl 溶液、ETV 溶液、BZA 溶液(A497=-0.498,A628=-0.368)。故实验按最佳顺序进行。
2.2.5 反应时间及稳定性
考察了室温下497 nm 和628 nm 处,BZA 与ETV 反应时间对体系│A│ 的影响。结果表明,该反应在10 min内可进行完全,10 min时,A497=-0.504,A628=-0.370;10~100 min,│A│ 基本处于平稳状态;100 min后,│A│有下降趋势。故实验选在10 min后的平稳区进行测定。
2.3 工作曲线及相关参数
依照前面各项选定的最佳条件,取0.00、0.20、0.40、0.60、0.80、1.00 mL 1.00×10-4mol/L BZA 标准操作液,配制标准系列溶液,并用DWO-VIS 法测定各溶液的吸光度,作A497+628-ρ标准曲线,见图6,相关参数见表2。可知,用双波长法测定的灵敏度约是单波长法测定的2倍,即双波长法能有效提高方法的灵敏度。后续实验均用双波长法进行测定。
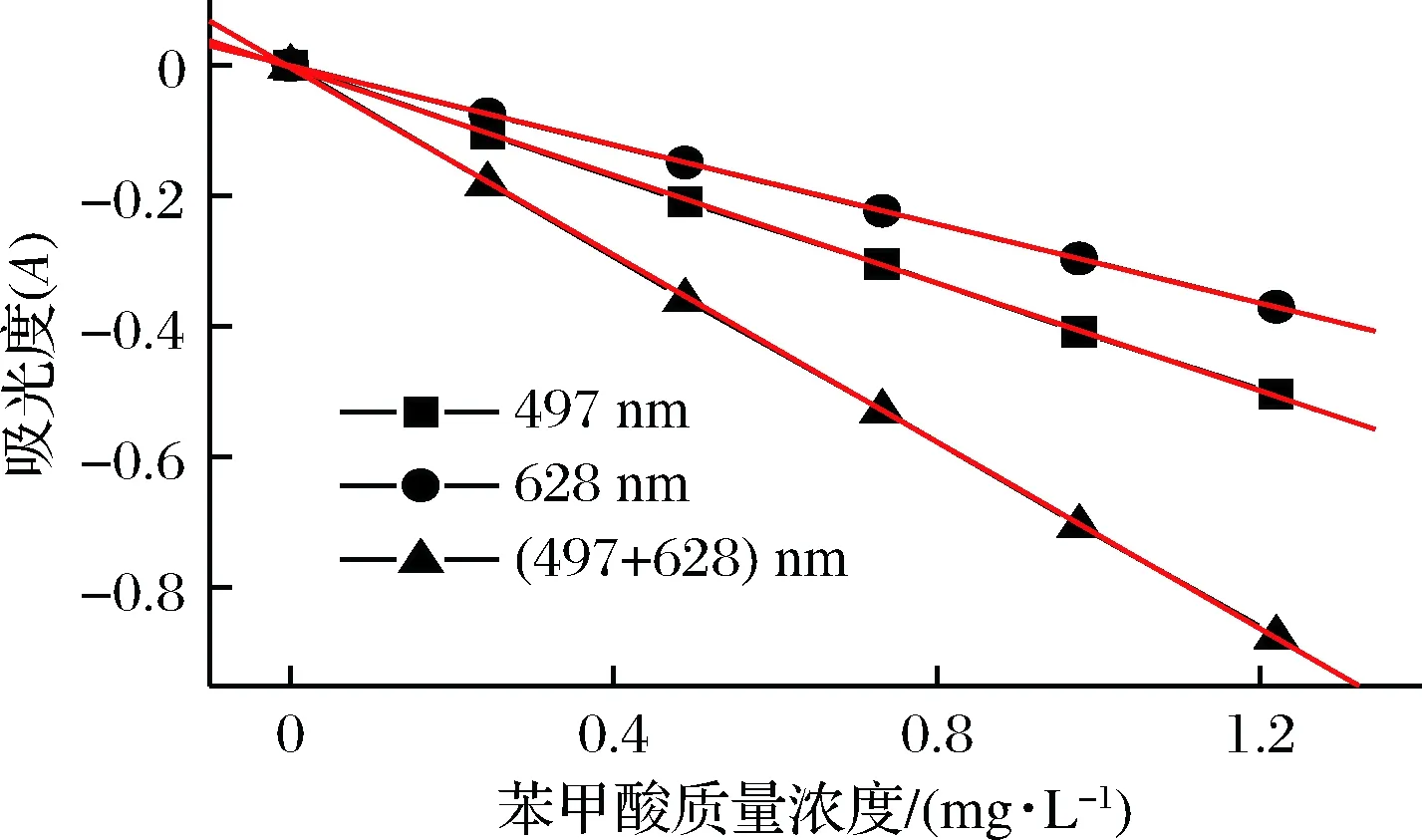
图6 苯甲酸的标准曲线
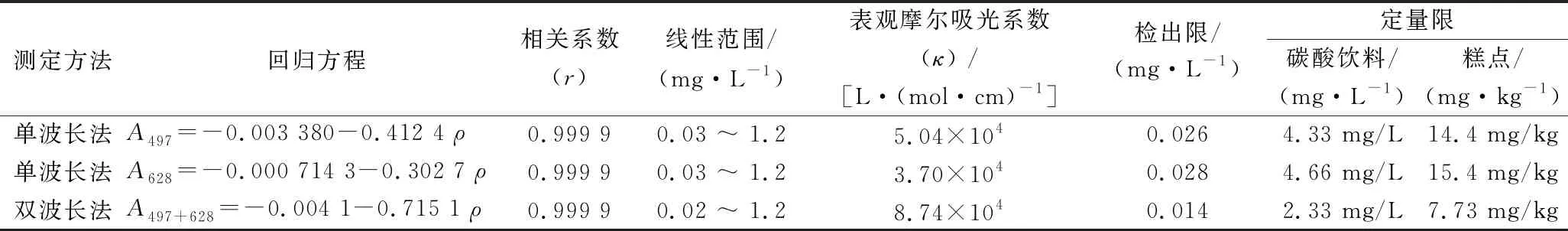
表2 标准曲线相关参数
2.4 共存物质的影响
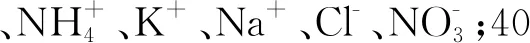
2.5 样品分析
取1.3 节已处理的1# 待测液2.00 mL、2#~4# 待测液各3.00 mL 分别代替1.4 节中的苯甲酸标准溶液,再按1.4 节方法加入其他试剂溶液并定容至10 mL。借助标准曲线或回归方程,用双波长法测定待测样液及原始饮料及糕点中的苯甲酸含量。各样液平行测定5份。结果见表3。
为了判断新方法的准确度,续做加标回收试验。准确移取各原始碳酸饮料10 mL 或准确称取糕点样品2~3 g(精确至±0.000 1 g),加入高、中、低 3 水平的苯甲酸标准溶液后,按1.3 节的方法处理样品,再用水定容于100 mL 容量瓶中,各水平平行配制5 份。测定结果见表3。表中数据表明,本法有较高的准确度和精密度。

表3 碳酸饮料及糕点样品分析结果及回收试验(n=5)
注:ND 为未检出;样品含量<检出限的按检出限的1/2 计算回收率。
3 结论
以乙基紫作显色剂,在可见光区测定苯甲酸的双波长吸收光谱法,操作简便、快速,有较高的准确度、精密度及灵敏度,也有良好的选择性及较宽的线性范围(较文献[23-24]的线性范围宽)。样品前处理简单,测定过程中,样液不需分离,可直接测定样品中的苯甲酸。本方法适于糕点及饮料中苯甲酸的快速测定。

