2019 年全球新药研发报告(Ⅳ)
(科睿唯安 )
(接2020 年第8 期)
16 代谢疾病药物
骨质疏松症是一种年龄相关性很强的疾病,由骨重建生理过程中的不平衡所致。长期以来,骨质疏松症的主要治疗药物始终是雌激素、双膦酸盐和抗RANKL 抗体狄诺塞单抗,这些药物均为减少骨吸收,从而减缓骨流失。但在合成代谢药物领域的新药较少,即促进新骨形成的药物。2019 年,一种具有合成代谢活性的全球首创新药在日本获批上市,即抗硬化蛋白单克隆抗体romosozumab(Evenity;UCB/Amgen Astellas BioPharma)。骨硬化蛋白是一种骨形态发生蛋白拮抗剂,可抑制骨祖细胞分化并降低成骨细胞活性。骨硬化蛋白由埋在骨基质中的骨细胞产生的SOST基因表达,是骨形成的强效抑制剂。成骨细胞被埋入矿化骨基质后,转变为骨细胞,并开始表达控制骨形成和磷酸盐代谢的硬化蛋白。Romosozumab 和其他抑制骨硬化蛋白的药物均可增强成骨细胞功能,从而同时促进骨形成和抑制骨吸收。Romosozumab 在日本的适应证为存在骨折高风险的男性和绝经后女性的骨质疏松症。2019 年下半年,romosozumab 在美国获批上市,用于治疗存在骨折高风险的绝经后女性,或其他现有骨质疏松症治疗失败或不耐受的骨质疏松症患者。
急性肝卟啉症(AHP)是一类极其罕见的遗传性疾病,以可能危及生命的发作为特征;对于一些患者而言,慢性的临床表现对日常功能和生活质量会带来不利影响。AHP 分为4 种类型:急性间歇性卟啉症、遗传性粪卟啉症、混合型卟啉症和ALA 脱水酶缺乏性卟啉症。每种类型的AHP 的病因均为遗传缺陷导致肝脏血红素生物合成通路的某种酶缺乏所致。2019 年,FDA 批准Alnylam Pharmaceuticals公司的givosiran(Givlaari)用于治疗成人AHP,该药是一种靶向5-氨基乙酰丙酸合酶1(ALAS1)的小干扰RNA(siRNA)。该药物经优先审评后,基于一项在94 例AHP 患者的Ⅲ期ENVISION 研究(NCT03338816)的结果,于2019 年11 月获批。在一项关键性随机双盲安慰剂对照的多国研究中,AHP 患者接受givosiran 治疗后,卟啉症的发作次数相较安慰剂治疗组患者减少70%。同样,该药物治疗还可以减少静脉输注血红素的用量,而且尿氨基乙酰丙酸和尿卟胆原的水平也有所下降。与治疗相关的最常见不良反应为恶心(27%)和注射部位的反应(25%)。
2019 年5 月,Ionis Pharmaceuticals 及 其 全资子公司Akcea Therapeutics 获得了volanesorsen(Waylivra)在欧盟有条件的上市许可,该药适用于作为基因检测确认家族性乳糜微粒血症(FCS)且胰腺炎风险较高的成人患者的饮食辅助治疗,这些患者对饮食限制和降脂治疗的应答不足。FCS 是一种罕见的常染色体隐性遗传病,由脂蛋白脂肪酶突变引起,进而导致血浆中乳糜微粒蓄积和高三酰甘油血症[34]。在高三酰甘油血症的并发症中,急性胰腺炎是最为严重的一种。Volanesorsen 是一种反义寡核苷酸,旨在减少载脂蛋白C-III(ApoC-III)的生成,而ApoC-III 是一种调节血浆三酰甘油的蛋白。作为有条件上市许可的一部分,Akcea 和Ionis公司基于临床试验登记将进行一项非干预性的许可后安全性研究(PASS)。Ⅲ期临床APPROACH 研究(NCT02211209)是迄今为止针对FCS 患者进行的最大规模的研究;在该研究中,与安慰剂相比,反义药物治疗导致具有临床意义和统计学意义的血浆三酰甘油水平降低。对有复发性胰腺炎病史的患者的分析显示,与安慰剂治疗组患者相比,接受volanesorsen 治疗的患者中胰腺炎发作率显著降低。APPROACH 试验中最常见的不良事件是注射部位反应和血小板水平降低。由于FCS 是一种尚无有效治疗方案的罕见病,volanesorsen 的研发获得了多个监管项目的支持,包括欧盟和美国的孤儿药资格认定以及英国突破性创新药物(PIM)资格认定。该产品于2019 年8 月在德国和法国上市。2019 年上市新药完整清单详见表3。

表3 2019 年新批准药物Table 3 New drugs approved in 2019

续表3

续表3
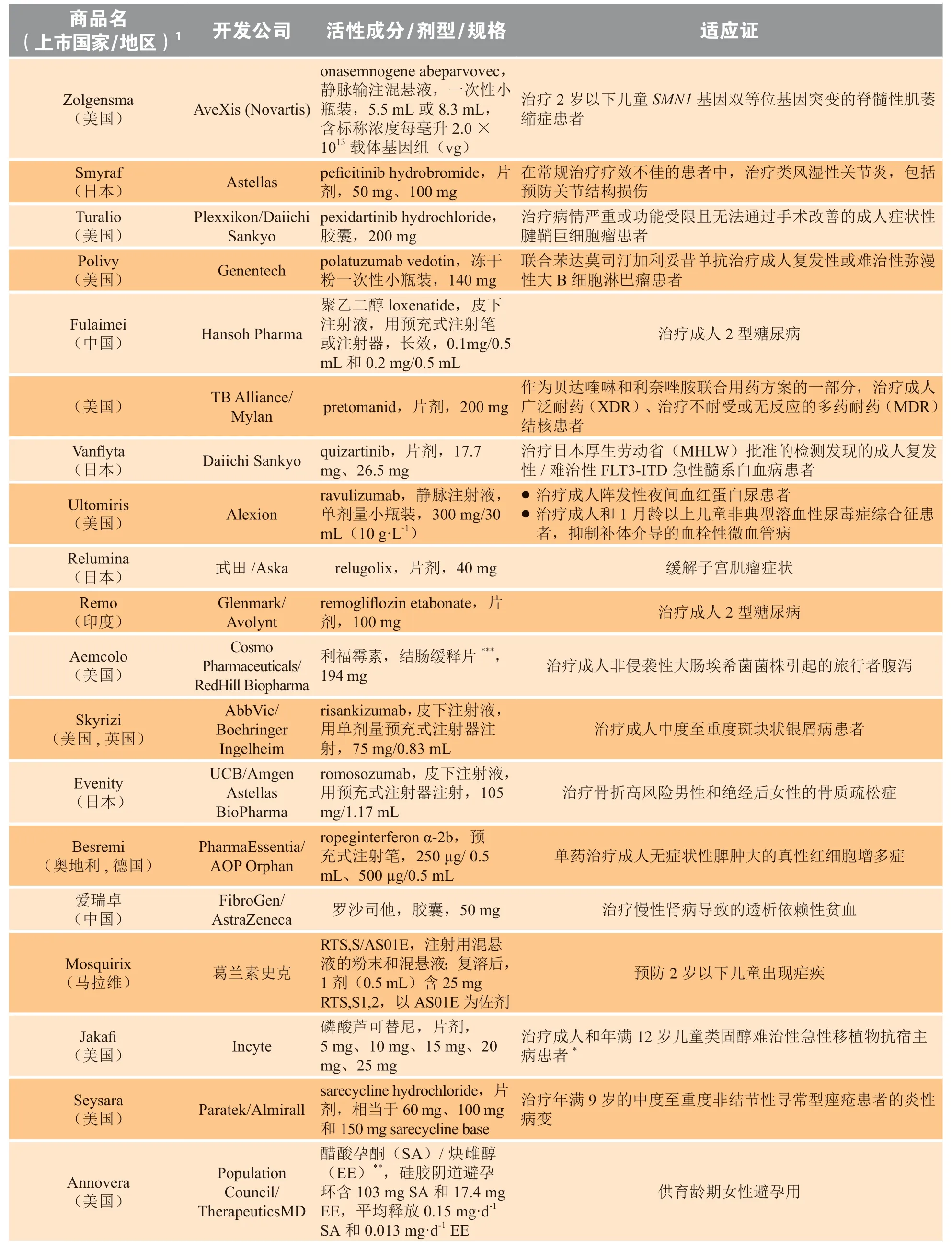
续表3

续表3
17 展望
根据Cortellis 早期药物研发情报和Cortellis 综合性竞争情报的分析,我们期待以下药物和生物制品将会是2020 年度本系列文章的讨论内容。
AR-101(Palforzia;Aimmune Therapeutics)是一种由花生衍生物的口服免疫治疗药物,有望成为首个获批用于花生过敏脱敏治疗药物。2019 年9 月,FDA 过敏产品咨询委员会建议批准该药品用于4~17岁儿童。生物制品许可申请(BLA)的审评目标日期为2020 年1 月下旬。
Horizon Therapeutics 公司的teprotumumab 是一种针对人胰岛素样生长因子1 受体(IGF-1R)的人源化单克隆抗体,将成为活动性甲状腺眼病(又称Graves 眼眶病)的首款治疗药物。2019 年12 月,FDA 皮肤和眼科药物咨询委员会一致投票支持批准该药物上市。FDA 已于2020 年1 月中旬批准teprotumumab,早于PDUFA 目标日期(3 月8 日)。
预计FDA 将在2020 年批准Sunovion 公司上市dasotraline,一种新型多巴胺和去甲肾上腺素再摄取抑制剂(DNRI),用于治疗中度至重度暴食症(BED)患者,BED 是一种严重的心理疾病且治疗方案有限。BED 特征为反复和持续的暴食,其定义为在短时间内摄入大量食物,发作期间感觉失控,之后有强烈羞愧感、内疚感和窘迫感。
2019 年11 月,罗氏宣布FDA 已接受diplrisam新药申请NDA,并授予其优先审评资格,该药是一种试验性运动神经元生存基因-2(SMN-2)剪接修饰剂,用于治疗脊髓性肌萎缩症(SMA)。Risdiplam 可增加并维持中枢神经系统(CNS)和身体外周组织中的SMN 蛋白水平。FDA 预计将于2020 年5 月24 日前作出批准决定。在此期间,罗氏计划针对合格的1 型SMA 患者开展一项全球患者同情用药项目。
EMA 正在审查Hansa Biopharma 公司的imlifidase的上市许可申请(MAA),该药的适应证为肾移植患者术前的脱敏治疗。Hansa Biopharma 于2019 年12 月22 日提交了对第120 天问题的回复,审评过程在按计划进行。该公司表示,预计CHMP 将于2020 年第2 季度给出意见,随后欧盟委员会可能于2020 年夏季做出决定。有关这些药物和其他2020年预测的概述详见表4。
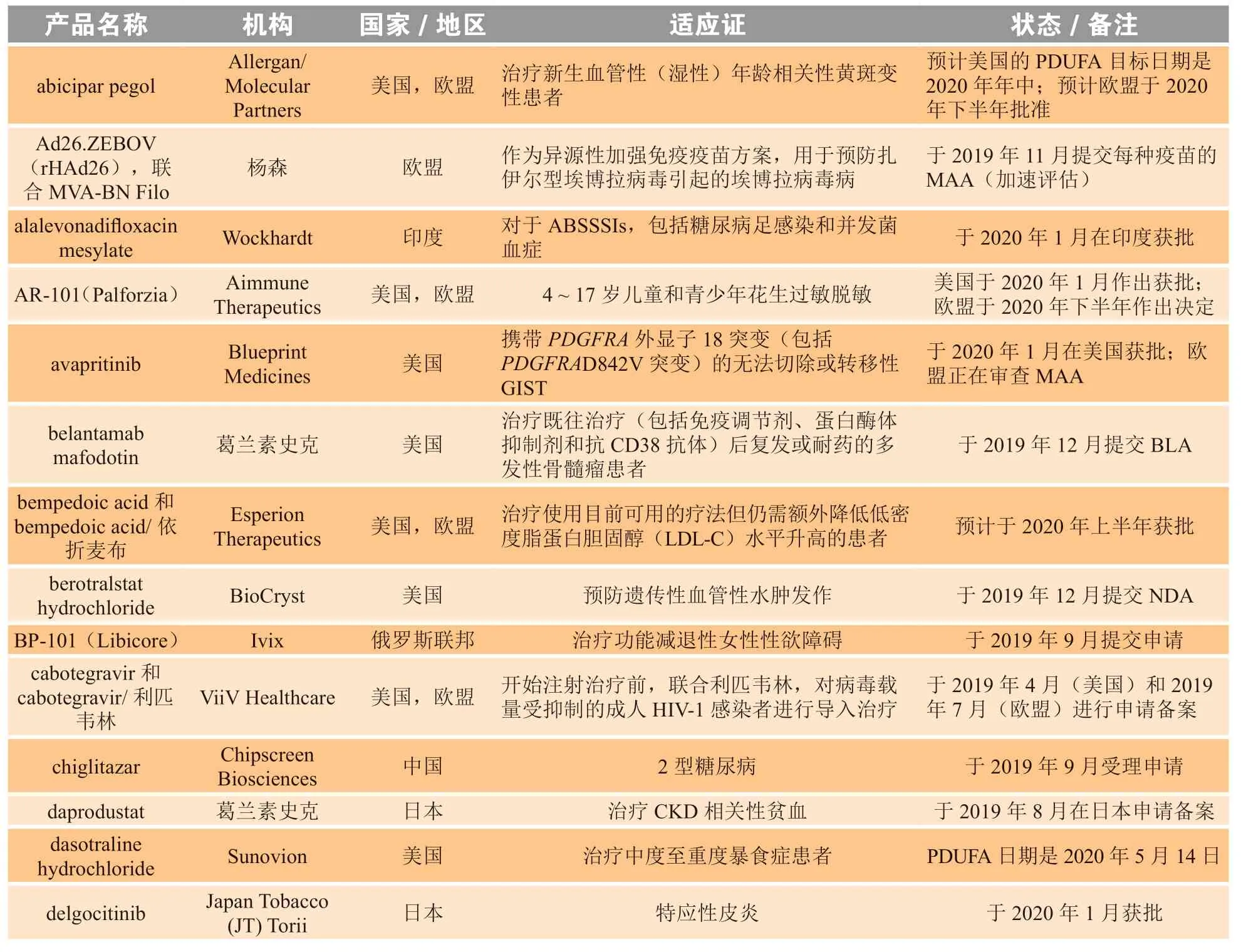
表4 2020 年批准及候选药物批准情况Fable 4 Approvals and candidates for approval in 2020

续表4

续表4

续表4
声明:本文作者均为科睿唯安公司的工作人员。

