红曲霉对类Camembert干酪成熟期质构和风味的影响
王 童,逄晓阳,芦 晶,马长路,杨宝雨,吴 政,梁佳祺,张书文*,吕加平*
(中国农业科学院农产品加工研究所,北京 100093)
霉菌干酪在成熟过程中发生的一系列酶促反应和化学变化对干酪的质构和风味会产生重要的影响。目前,商品霉菌干酪加工过程中使用的霉菌菌种主要有卡地干酪青霉(Penicilliumcamemberti)、娄地青霉(P.roqueforti)和白地霉(Geotrichum candidum),这些菌种可以通过商业渠道购买获得[1]。霉菌干酪包括表面霉菌成熟型和内部霉菌成熟型,表面霉菌成熟型干酪(如Camembert干酪、Brie干酪)的特征是成熟后其表面覆盖一层霉菌,外表稍硬,内部质地柔软;内部霉菌成熟型干酪(如蓝纹干酪等)在生产过程中需要穿孔,以利于空气进入凝乳中,带入霉菌的孢子,成熟后干酪内部会形成有色的霉纹。近几年来,Camembert干酪因成熟期短、酶解程度高、功能性强而备受关注。
关于霉菌干酪,国内外已有大量的研究,主要集中于成熟过程中干酪的理化和风味变化以及这些变化与干酪发酵的乳酸菌、酵母和霉菌发酵剂之间的关系,研究人员希望通过了解干酪成熟的机理,从而筛选出有益于干酪成熟和功能性的发酵菌种。Kawai等研究了从不同国家的Camembert干酪、Brie干酪、Coulommiers干酪和Chaource干酪中筛选的6 株白地霉,对菌株所产香气进行比较,并对单菌种生产的表面霉菌成熟干酪产品进行感官比较,最终认为来自法国Camembert干酪的白地霉获得的结果最满意[2];Leclercq-Perlat等研究了Camembert干酪成熟期理化性质、风味物质和微生物菌群的,并将这些指标建立一定的联系[3];Voigt等研究了高压处理牛乳对Camembert干酪成熟期品质的影响[4];Lee等将韩国传统的红参粉加入Camembert干酪中以改善其功能特性[5]。刘南从传统腐乳中分离出的毛霉应用于Camembert干酪的生产[6];Chen Lishui等从129 株酵母中筛选出3 株有潜在益生功能的菌株应用于Camembert干酪的生产[7];Yu Huaning等将红曲霉应用于Camembert干酪中制备红曲干酪[8]。这些研究已取得一定进展,但对成熟过程中干酪质构和风味的变化规律还有待进一步研究。
红曲霉在食品中的应用已有上千年的历史,主要用于腐乳、红曲米(粉)、红曲酒和红曲醋等传统食品,红曲类产品因其天然的红色色泽以及特有的风味而广受中国消费者欢迎。许多研究结果还表明,红曲霉发酵产物中含有多种生物活性物质,如莫纳卡琳K、γ-氨基丁酸、红曲色素和红曲多糖等,所以红曲霉发酵食品在食品工业中被广泛用作着色剂、防腐剂、营养补充剂,其还可用于医药行业作为膳食补充剂,在预防治疗高血压、降低胆固醇水平、改善血液循环系统等方面都有很好的效果[9-11]。因此,应用来源于腐乳中的红曲霉作为辅助发酵剂改善类Camembert干酪的风味和品质,不仅能够丰富我国天然干酪的品种,提高我国消费者对干酪接受度,而且对我国天然干酪开发具有重要意义。
本实验以生牛乳为原料,以霉菌干酪的加工工艺为基础,通过添加或不添加红曲霉分别制作两种不同的类Camembert干酪,在两种酪成熟期的第0、8、16、24、32、40天分别进行取样,通过水分质量分数、蛋白水解度、质构和风味参数,对比分析在40 d的成熟期两种干酪质构和风味的变化以及红曲霉对类Camembert干酪成熟期质构和风味的影响。
1 材料与方法
1.1 材料与试剂
牛乳购于北京市三元绿荷牧场;FD-DVS R-704-乳酸菌发酵剂、CHY-MAX POWDER EXTRA NB凝乳酶科汉森中国有限公司;CHOOZITTMPC 12 LYO 20D卡地干酪青霉 丹尼斯克中国有限公司;红曲霉菌种(保藏号5038,菌种来源为腐乳)购自中国工业微生物菌种保藏管理中心。
1.2 仪器与设备
DELTA 320 pH计 梅特勒-托利多仪器(上海)有限公司;YQ1-57乳成分体细胞检测仪、BSA124S-CW型电子天平 赛多利斯科学仪器(北京)有限公司;TA-XT2i质构仪 英国Stable Micro Systems公司;PEN-3型便携式电子鼻 德国Airsense公司;QP2010Plus气相色谱-质谱联用仪 日本岛津公司;DHG-9146A型电热恒温鼓风干燥箱 上海精宏试验设备有限公司;HDL超净工作台 北京东联哈尔仪器制造有限公司;LHS150/250 HC-II恒温恒湿箱 上海一恒科学仪器有限公司;DK-S24电热恒温水浴锅 上海森信实验仪器有限公司;干酪槽、干酪刀、干酪板、模具等为自制。
1.3 方法
1.3.1 原料乳品质检测
采用乳成分体细胞检测仪以对牛乳中的蛋白、脂肪、乳糖水平及体细胞数进行检测,酸度测定采用GB 5009.239ü2016《食品安全国家标准 食品酸度的测定》中的方法;菌落总数测定采用GB 4789.2ü2016《食品安全国家标准 食品微生物学检验 菌落总数测定》中的方法。
1.3.2 霉菌干酪加工工艺
原料牛乳→标准化→杀菌(75 ℃、15 s)→冷却(32 ℃)→接种乳酸菌发酵剂(1.5 g/100 L)→添加霉菌发酵剂(106CFU/L)、红曲霉发酵液(白霉干酪不添加红曲霉发酵液)(体积分数3%)→发酵1 h(34 ℃)→加凝乳酶(40 IMCU/L)→切割→搅拌→入模排乳清→表面盐渍(涂抹质量分数1%的食盐,16~18 ℃盐渍2 h)→成熟12 d(12~14 ℃、相对湿度95%)→蜡纸包装→4 ℃存放后熟28 d
根据以上方法,制得两种干酪,仅接种卡地青霉制得白霉干酪、接种卡地青霉和红曲霉制得红曲干酪。两种干酪的成熟期均为40 d,在成熟期的第0、8、16、24、32、40天分别对干酪进行取样,探究其质构和风味随成熟时间的变化。
1.3.3 红曲霉发酵液制备
将红曲霉在PDA培养基培养3~4 d后,用无菌水洗涤收集孢子得到浓度为1.0h105CFU/mL的孢子液,以体积分数5%的接种量接种到已灭菌质量分数5%马铃薯全粉溶液中,30 ℃、200 r/min摇瓶培养4 d,得到色值40 U/mL的红曲霉发酵液。
1.3.4 干酪水分测定
采用GB 5009.3ü2016《食品安全国家标准 食品中水分的测定》中对半固体样品的测定方法。
1.3.5 干酪蛋白水解度测定
蛋白质水解的测定参照Chen Lishui等[7]的方法,pH 4.6酸溶性氮(acid soluble nitrogen,ASN)的测定:准确称取0.75 g干酪样品,加入25 mL pH 4.6的醋酸盐缓冲溶液,充分研磨,制成悬浮液。悬浮液于4 000 r/min离心20 min,准确量取5 mL上清液移入凯氏消化管中,进行凯氏定量测定,计算ASN占干酪总氮(total nitrogen,TN)的比例(ASN/TN)。非蛋白氮(non-protein nitrogen,NPN)的测定:准确称取1.50 g干酪样品,加入25 mL质量分数12%的三氯乙酸溶液,充分研磨,制成悬浮液。悬浮液于4 000 r/min离心20 min,准确量取5 mL上清液移入凯氏消化管中,进行凯氏定量测定,计算NPN占干酪总氮的比例(NPN/TN)。每个样品做3 次平行。
1.3.6 干酪质构的测定
质构的测定参考Innocente等[12]的方法,将干酪切割为20 mmh20 mmh20 mm的立方体,在室温((25f2)℃)下平衡1 h后进行质构测试。干酪质构采用质地剖面分析(texture profile analysis,TPA)二次下压法测定,具体测试参数:测试前探头行进速率为1 mm/s,测试中探头行进速率为1 mm/s,探头回程的行进速率为5 mm/s,采用应变测试模式,压缩比为75%;两次压缩间隔时间为5 s;触发力为5.0 g;探头为p/5;数据获取率为200 pulses/s;每个样品至少平行测试3 次。干酪的硬度、黏着性、内聚性、弹性、胶性以及咀嚼性等质构参数采用质构仪自带的软件Exponent 5.0进行处理获取。
1.3.7 电子鼻测定风味的变化
参考Kalit等[13]的方法并进行适当修改,即精确称取每份质量为(2.00f0.01)g样品,切碎后分别装入20 mL顶空瓶中,在室温下平衡20 min,充分产生顶空挥发气体。样品密封,通过顶空抽样方式检测,每个样品做3 次平行。采用PEN-3型便携式电子鼻进行测定,电子鼻传感器阵列包括10 个高灵敏度加热型金属氧化物检测器传感器,载气为干燥空气,流速为300 mL/min,清洗时间为180 s,样品测试时间为60 s,通过软件记录每秒的响应值,每个样品信息图共有10 条曲线,选取传感器相应信号曲线平稳处4 个响应值作为样品信息采集点,得到原始数据,然后用Winmuster 1.6.2软件进行主成分分析。
1.3.8 固相微萃取-气相色谱-质谱联用测定风味物质
样品前处理:参考Lee等[14]的方法,每个样品分别称取(5.00f0.01)g,将块状样品切碎后放入特制的顶空瓶中,迅速盖上盖子,在60 ℃水浴中平衡30 min。将已老化的固相微萃取头(聚二甲基硅氧烷(polydimethylsiloxane,PDMS),100 μm)从瓶盖中插入样品瓶中,用手柄将石英纤维头推出暴露于顶空的气体中进行萃取吸附30 min,然后将纤维头退回到萃取头内,拔出萃取头。将萃取吸附了顶空气体组分的萃取头插入气相色谱-质谱联用进样器中,测得定性结果。
色谱和质谱条件。色谱条件:色谱柱为DB-WAX弹性石英毛细管柱(30 mh0.25 mm,0.25 μm);载气为氦气,流速0.8 mL/min,恒速;多阶段程序升温,起始温度40 ℃,保持30 min,以6 ℃/min升温至130 ℃,再以8 ℃/min升温至230 ℃,保持8 min,进样口温度为250 ℃,不分流。质谱条件:正离子电子轰击,发射电流为200 μA,电子能为70 eV,接口温度为250 ℃,源温度为200 ℃,检测电压为350 V。
1.3.9 挥发物的定性及定量测定
定性测定:将挥发物质谱图与NIST标准谱库进行匹配,仅报道正、反匹配度大于800(最大值为1 000)的鉴定结果。挥发物的保留指数(retention index,RI)通过化合物与两种紧靠它的作为标准物的正构烷烃来标定,设其中一个碳原子数为n,计算公式如公式(1)。

式中:tR(n)、tR(n+1)、tR(x)分别为碳原子数为n的正构烷烃、碳原子数为n+1的正构烷烃、挥发物的保留时间。
定量测定:将1 μL含量为890 mg/g的内标物四氢呋喃加入5 g样品中,通过计算待测挥发物与内标物的峰面积比求得待测挥发物含量(假定各挥发物的绝对校正因子为1.0),计算如式(2)所示。

式中:A待测挥发物/A内标物为待测挥发物与内标物的峰面积比;m内标物为内标物质量(1 μg);m样品为样品质量(5 g)。
1.4 数据处理与分析
响应质构参数和风味物质参数的方差分析由SPSS 24.0软件完成,显著性分析采用单因素方差分析中的最小显著性差异法进行,P≤0.05表示差异显著。
2 结果与分析
2.1 原料乳品质分析结果
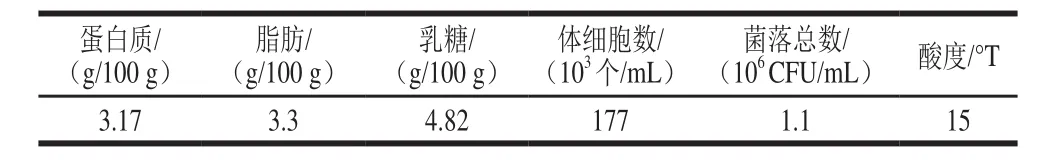
表 1 原料乳成分及新鲜度测定结果Table 1 Composition and freshness of raw milk
查阅GB 19301ü2010《食品安全国家标准 生乳》,该原料乳成分及新鲜度符合该标准的要求,可用于干酪加工。
2.2 两种干酪成熟期水分质量分数和蛋白水解度分析结果
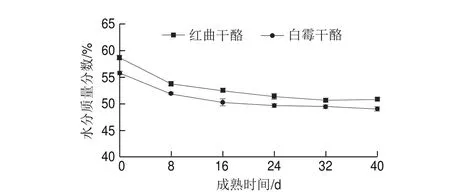
图 1 两种干酪不同成熟时间的水分质量分数的变化Fig. 1 Changes in water content of two cheeses with ripening time

图 2 两种干酪不同成熟时间的ASN/TN的变化Fig. 2 Changes in acid soluble nitrogen to total nitrogen ratio of two cheeses with ripening time
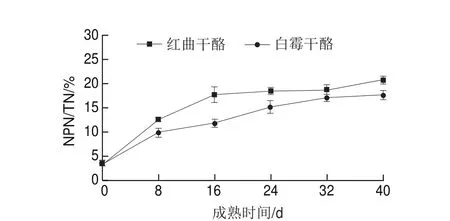
图 3 两种干酪不同成熟时间的NPN/TN的变化Fig. 3 Changes in non-protein nitrogen to total nitrogen ratio of two cheeses with ripening time
由图1可知,在成熟期间两种干酪的水分质量分数都在不断降低,且前16 d下降速率较快,16 d后用蜡纸包装干酪并放入4 ℃冰箱成熟保存,水分质量分数仅有少量降低。干酪在刚脱离模具时,水分质量分数较高,其内部还有少部分乳清没有完全排出,在表面进行盐渍后,表面渗透压较高,也促进内部的残余乳清在表面析出,在成熟期的前2 d,培养箱相对湿度设定为80%~85%,使干酪表面逐渐干燥,从而有益于霉菌孢子的快速生长。由图1可知,加入红曲霉发酵液后干酪的水分质量分数有一定的提高,这是因为红曲霉在发酵液中分解淀粉产生大量的糖类物质,而糖类物质大多具有很强的吸水性,故红曲干酪的水分质量分数高于白霉干酪。
蛋白水解对于干酪成熟期质地和风味有着重要作用,因此,蛋白水解程度被认为是干酪成熟的一个指标。一般来说,蛋白水解指数通常用pH 4.6 ASN和NPN占干酪TN的比例来表示。干酪中蛋白的水解主要由发酵剂中微生物代谢产生的蛋白酶、牛乳自身微生物产生的蛋白酶以及干酪中残余的凝乳酶催化进行的。ASN/TN是蛋白初级水解的指标,pH 4.6环境下的ASN主要由干酪内部残余的凝乳酶催化蛋白水解产生的,也有部分来源于微生物产生的蛋白酶催化产生;NPN/TN是蛋白次级水解的指标,NPN含量与干酪中的霉菌和细菌产生的蛋白酶有关[15]。由图2、3可知,随着成熟时间的延长,两种干酪的ASN/TN和NPN/TN不断增加,说明蛋白的初级和次级水解程度都在不断加剧。成熟初期微生物尤其是霉菌不断生长产生大量蛋白酶,加速蛋白水解,成熟16 d之后干酪在4 ℃环境下微生物生长受到一定的抑制,蛋白酶活力也有一定的下降,蛋白水解速率逐渐下降。加入红曲霉后在一定程度上提高了蛋白的初级和次级水解度,这可能是由于加入的红曲霉不仅自身可以产生一些蛋白酶促进蛋白水解,而且其发酵液中含有的糖类氨基酸能营养物质也可以促进其他霉菌和细菌的生长。
2.3 两种干酪成熟期质构的分析
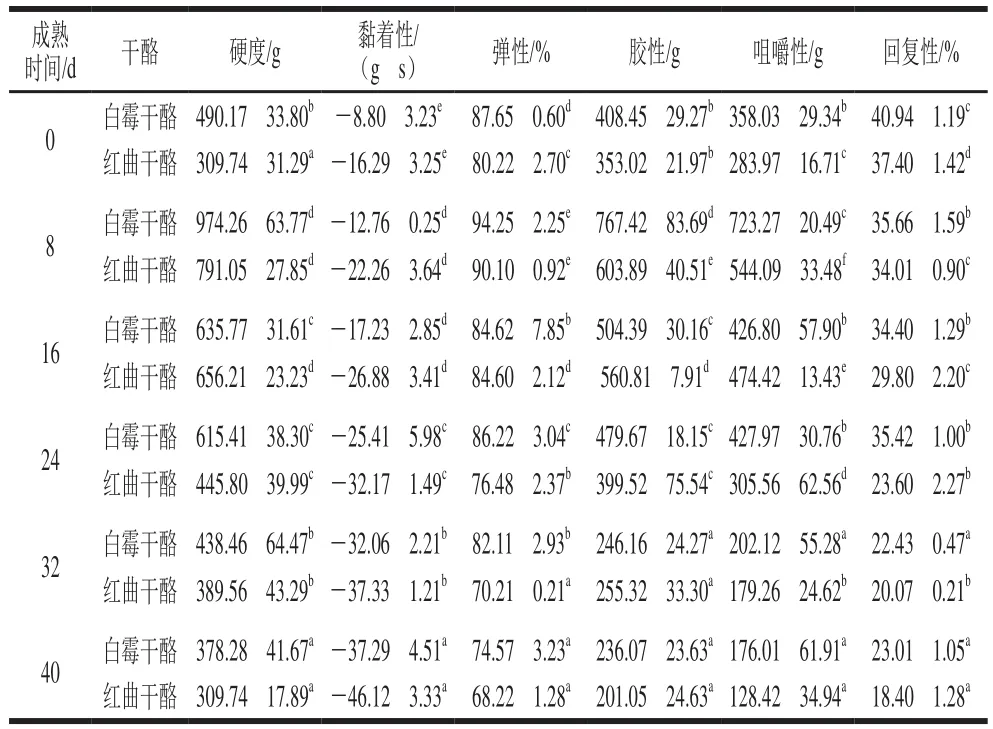
表 2 两种干酪成熟期间质地特性的变化Table 2 Changes in texture parameters of cheeses during ripening
从表2可知,在干酪刚脱离模具时,红曲干酪的硬度、弹性、胶性和咀嚼性均小于白霉干酪而黏着性则大于白霉干酪,这是由于红曲干酪在凝乳前加入了红曲霉发酵液,发酵液中红曲霉生长到一定阶段其菌丝相互缠绕形成球状,在凝乳过程中对蛋白胶束的形成产生一定的阻碍,使得其初期的硬度、弹性及相关指标低于白霉干酪。发酵液中含有大量的淀粉类物质,经过一段时间的发酵淀粉被水解产生一部分糖类,使其黏着性较高。随着成熟期延长,两种干酪的硬度在0~8 d不断增加,8 d后呈下降的趋势。牛乳的酶凝过程可以分为两个阶段:首先是凝乳酶水解稳定酪蛋白结构的κ-酪蛋白,形成副酪蛋白和糖巨肽,当足够的κ-酪蛋白被水解后,就会发生非酶二级反应即酪蛋白凝聚;酪蛋白通过凝集形成蛋白质三维空间网络结构,并通过脱水收缩使结构变得更加致密,形成一定硬度及弹性的干酪粒[16-17]。干酪在刚脱离模具的时候水分质量分数较高,硬度也较小。由水分质量分数结果可知,在前8 d的成熟期内,干酪的水分质量分数降低较快而硬度增加;在成熟期的第6天,开始有白霉在干酪表面生长,再经过2~3 d,干酪表面会被一层致密的白色绒毛状的菌丝包裹,霉菌生长到一定阶段会代谢产生蛋白酶使干酪中的酪蛋白胶束发生水解,蛋白空间网络结构强度和刚度降低,因此其硬度开始减小[18-19]。弹性表征干酪受到外力作用后恢复其原有形状的能力,干酪的弹性在0~8 d有一定的增加,在成熟期的第8~40天随成熟时间的延长呈下降趋势,后期下降速率趋于平缓。引起这一变化的原因是在成熟初期干酪内部有较多的孔洞,蛋白质的结构完整,酪蛋白胶束高度交联,使干酪表现出较好的弹性,而伴随成熟时间的延长,霉菌产生的蛋白酶使部分蛋白水解,孔洞逐渐消失,干酪的弹性也在逐渐下降[20]。黏着性中的负号代表测试探头受到的作用力方向向下,与大小无关。从表2中可以看出,两种干酪黏着性随成熟时间的延长逐渐增大,因为随着成熟时间的延长,霉菌产生的蛋白酶和脂肪酶使蛋白质不断水解,大分子分解形成小分子物质,二者形成的小分子物质不断融合,发生交联现象,导致干酪的黏着性随着成熟期的延长逐渐增加[15]。
胶性是干酪的整体属性,咀嚼性表征咀嚼过程中能量的整体消耗,胶性和咀嚼性是二次特性,二者均与硬度成正比,因此变化趋势和硬度相似,这与于华宁等的实验结果一致[16]。成熟初期(0~8 d)胶性和咀嚼性由于水分质量分数减少,硬度增大而增大,随着成熟期延长,蛋白质水解和脂肪降解的程度越来越高,干酪质地变得柔软,其咀嚼性和胶性都呈下降趋势。回复性表示干酪受压后迅速恢复形变的能力,随着成熟时间的延长,酪蛋白水解过程持续进行,干酪的组织逐渐被破坏,因此回复性呈下降趋势。
将两种干酪各项质构数据对比分析发现,在相同的成熟时间,红曲干酪的硬度、弹性、胶性、咀嚼性和回复性要低于白霉干酪,产生这种差异的原因可能是红曲霉发酵液中含有一些淀粉等大分子物质,这些物质加入牛乳后在干酪凝乳过程对酪蛋白胶束的聚集产生一定阻碍,影响了酪蛋白空间网状结构的形成,使孔洞数量减少,进而造成其硬度、弹性、胶性、咀嚼性和回复性一定程度减小,干酪总体呈现柔软质地。对比两种干酪的黏着性参数,在相同的成熟时间,红曲干酪的黏着性高于白霉干酪,这可能是由于红曲霉在以马铃薯为碳源的培养基中会产生很多的糖化酶,从而分解淀粉产生糖类物质,糖类物质具有较高的黏性,所以发酵液加入到干酪中会提高干酪的黏着性,而高黏着性对产品光滑、均匀的质地更加有利。因此,与白霉干酪相比,红曲干酪口感更柔软、质地更加均匀,表现出更优良的质构特性。
2.4 电子鼻分析两种干酪成熟期的整体风味特性变化

图 4 两种干酪不同成熟时间(0~40 d)的电子鼻主成分分析图Fig. 4 Principal component analysis of electronic nose data for two cheeses with different ripening times (0-40 d)
电子鼻通过模拟人类和动物嗅觉工作原理对检测气味进行分析,与其他分析方法不同的是,电子鼻得到的不是样品中某一种或几种组分的定性定量结果,而是能捕捉到样品中挥发性成分的整体信息[21]。将电子鼻对两种干酪在40 d成熟期内6 个时间点检测的风味参数进行主成分分析,结果如图4所示。PC1和PC2贡献率和为92.33%,大于90%,说明这两个主成分已经代表了样品的主要信息特征。从图4中可以看出,白霉干酪风味变化主要在第一主成分轴上,而红曲干酪风味在第二主成分轴上有较大变化。从成熟期的变化来看,白霉干酪和红曲干酪未开始成熟的风味及其成熟期风味变化的方向都存在着明显差异。此外可以看出两种干酪在成熟中期(16~24 d)的风味较为相似,随成熟时间进一步延长,两种干酪风味向不同的方向变化,因此成熟后期两种干酪的风味存在较大差异。
2.5 两种干酪不同成熟期风味物质分析结果
对两种霉菌干酪不同成熟期的挥发性风味物质进行了气相色谱-质谱分析。由表3~6可知,白霉干酪共检出44 种化合物,包括11 种酸、9 种酮、10 种醇、8 种酯和6 种其他化合物;红曲干酪共检出47 种化合物,包括12 种酸、10 种酮、10 种醇、8 种酯和7 种其他化合物。随成熟时间延长,两种干酪各类物质总量的变化趋势相似,但在种类和含量上均存在不同程度的差异。
2.5.1 酸类化合物
酸类干酪中的酸类化合物主要有3 种来源,包括脂肪水解、蛋白水解和乳糖发酵[7]。直链脂肪酸(碳原子数大于4)是脂肪水解的产物,而支链酸(如2-甲基丙酸或3-甲基丁酸)主要是蛋白水解产生的氨基酸通过去氨基作用形成的化合物,醋酸和丙酸是乳糖发酵过程中的代谢产物[21]。鉴定出的酸类化合物主要是一些短链和中链脂肪酸,这些有机酸都曾被报道为干酪中的重要气味物质[22],大多数酸类化合物含量在成熟过程中存在统计学差异(P<0.05)。由表3可知,来源于脂肪水解的羧酸(丁酸、己酸、庚酸、辛酸、壬酸、癸酸、十四酸和月桂酸)含量最丰富,占酸类化合物总含量的90%以上,由此可以看出白霉干酪和红曲干酪的酸类化合物主要来自脂肪水解所产生的脂肪酸。羧酸本身不仅是香气化合物,而且还是其他重要风味化合物的前体,如甲基酮、醇、内酯、醛和酯[23]。由图5可知,在成熟期前16 d,羧酸类物质的含量一直增加,16 d之后逐渐开始下降。因为在成熟前期,微生物快速增长,大分子物质水解生成脂肪酸的速率加快,脂肪酸含量上升,随着成熟时间延长,部分脂肪酸作为前体物质被消耗,且12 d后成熟温度降低为4 ℃,脂肪酶活性下降,脂肪酸代谢速率低于生成速率,因此出现降低趋势。短链和中间链羧酸被认为是风味形成的关键因素,而且每种脂肪酸都有其特有的风味,其中偶数脂肪酸因其较低的感知阈值对干酪整体气味有更大的贡献,其中乙酸、己酸、丁酸、甲基丁酸和辛酸是Camembert干酪最有效的气味剂。甲基丁酸与丁酸具有典型的汗味、奶酪味,己酸是一种脂肪分解产生的短链羧酸,具有辛辣和酸味,辛酸具有酸味和汗味,是山羊奶酪的典型的香气物质[24-25]。乙酸和丙酸含量在成熟期24 d一直增长,之后开始有少量的降低,说明在干酪成熟过程中负责乳酸代谢的微生物在成熟期前期的活性可能更强,成熟期后期温度降低为4 ℃且霉菌大量生长,乳酸代谢受到一定的抑制,且后期乙酸和丙酸作为前体合成其他风味物质。乙酸和丙酸在白霉干酪中的含量明显高于红曲干酪,可能是红曲霉代谢产物的存在一定程度上抵制了乳酸菌的生长。红曲干酪中的2-甲基丁酸、3-甲基丁酸含量显著高于白霉干酪,由蛋白水解度的测定结果可知,红曲干酪中红曲霉的加入促进了干酪中的蛋白水解。红曲干酪中丁酸、己酸、月桂酸含量显著高于白霉干酪,而辛酸、癸酸含量却低于白霉干酪。红曲霉在干酪中的应用研究较少,根据以上结果,结合相关文献分析,红曲酶的加入对有机酸的影响可能主要有3 个方面:第一是其存在对干酪中的产乙酸和丙酸的细菌可能具有一定的抑制作用,有研究报道红曲霉可以产生一些抑菌物质[10];第二是红曲霉自身产生蛋白酶和脂肪酶可能加速干酪中蛋白和脂肪的水解,有关红曲霉代谢酶类的研究主要是针对糖化酶和酯化酶,对于蛋白酶和脂肪酶的研究较少,尤其是其应用于干酪中的代谢途经还有待进一步研究;第三是红曲发酵液中的一些红曲代谢产物,如红曲色素、红曲多糖、莫纳卡琳-K等物质的存在对Camembert青霉的生长和代谢以及脂肪水解的环境具有一定的影响,这些因素都会影响最终脂肪酸产物的含量。且随成熟期的延长,有机酸逐渐被用于合成为甲基酮、酯类等物质,脂肪酸含量的差异也可能与其在酯化反应中的利用率有关。

表 3 两种干酪不同成熟时间的有机酸类挥发性风味物质Table 3 Volatile organic acid profiles of two cheeses with different ripening times ng/g
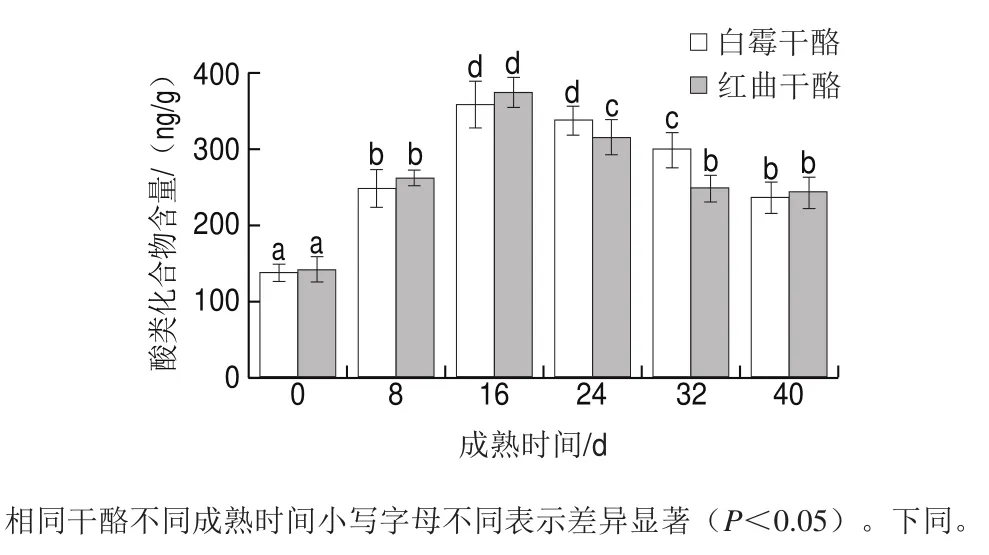
图 5 两种干酪不同成熟时间的酸类化合物的含量变化Fig. 5 Changes in acid contents of two cheeses with different ripening times
2.5.2 酮类化合物
酮类化合物由于其典型的气味和低气味阈值在表面霉菌成熟型干酪的风味形成中起着十分关键的作用。由图6可知,随成熟时间延长,两种干酪的酮类化合物含量不断增加。由表4可知,在两种干酪中鉴定出的酮类均为甲基酮,甲基酮是霉菌干酪挥发性成分中含量最多的中性化合物,特别是在Camembert干酪和蓝纹干酪中[26]。这类物质通常有奇数个碳链(C3~C15),除了2-羟基丁酮外,碳原子为偶数的甲基酮在表面霉菌成熟型干酪中含量很少。2-戊酮、2-庚酮、2-辛酮、2-壬酮、2-癸酮是表面成熟型干酪的特征风味物质[27]。甲基酮是以脂肪酸为前体合成的,脂肪酸经酶催化氧化生成β-酮酸,β-酮酸去羰基生成少一个碳原子的甲基酮[28],故甲基酮的含量与相应的脂肪酸含量有关,由表3、4对比发现,甲基酮与相应的脂肪酸的含量变化多呈负相关,因为产物的生成,即意味着前体物质被消耗。将两种干酪酮类化合物含量对比发现,其中含量最多的是2-庚酮、2-壬酮,其次是2-丁酮、2-十一酮。红曲干酪中2-丁酮、2-十一酮、2-十三酮含量明显高于白霉干酪,而壬酮、辛酮、癸酮、癸烯酮含量低于白霉干酪,红曲霉对于干酪中甲基酮的影响与脂肪水解产生的脂肪酸前体含量差异有着直接的关系。如白霉干酪中的辛酸含量较高,其合成的相应甲基酮(2-壬酮)在白霉干酪中总体高于红曲干酪;在红曲干酪中月桂酸的含量较高,其合成的十一酮在红曲干酪含量总体也高于白霉干酪。因此在酮类化合物中红曲干酪含有的水果香气物质更多,而白霉干酪含有的奶香味物质更多。2-戊酮、2-十一酮和2-十三酮具有典型的水果香气;2-壬酮、2-辛酮、2-羟基丁酮是产生牛乳香气的主要物质,表现为热牛乳味和黄油味,因此酮类也是大多数乳制品的主要风味;庚酮与霉菌干酪蘑菇味和坚果味的产生有关,壬烯酮、癸烯酮则会给干酪带来一种焙烤的香气[29]。

表 4 两种干酪不同成熟时间的酮类挥发性风味物质Table 4 Volatile ketone profiles of two cheeses with different ripening times ng/g
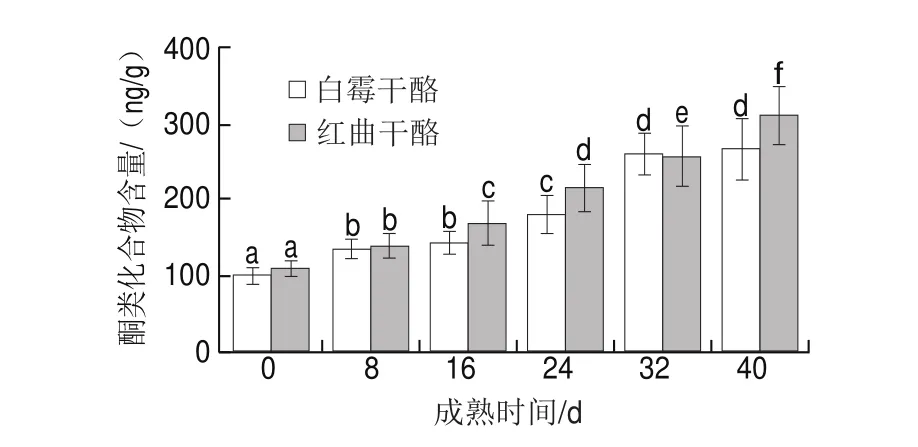
图 6 两种干酪不同成熟时间的酮类化合物的含量变化Fig. 6 Changes in ketone contents of two cheeses with different ripening times
2.5.3 醇类化合物

表 5 两种干酪不同成熟时间的醇类挥发性风味物质Table 5 Volatile alcohol profiles of two cheeses with different ripening times

图 7 两种干酪不同成熟时间的醇类化合物的含量变化Fig. 7 Changes in alcohol contents of two cheeses with different ripening times
由图7可以看出,随着成熟时间延长,两种干酪中的醇类化合物含量在前16 d快速增加,16 d之后开始逐渐下降,在成熟期后期,虽然两种干酪中醇类化合物含量都开始下降,但是红曲干酪中的醇类化合物降低速率显著低于白霉干酪。在40 d成熟期,红曲干酪中醇类化合物含量一直显著高于白霉干酪(P<0.05)。霉菌软质干酪中具有典型的醇类化合物主要是1-辛烯-3-醇、苯乙醇、甲基丁醇和丁二醇。1-辛烯-3-醇在霉菌干酪中含量较高且阈值低,迄今为止被认为是Camembert干酪和蓝纹干酪产生蘑菇味的主要香气物,但其含量过高,干酪也会产生不良的风味[30]。由表5可知,随成熟时间延长,1-辛烯-3-醇在两种干酪中不断积累,含量逐渐增加,白霉干酪中1-辛烯-3-醇的含量比红曲干酪中略高一些。Kubícková等发现,当在干酪中加入相应的辛烯酮后,这种蘑菇味的强度会随之增大[31]。苯乙醇有典型的花香和蜂蜜香气[32],在白霉干酪成熟第8天含量达到最大值,之后含量逐渐下降;而在红曲干酪中苯乙醇含量在第16天达到最大值,之后含量变化较小,红曲干酪醇类总含量显著高于白霉干酪的主要原因是其含有较高含量的苯乙醇(表5)。
在两种干酪中含量比较高的仲醇是2-庚醇和2-壬醇,其具有乙醇香气,其含量变化与相应甲基酮的变化相关。2,3-二丁醇是两种干酪中唯一鉴定出的二级醇,具有水果香气,它在干酪成熟期前16 d含量较高,之后含量开始下降,且在红曲干酪中的含量显著高于白霉干酪。2,3-二丁醇含量与相应甲基酮(2-丁酮)的含量呈正相关,由表4可知,红曲干酪中2-丁酮含量较高,所以红曲干酪中二丁醇含量也高于白霉干酪。
2.5.4 酯类化合物
大多数酯类都有花香和果香,而且可以减少脂肪酸和胺所带来的辛辣和苦味。由图8可以看出,两种干酪中酯类化合物随成熟时间延长含量不断增加,到32 d之后含量逐渐稳定,不再增加,甚至还有少量的下降。目前认为干酪中乙酯合成方式多以酯化反应和醇解反应为主,其中需要利用的酶体系分别为酯酶和醇酰基转移酶。Malcata等发现在一些乳酸菌、酵母菌或霉菌的参与下,还有其他途径可以生成乙酯类物质,如酸解反应和酯交换反应[33]。奶酪随成熟时间延长乙酯含量经常呈现下降趋势,因为酯酶水解酯生成醇和酸等物质。Liu等发现植物乳杆菌和嗜热链球菌可以水解短链和中链酯类化合物[34];Fenster等发现乳酸菌、霉菌和酵母中酯酶还能水解烷基酯类化合物[35];干酪中酯类化合物的积累取决于酯的合成和水解,其最终平衡点主要依靠反应环境,如水分活度、底物浓度等,而这些因素处于动态变化中,因此酯类化合物含量也处于一种动态平衡。由表6可以看出,两种干酪鉴定出的酯类化合物主要是内酯和乙酯类化合物。内酯是一种环状酯,其是由醇酸通过分子间酯化形成的一种环状结构,α-内酯和β-内酯不稳定,通常作为有机物合成过程的中间产物,γ-内酯和σ-内酯比较稳定,不容易分解,内酯具有很强的芳香气味,虽然这些气味并不是真正的干酪风味,但它们与干酪风味的形成有很大的关系[36]。在两种干酪中鉴定出的内酯有两种,分别是σ-癸内酯和σ-十二内酯,具有椰子味和黄油味,σ-癸内酯是白霉干酪在未成熟时唯一检测到的酯类,随成熟时间延长,白霉干酪中内酯含量比较稳定,红曲干酪成熟后期内酯含量一定程度增加。乙酯类化合物尤其是C2~C10的乙酯类化合物,使奶酪拥有果香风味,如苹果、香蕉、菠萝等特征风味,对奶酪整体风味的平衡起促进作用。根据目前的研究报道,奶酪中常见的乙酯类化合物有乙酸乙酯、丁酸乙酯、己酸乙酯、辛酸乙酯和癸酸乙酯,在不同种类的奶酪中,乙酯种类和含量差异很大[37]。由表6可知,在成熟过程中红曲干酪中酯类化合物含量总体高于白霉干酪,产生这一结果的原因一是红曲干酪在未成熟时即含有较多的酯类,这可能是由于初期加入的红曲霉发酵液中本身含有一些酯类化合物。除此之外红曲霉代谢可以产生较多酯酶,有研究表明红曲霉产生的酯酶在白酒酿造过程中促进了己酸乙酯、辛酸乙酯等芳香味物质的合成,故其常用于白酒酿造中以提高其感官品质。此外由2.5.3节分析可知红曲干酪中还含有较多的醇类化合物,这些因素都促进了酯类化合物的合成,故红曲干酪中的己酸乙酯、辛酸乙酯、癸酸乙酯的含量显著高于白霉干酪。

表 6 两种干酪不同成熟时间的酯类挥发性风味物质Table 6 Volatile ester profiles of two cheeses with different ripening times
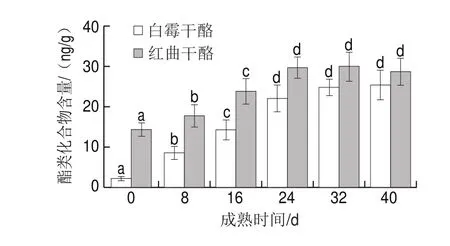
图 8 两种干酪不同成熟时间的酯类化合物的含量变化Fig. 8 Changes in ester contents of two cheeses with different ripening times
2.5.5 其他化合物
在两种霉菌干酪中还发现了一些其他化合物,包括戊醛、苯乙醛、癸五烯、右旋柠檬烯、甲苯、丁羟基甲苯、癸烷、辛烷、醋酸铵。醛是一种不稳定的化合物,由于能迅速还原为初级醇或氧化成相应的酸而不积聚在奶酪中。苯甲醛具有坚果味,是由色氨酸和苯丙氨酸转化形成,对干酪整体的良好风味有重要作用。右旋柠檬烯是萜类物质,具有柠檬、橘子的香气。甲苯、丁羟基甲苯等苯环类化合物的形成可能与色氨酸、苯丙氨酸的转化有关,这些物质含量高时会带来一些不良的风味。烃类和醋酸盐对于风味的贡献很小,这些物质在干酪中含量很低,大多仅在成熟期的某段时间被检出。
3 结 论
本实验以Camembert干酪的制作工艺为基础,制作两种不同的Camembert干酪:一种将从腐乳中分离的红曲霉作为辅助发酵剂加入干酪中;另一种不加入红曲霉作为对照。通过对两种霉菌干酪质构和风味成分的测定,探究红曲霉作为辅助发酵剂对Camembert干酪成熟期质构和风味变化的影响。结果表明,加入红曲霉后,干酪的水分质量分数和蛋白水解度有一定的提高,干酪的黏着性提高,而硬度、弹性、胶性、咀嚼性和回复性降低,说明加入红曲霉后干酪口感更柔软、质地更加均匀。通过电子鼻对两种干酪不同成熟期整体香气轮廓的变化进行分析,随成熟期延长,白霉干酪和红曲干酪未开始成熟的风味以及其成熟期风味变化的方向都存在明显差异,但红曲干酪初期的风味与白霉干酪后期的风味在整体香气轮廓上较为接近。通过固相微萃取-气相色谱-质谱联用对两种干酪的挥发性物质进行定性定量分析,将鉴定出的主要挥发性风味物质分为有机酸类、酮类、醇类和酯类物质,针对其成熟期的含量变化以及两种干酪风味变化的差异性进行分析。结果表明,红曲霉的加入对于干酪成熟期4 类风味物质的总体变化趋势影响较小,但其对于不同风味物质的含量有一定的影响。加入红曲霉后,各类有机酸的含量都有一定的改变,其具体影响的代谢途径还有待进一步研究。红曲霉对有机酸含量的变化也直接影响了以其为前体合成的甲基酮类、醇类和酯类物质的合成,还有红曲霉代谢产生的酯酶对于酸类和醇类的利用以及己酸乙酯、辛酸乙酯等酯类物质的合成具有重要影响。这些物质含量差异会使红曲干酪相比白霉干酪奶香味(壬酮、辛酮、壬烯酮、癸酮等)、蘑菇味(1-辛烯-3醇)物质含量较少而果香味(2-丁酮、2-十一酮、己酸乙酯、辛酸乙酯、癸酸乙酯)花香和蜂蜜香味(苯乙醇、丁二醇等)物质含量较多。

